На современном этапе развития фетальной хирургии намечается тенденция к более широкому использованию фетоскопического доступа по сравнению с открытым. Отработка техники на животных позволила сделать шаг от «открытых» вмешательств на плоде, то есть путем гистеротомии, к миниинвазивным методикам [1]. Преимущественно показанием для хирургических вмешательств являются проблемы монохориальной многоплодной беременности. Все чаще показаниями для оперативного вмешательства становятся врожденные пороки развития не только внутренних органов, но и сердца. Используя современные методы медикаментозной поддержки, удается обеспечить безопасность для матери, однако нарушение целостности биологических мембран сопровождается риском преждевременных родов. Высокая эффективность проводимых фетальных операции при фето-фетальном трансфузионном синдроме по сравнению с консервативным лечением привело к широкому внедрению хирургических вмешательств на плоде во многих клиниках мира.
Общие положения о хирургии плода и условия проведения вмешательств
Применение во время беременности современных методов эхографии, магнитно-резонансной томографии и инвазивных исследований позволяет диагностировать внутриутробную патологию плода на ранних сроках гестации. При некоторых состояниях возможно проведение лечения после рождения. В других случаях предпочтительно лечение во время беременности, то есть плод становится пациентом. Воздействие может быть этиотропным, когда это невозможно, осуществляют лечение угрожающих жизни плода состояний, проводят профилактику повреждения органов, при этом более радикальные меры откладывают до момента рождения.
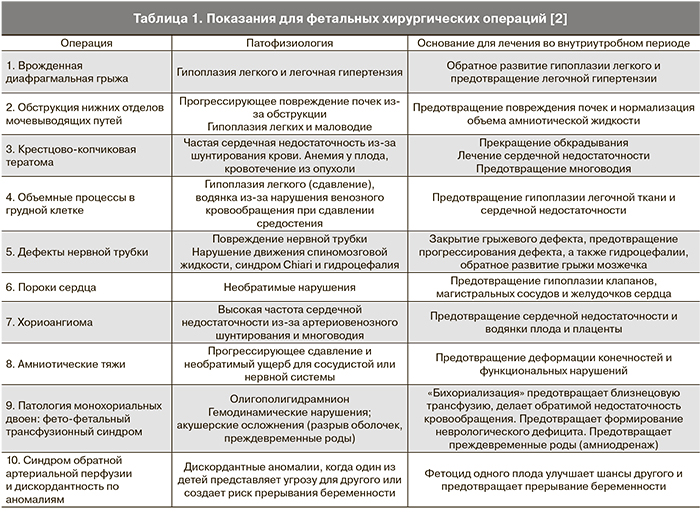
Некоторые редкие состояния могут требовать более обширных вмешательств и не могут быть выполнены без обеспечения хорошего доступа к плоду путем гистеротомии или эндоскопии. Нарушение маточно-амниотического барьера сопровождается потенциальными осложнениями, такими как риск преждевременных родов, реже – инфицирования, отслойки плаценты и разрыва матки. Из-за наличия риска для матери и плода Международным обществом фетальной медицины и хирургии разработаны критерии для применения такого рода вмешательств [2]: 1) наличие точного диагноза и прогноза; 2) отсутствие эффективных методов лечения заболевания после рождения; 3) наличие экспериментальных данных об эффективности вмешательства во внутриутробном периоде и его безопасности. Вмешательство следует осуществлять строго по протоколу бригадой врачей различных специальностей, хорошо знакомых с техническими аспектами операции. Изначально фетальную хирургию использовали при угрозе жизни плода, но затем стали применять также при таких состояниях, как патология плаценты, аномалии развития, то есть в случаях, когда возможно потенциальное снижение частоты потери плода (табл. 1).
На практике фетальная хирургия отличается в США и Европе. Открытая фетальная хирургия относительно редко применяется в Европе, за исключением операций на плаценте [3]. Это в большей степени связано с отношением перинатологов, а не с региональными различиями в характере заболеваемости. И напротив, американские центры относительно редко применяют фетоскопию [4, 5]. В последние годы происходит активное внедрение внутриутробных вмешательств при врожденных пороках сердца. При наличии у плода врожденного порока сердца используется пункционная методика, при которой доступ к матке и сердцу плода осуществляется через иглу, под ультразвуковым контролем, что является впечатляющим достижением при лечении данной патологии [6, 7].
Открытые хирургические вмешательства на плоде выполняют под общим обезболиванием беременной, поскольку анестетики угнетают сократительную способность матки [8]. Плоду дополнительно могут вводить анальгетики, анестетики и миорелаксанты [9]. Концепция о боли у плода некоторыми авторами подвергается сомнению. Тем не менее, разумно предпринимать превентивные меры при потенциально «болезненных» внутриутробных хирургических вмешательствах. На сегодняшний день предложено несколько протоколов анестезиологического пособия при фетальной хирургии [10–12]. Чаще всего клиницисты придерживаются политики назначения плоду анальгетиков при процедурах, когда он может испытывать боль, начиная со срока 18–20 недель беременности. Если мать подвергается общему обезболиванию, у плода достигается обезболивание анальгетиками, поступающими трансплацентарно, и дополнительное обезболивание плода не требуется [8]. Доступ в матку осуществляется путем широкой лапаротомии и гистеротомии, края раны на матке клипируют для предотвращения кровотечения. Плод частично выводится в рану, во время операции осуществляют мониторирование его состояния. В большинстве случаев для мониторинга достаточно фиксации пульсоксиметра к ручке плода. После операции пациентку наблюдают в палате интенсивной терапии, проводя массивный токолиз, который в настоящее время редко сопровождается побочными эффектами.
Открытая хирургия плода
В современной медицине плода спектр патологий, подвергающихся открытым операциям, значительно сужен. Существуют единичные наблюдения о попытках выполнения операций связанных с патологией сердечно-сосудистой системы плода, но в основном открытые операции у плода выполняются при аденоматозе легкого, миеломенингоцеле и крестцово-копчиковой тератоме.
Врожденная кистозная аденоматоидная мальформация легкого
Для планирования лечебных мероприятий при аденоматозе легкого и предсказания вероятности гибели плода используется соотношение размеров поражения с окружностью головки плода (CCAM Volume Ratio – CVR) [13]. Когда CVR превышает 1,6, имеется 80% риск развития водянки плода, а вероятная гибель плода оправдывает хирургическое вмешательство [14, 15]. Мать также подвергается риску из-за опасности возникновения так называемого зеркального синдрома, или синдрома Баллантайна [16, 17]. При естественном течении, на сроке более 32 недель производят родоразрешение, для плодов на более ранних сроках гестации спасительным может оказаться хирургическое вмешательство. В ходе хирургического вмешательства кистозную полость можно пунктировать или выполнить шунтирование из миниинвазивного доступа. Исследование, проведенное в Детском госпитале Филадельфии, демонстрирует 23 случая шунтирования при аденоматозе легкого. Срок беременности на момент операции составил 21–22 недели, а на момент родов – 36,3 недели. Выживаемость детей, по данным авторов, составила 74% [18, 19, 21]. Клиницистами из Филадельфии опубликованы 22 наблюдения лобэктомии, при преимущественно солидном варианте аденоматозной дисплазии. Торакотомию у плода выполняли между 21-й и 31-й неделями гестации, причем 11 детей выжили и нормально развиваются [20]. Антенатальная гибель плода происходила из-за синдрома Баллантайна (n=1), преждевременных родов и/или хорионамнионита (n=2). 6 детей погибли во время операции и 2 – после операции из-за тяжелых гемодинамических расстройств. Для предотвращения смерти плода во время операции необходимо обеспечивать адекватное мониторирование и использовать возможности его реанимации.
Лечение миеломенингоцеле
Дефекты нервной трубки хорошо поддаются диагностике во внутриутробном периоде и часто не приводят к гибели плода [22]. Однако нельзя недооценивать смертность и проблемы со здоровьем у родившихся детей. Смертность при стволовой дисфункции составляет 35%, 81% детей с гидроцефалией нуждаются в лечении. Более чем 70% детей имеют IQ>80, но только 37% могут вести независимую жизнь во взрослом периоде жизни, поскольку у большинства имеется расстройство тазовых функций и паралич нижних конечностей [23]. На сегодняшний день имеются доказательные экспериментальные и клинические данные, что внутриутробная хирургия миеломенингоцеле улучшает исходы [24, 25]. К настоящему времени эффективность внутриматочного вмешательства изучена только в исследовании NIH-MOMS (Management Of Myelomeningocele Study) [26]. Это исследование показало, что риск для матери является приемлемым, в том числе риск отека легких при использовании современных токолитиков. Имеется риск разрыва матки, потребности в гемотрансфузии (2,2%) и обструкции кишечника. Преждевременные роды при сроке менее 30 недель наступают в 10–15% наблюдений, у некоторых больных развивается маловодие. Ятрогенный риск перинатальной смерти составляет 3–6% [27, 28].
Крестцово-копчиковая тератома
Является наиболее часто встречающимся новообразованием у новорожденных, при этом его легко можно диагностировать до родов. Состояние плода зависит от размеров новообразования и скорости его роста с соответствующими метаболическими последствиями: может развиться анемия, опухоль может функционировать как большая артерио-венозная фистула с формированием тяжелой сердечной недостаточности. Наиболее распространенными последствиями являются: многоводие, вызывающее преждевременные роды, водянка плода и внутриутробная гибель плода из-за нарушения сердечной деятельности. Самым частым осложнением у матери является развитие зеркального синдрома. На сегодняшний день нет единого мнения о том, что считать признаками плохого прогноза, оправдывающими хирургическое вмешательство. Группы исследователей из Сан-Франциско и Филадельфии считают признаками плохого прогноза водянку плода и плацентомегалию [29, 30]. Тем не менее, эта закономерность не оценивается статистически как достоверная [31]. По заключению британских авторов, если опухоль небольшая (менее 7 см), и ее наличие не сопровождается функциональными проблемами, беременность можно вести консервативно. При опухолях большего размера или при их выраженной васкуляризации необходимо тщательное наблюдение для выявления признаков быстрого роста, оценки объема амниотической жидкости, допплерометрических показателей деятельности сердца и кровотока в самом новообразовании [32]. Таким образом, водянка и плацентомегалия или другие признаки декомпенсации свидетельствуют о плохом прогнозе заболевания. Этиотропное воздействие направлено непосредственно на опухоль или ее сосудистую сеть. Американские клиницисты описали 4 случая открытого иссечения опухолей, расположенных преимущественно вне полости таза. Срок беременности на момент родов составил в среднем 29 недель, 3 ребенка выжили [33]. У одного ребенка после рождения отмечалось сужение прямой кишки в месте наложения швов, прочие осложнения можно отнести за счет воздушной эмболии. У одного выжившего имелось поражение легких вследствие недоношенности (27,6 недели). Также у одной женщины развился отек легких. В литературе имеются единичные наблюдения применения малоинвазивной технологии с целью блокады кровотока в сосудах, питающих опухоль. Большинство клиницистов использует для этих целей лазер фетоскопическим доступом. Описано также применение термокоагуляции и радиочастотной аблации, но при этом возможно нарушение коллатерального кровотока [30, 33]. Эмболизация сосудов с применением пункционного доступа может стать альтернативой, при этом возможно введение спирта [30], гистоакрила [34] или спиралей для эмболизации. Однако на сегодняшний день ни одна из процедур не является полностью безопасной в отношении развития осложнений беременности и преждевременных родов. Требуются дальнейшие исследования и разработка оптимальной технической базы.
Врожденные пороки сердца
Большинство врожденных пороков сердца хорошо переносятся во внутриутробном периоде и не приводят к развитию сердечной недостаточности у плода. Наиболее неблагоприятными являются пороки с обструкцией аортального и легочного клапанов, которые приводят к гипоплазии прилежащего желудочка. Выраженный аортальный стеноз приводит к дилатации желудочка и гипертрофии его стенки, ишемическим и фиброзным изменениям в ней. В случаях, осложненных утолщением межпредсердной перегородки и преждевременным закрытием открытого овального окна, страдает легочный кровоток и возникает водянка плода, что сопровождается риском внутриутробной смерти в 80% [35]. Эти данные оправдывают фетальные кардиохирургические вмешательства, которые, как правило, выполняются при рестриктивном открытом овальном окне или его закрытии, стенозе/атрезии аортального или легочного клапанов.
Процедура баллонной атриосептостомии (процедура Рашкинда) при интактной межпредсердной перегородке или рестриктивном открытом овальном окне
Рестриктивное открытое овальное окно встречается приблизительно у 7% плодов с транспозицией магистральных сосудов и у 22% – с синдромом гипоплазии левых отделов сердца. Операцию возможно выполнить под эхо-контролем с помощью баллона или радиочастотной аблации. Критериями необходимости операции являются рестриктивность межпредсердного сообщения по данным пульсового Допплера [36, 37]. В литературе описаны единичные случаи атриосептостомии у плода, 1 из 17 (6%) умер внутриутробно, 9 (53%) – умерло после рождения и 7 (41%) выжили [38].
Баллонная вальвулопластика аортального клапана
Необходимость вмешательств у плода вызвана тем, что при уменьшении обструкции левого желудочка улучшается его опорожнение и соответственно уменьшается перегрузка желудочка, увеличивается кровоток через левые отделы сердца и предотвращается переход критического стеноза аортального клапана в синдром гипоплазии левых отделов сердца. Операция выполняется пункционной методикой под ультразвуковым контролем (рисунок).
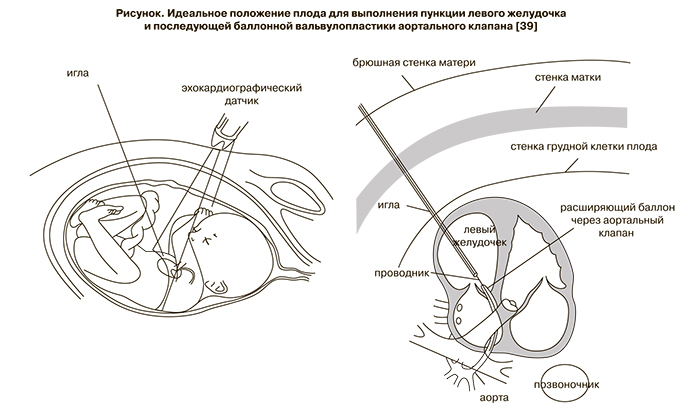
Критерии отбора пациентов четко не сформулированы. Противоречия относительно оптимальных показаний к операции сводятся к тому, что операция должна быть выполнена до формирования синдрома гипоплазии левых отделов сердца. Однако эхокардиографические критерии превращения стеноза аорты в синдром гипоплазии левых отделов сердца четко не описаны.
Маtsui и соавт. освещают 6 исследований аортальной вальвулопластики, в которые вошли 66 плодов [39]. Исходы следующие: 13 (20%) – погибли, 2 (3%) – прерывание беременности, 10 (15%) – смерть после рождения, 38 (57%) – выжили.
Таким образом, на сегодняшний день нет единого мнения о четких диагностических критериях перехода критического аортального стеноза в синдром гипоплазии левых отделов сердца. Для предотвращения гипердиагностики и превышения показаний к внутриутробной баллонной вальвулопластике аортального клапана требуются дополнительные экспериментальные и клинические исследования.
Баллонная вальвулопластика легочного клапана при атрезии легочной артерии с интактной межжелудочковой перегородкой
Цель операции – декомпрессия правого желудочка и предупреждение гипоплазии правого желудочка и дилатации правого предсердия. Критериями отбора являются: выраженная трикуспидальная регургитация, нарушение кровообращения плода и водянка плода [40–43]. Последние исследования немногочисленны и демонстрируют малое число наблюдений. Это связано с тем, что все предпочитают докладывать лишь о хороших результатах, поэтому эффективность операций может быть переоценена. Относительным ограничением широкого распространения внутриутробных кардиохирургических вмешательств является то, что до сих пор неясно, связан ли неблагоприятный исход хирургии с самой процедурой или с другими причинами.
Заключение
Подводя итоги, можно сказать, что открытые фетальные вмешательства представляют большой научный и практический интерес, однако в силу высокого риска имеют ограниченное применение в клинической практике. Требуется накопление доказательной базы эффективности подобных вмешательств.
Основной проблемой, ограничивающей применение пункционных вмешательств при врожденных пороках сердца, является отсутствие четких критериев для выполнения подобных процедур у плода. Есть единичные исследования, которые показывают, что кардиохирургические операции у плодов технически осуществимы, позволяют лучше расти желудочкам, улучшают функцию сердца и предотвращают/уменьшают обструкцию. Хорошие результаты таких исследований вдохновляют на дальнейшие мультицентровые исследования, которые должны ответить на вопрос, существуют ли четкие эхографические критерии показаний к подобным операциям.



