Коронавирусная инфекция, вызванная новым штаммом вируса SARS-CoV-2 (в настоящее время классифицируется как COVID-19), впервые выявленная в декабре 2019 г. в Ухане, Китайская Народная Республика, способствовала значительному росту смертности во многих странах. Наряду с дыхательной недостаточностью, распространенным нарушением у пациентов с COVID-19 является коагулопатия, о чем свидетельствует повышение уровня фибриногена, Д-димера в плазме крови [1].
Основная клиническая проблема, связанная с COVID-19, – тяжелая, интерстициальная пневмония. Это воспалительное состояние, являющееся следствием персистенции вируса в легочных тканях, приводит к серьезному нарушению системы гемостаза, которое наблюдается у пациентов с данной инфекцией. У больных коронавирусной инфекцией баланс в системе гемостаза сдвинут в сторону гиперкоагуляции, которая приводит к тромбозу микроциркуляторного русла, тромбоэмболии легочных артерий (ТЭЛА), тромбозу глубоких вен нижних конечностей [2]. Тяжелейшим проявлением коагулопатии является синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), характеризующийся уменьшением количества тромбоцитов, удлинением протромбинового времени и активированного частичного тромбопластинового времени (АЧТВ), повышением концентрации Д-димера, снижением уровня фибриногена, а также антитромбина III [3].
Механизм коагулопатии у пациентов с COVID-19 является многокомпонентным. Влияние инфекции SARS-CoV-2 на коагуляцию и фибринолиз регулируется провоспалительными цитокинами, такими как ИЛ-1-β, ФНО-α и ИЛ-6. Повышение провоспалительных цитокинов в сыворотке крови пациентов с COVID-19 обусловлено активацией врожденного и адаптивного звеньев иммунитета в ответ на поражение многих клеток организма: альвеолоцитов I типа, кардиомиоцитов, холангиоцитов печени, колоноцитов толстой кишки, кератиноцитов пищевода, эпителиальных клеток желудка, подвздошной и прямой кишки, проксимальных канальцев почек, мочевого пузыря. Дисфункция эндотелиальных клеток, вызванная инфекцией, приводит к избыточному образованию тромбина и подавлению фибринолиза, что указывает на состояние гиперкоагуляции [4]. Также при коронавирусной инфекции поражение эндотелиальных клеток кровеносных сосудов ведет к их активации и гибели. В результате происходит высвобождение в кровь тканевого фактора и фактора Виллебранда (VWF), что приводит к повышенной активации протромбиназы по внешнему пути свертывания путем активации VII фактора свертывания. В свою очередь, за счет повышенного в крови уровня VWF более активно происходит адгезия тромбоцитов к коллагену I и III типа в местах повреждения эндотелия через GP1b на мембране тромбоцитов. В местах тромбообразования происходит экзоцитоз плотных гранул, содержащих низкомолекулярные соединения, такие как АДФ, АТФ, серотонин, ионы кальция и магния, ГДФ, ГТФ и др. и α-гранул, содержащих VWF, фибриноген, фибронектин, тромбоспондин, факторы свертывания, фибринолиза и антикоагулянты (плазминоген, протеин S), провоспалительные цитокины и хемокины (тромбоцитарный фактор 4, ß-тромбоглобулин). Это приводит к аутоактивации тромбоцитов и изменению профиля экспрессии их поверхностных рецепторов. Таким образом, можно выделить основные звенья, влияющие на развитие коагулопатии: повышение уровня фибриногена, повышение уровня провоспалительных цитокинов, активация эндотелия, выброс тканевого фактора и VWF, активация тромбоцитов.
Экспертами Международного общества тромбоза и гемостаза (ISTH) были опубликованы рекомендации о терапии коагулопатии у пациентов с COVID-19, в которых предлагалось рассмотреть применение профилактических доз низкомолекулярного гепарина (НМГ) у всех пациентов с COVID-19, а также регулярный скрининг таких показателей, как АЧТВ, протромбин по Квику, уровень фибриногена, Д-димера и ATIII [5]. Однако, несмотря на наличие исследований, отмечающих высокий процент тромбоэмболических осложнений у пациентов с COVID-19 [6, 7], а также на связь микротромбирования сосудов легких с развитием острого респираторного дистресс-синдрома (ОРДС) [8], до сих пор не выработаны единые критерии назначения антикоагулянтной профилактики, терапии и мониторинга показателей плазменного гемостаза у таких пациентов, а также не выработаны критерии, позволяющие спрогнозировать тяжелое течение вирусной пневмонии, не определена связь между изменением показателей плазменного гемостаза и течением болезни. Поэтому целью данной работы была оценка состояния плазменного гемостаза у пациентов с различной тяжестью течения COVID-19.
Материалы и методы
В исследование были включены 46 пациентов, госпитализированных в инфекционный госпиталь на базе ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России в период с 23.04.2020 по 26.05.2020. Идентификацию SARS-CoV-2 проводили методом РТ-ПЦР. Критериями включения пациентов в исследование служили согласие пациента на исследование и подтвержденный диагноз COVID-19, критериями исключения – беременность, неподтвержденный диагноз COVID-19, несоблюдение протокола и преаналитического этапа исследования.
Пациенты были стратифицированы по степени тяжести на 4 группы в соответствии с временными методическими рекомендациями МЗ РФ по профилактике, диагностике и лечению новой коронавирусной инфекции, версия 7 от 03.06.2020: легкое течение, среднетяжелое течение, тяжелое течение, крайне тяжелое течение [9]. Критерии стратификации: легкое течение – температура (Т) тела <38°C, кашель, слабость, боли в горле. Отсутствие критериев среднетяжелого и тяжелого течения. Среднетяжелое течение – Т тела >38 °C, частота дыхательных движений (ЧДД) >22/мин, одышка при физических нагрузках, изменения при компьютерной томографии (КТ), типичные для вирусного поражения (объем поражения минимальный или средний, КТ 1–2), SpO2<95%, С-реактивный белок (СРБ)>10 мг/л. Тяжелое течение – ЧДД>30/мин, SpO2≤93%, PaO2/FiO2≤300 мм рт. ст., снижение уровня сознания, ажитация, нестабильная гемодинамика (систолическое АД менее 90 мм рт.ст. или диастолическое АД менее 60 мм рт.ст., диурез менее 20 мл/ч), острая дыхательная недостаточность с необходимостью респираторной поддержки, изменения в легких при КТ, типичные для вирусного поражения (объем поражения значительный или субтотальный; КТ 3–4), лактат артериальной крови >2 ммоль/л, qSOFA >2 баллов. Крайне тяжелое состояние – острая дыхательная недостаточность с необходимостью респираторной поддержки, септический шок, полиорганная недостаточность, изменения в легких при КТ, типичные для вирусного поражения критической степени (объем поражения значительный или субтотальный, КТ 4) или картина ОРДС.
Клинико-лабораторный мониторинг проводили ежедневно. Взятие крови осуществляли утром, натощак из периферической вены c помощью закрытых систем для взятия венозной крови S-Monovette® (Sarstedt, Германия) для определения количества тромбоцитов (PLT) с антикоагулянтом К3ЭДТА, для коагуляционных тестов с цитратом натрия (3,2%) в соотношении 1:9. Цитратную плазму, бедную тромбоцитами, получали путем центрифугирования в течение 15 мин при 3000 об/мин. В полученной плазме проводили определение следующих показателей: АЧТВ, протромбин по Квику, концентрация Д-димера, фибриногена и ATIII. Определение показателей гемостаза осуществлялось на автоматическом коагулометре ACLTOP 700 (Instrumentation Laboratory, Werfen, USA) количество тромбоцитов – на автоматическом гематологическом анализаторе SYSMEX XT-4000 (Sysmex, Japan).
Статистический анализ
Для проверки нормальности распределений использовался критерий Колмогорова–Смирнова. В результатах представлены медианы значений и интерквартильный размах (25–75%). Для сравнения статистической значимости различий медиан показателей между группами наблюдения был использован непараметрический критерий Манна–Уитни при помощи программного обеспечения IBM – SPSS Statistics. Критическая величина уровня значимости при интерпретации результатов статистического анализа p=0,05. Для выявления пороговых значений Д-димера и антитромбина III, после преодоления которых будет наблюдаться неблагоприятный исход, использовался метод ROC-кривых при помощи программного обеспечения MedCalc.
Результаты и обсуждение
Из 46 пациентов, включенных в исследование, мужчин было 28 (60,9%), женщин 18 (39,1%). Средний возраст мужчин составил 61,5 (53,5–67,5) года, женщин 64,5 (57–73) года. Вредные привычки в виде курения имели 4 пациента (8,7%). Диагнозы гипертоническая болезнь в анамнезе имели 22 пациента (48%), сахарный диабет 1-го типа: 2 пациента (4,3%), сахарный диабет 2-го типа: 6 пациентов (13%). Индекс массы тела (ИМТ), соответствующий нормальным значениям от 18,5 до 24,99, наблюдался у 8 пациентов (17,4%), дефицит массы тела с ИМТ от 16,5 до 18,49 – у 1 пациента (2,2%), с избыточной массой тела, ИМТ от 25 до 29,99 – у 21 пациента (45,6%). Ожирение наблюдалось у 16 пациентов (34,7%), из них с ИМТ от 30 до 34,99 – 10 пациентов (21,7%), с ИМТ от 35 до 39,99 – 5 пациентов (10,9%), с ИМТ >40 – 1 пациент (2,2%). Все пациенты проживали на территории Москвы или Московской области.
В результате проведенного исследования не выявлено отличий показателей АЧТВ и протромбина по Квику у пациентов с коронавирусной инфекцией от нормальных значений (р>0,05), которые составляли 30,3 (27,4-35,2) секунд для АЧТВ и 75 (70,2–82,5)% для протромбина по Квику. Даже у пациентов с крайне тяжелым течением COVID-19, с развившимся ДВС-синдромом, не наблюдалось удлинения АЧТВ и снижения протромбина по Квику. Эти результаты согласуются с данными литературы, в которых говорится об особенном течении ДВС-синдрома у пациентов с COVID-19, при котором крайне редко наблюдается удлинение АЧТВ и снижение протромбина по Квику во второй и третьей фазе течения ДВС-синдрома [10, 5].
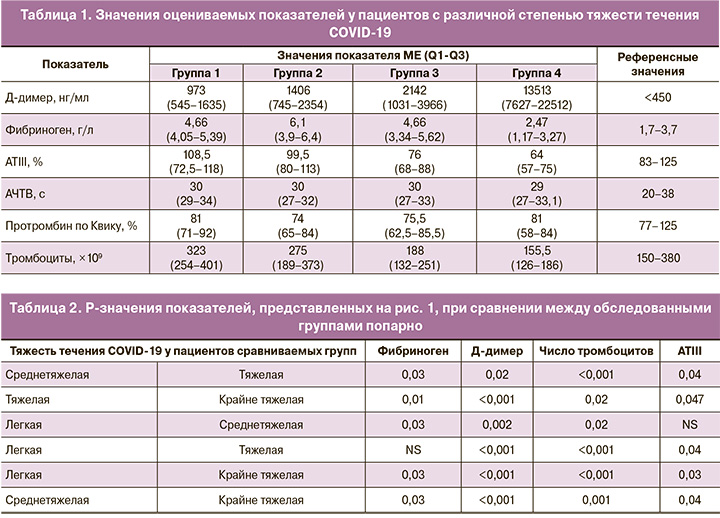
При оценке концентрации Д-димера (рис. 1А, табл. 1) было показано, что в 100% случаев у пациентов с подтвержденным диагнозом COVID-19 наблюдалось повышение значений более 450 нг/мл. При этом степень возрастания уровня данного маркера была прямо пропорциональна нарастанию тяжести течения заболевания. Это говорит о том, что во время ухудшения состояния пациентов развивается коагулопатия, ведущая к гиперкоагуляции, в результате которой происходит образование тромбов внутри сосудистого русла, одновременно активируется система фибринолиза, расщепляющая фибриновые сгустки до продуктов деградации фибрина, которыми являются Д-димеры. У пациентов с крайне тяжелым течением COVID-19 концентрация Д-димера составляла более 13000 (7627–22 512) нг/мл, что является высоким риском развития ТЭЛА [11]. В данном исследовании в крайне тяжелом состоянии находились 6 пациентов, 5 из которых погибли и 1 пациент выздоровел. Данное наблюдение говорит о необходимости регулярного мониторинга концентрации Д-димера у пациентов в тяжелом и крайне тяжелом состояниях.

В результате мониторинга уровня Д-димера установлено, что у пациентов с неблагоприятным исходом наблюдалось повышение концентрации Д-димера на 5–10-е сутки наблюдения до 6500–7000 нг/мл (рис. 2). Было определено, что если на 5–10-е сутки течения COVID-19 концентрация Д-димера превышала 3633 нг/мл, то со специфичностью 92,3% и чувствительностью 100% наступал неблагоприятный исход, AUC=0,9, р=0,001, прогностическая ценность положительного результата 99,1%, негативного – 100%. Это согласуется с исследованиями других авторов [12].
 Полученные нами результаты согласуются с опубликованными ранее данными, в которых выявлено 2–3-кратное увеличение Д-димера у пациентов, находившихся в ОАР [13]. В результате многоцентрового ретроспективного исследования в Китае показано, что концентрация Д-димера существенно различалась в группе погибших и выживших пациентов, и повышение концентрации Д-димера более 1000 нг/мл статистически значимо связано с неблагоприятным исходом (р<0,01) [2]. Приведенные факты хорошо соотносятся с полученными нами данными о существенных различиях в показателях Д-димера между группами с разной тяжестью течения COVID-19.
Полученные нами результаты согласуются с опубликованными ранее данными, в которых выявлено 2–3-кратное увеличение Д-димера у пациентов, находившихся в ОАР [13]. В результате многоцентрового ретроспективного исследования в Китае показано, что концентрация Д-димера существенно различалась в группе погибших и выживших пациентов, и повышение концентрации Д-димера более 1000 нг/мл статистически значимо связано с неблагоприятным исходом (р<0,01) [2]. Приведенные факты хорошо соотносятся с полученными нами данными о существенных различиях в показателях Д-димера между группами с разной тяжестью течения COVID-19.
Уровень фибриногена у пациентов с разной тяжестью течения COVID-19 представлен на рис. 1В и в таблице 1. Фибриноген является маркером острой фазы воспаления. У всех групп, за исключением группы крайне тяжелого течения, наблюдалась гиперфибриногенемия. В начале заболевания происходило повышение уровня фибриногена в плазме крови и его накопление, своего пика показатель достигал у пациентов в среднетяжелом состоянии и составлял 6,1 (3,9–6,4) г/л. Далее, когда течение перетекало в тяжелую форму, начиналась, по-видимому, фаза «потребления», и накопленный фибриноген расходовался на образование фибриновых сгустков. В результате происходило уменьшение фибриногена в плазме.
Похожую динамику можно наблюдать в результатах мониторинга количества тромбоцитов (рис. 1C, табл. 1). Снижение тромбоцитов является показателем тяжести течения COVID-19 [15]. Уменьшение уровня тромбоцитов пропорционально увеличению тяжести течения инфекции. Как и в ситуации с фибриногеном, начиная со времени, когда у пациентов происходило нарастание степени тяжести до средней – начиналось потребление тромбоцитов.
Все 46 обследованных пациентов находились на антикоагулянтной профилактике высокими дозами НМГ. По данным литературы, во время течения коронавирусной инфекции происходит снижение уровня ATIII [16], что блокирует адекватное действие НМГ, а также затрудняет подбор дозировок НМГ. Ввиду этого необходим не только регулярный мониторинг уровня ATIII, но и своевременное его восполнение. Мониторинг уровня ATIII представлен на рисунке 1D и в таблице 1. У пациентов с легким и среднетяжелым течением COVID-19 уровень ATIII был нормальным: 108,5% (72,5–118%) и 99,5% (80–113%) соответственно. У пациентов с тяжелым и крайне тяжелым течением значения ATIII были ниже нормы и составляли 76% (68–88%) и 64% (57–75%) соответственно. Определено, что если уровень ATIII во время течения инфекции COVID-19 опускается ниже 70,8%, то со специфичностью 80% и чувствительностью 85,5% (p<0,001) наступает неблагоприятный исход, AUC=0,85, прогностическая ценность положительного результата 30,5%, негативного – 96,1%. На сегодняшний день немного исследований посвящено изучению концентрации АТIII при течении COVID-19. Сообщается как о снижении [8], так и о почти нормальных уровнях АТIII у пациентов COVID-19 [17]. Однако большинство исследователей сообщают о значимой разнице в показателях естественных антикоагулянтов в группе выживших и погибших пациентов.
Заключение
В данной работе показана зависимость между показателями плазменного гемостаза (Д-димер, фибриноген, антитромбин III), а также количеством тромбоцитов и тяжестью течения коронавирусной инфекции COVID-19. В случае тяжелого и крайне тяжелого течения необходим ежедневный мониторинг данных показателей ввиду их динамического изменения. Крайне важен мониторинг уровня антитромбина III для проведения успешной антикоагулянтной профилактики НМГ. Также показана прогностическая ценность концентрации Д-димера и антитромбина III в отношении исхода заболевания.



