Изучение микробиоты является актуальной темой для современной медицины, поскольку микробные сообщества оказывают колоссальное влияние на функционирование желудочно-кишечного тракта и иммунной системы [1]. Актуален этот вопрос и в отношении микрофлоры младенцев. Новорожденные дети рождаются с практически стерильным кишечником. Микробиота кишечника у них формируется постепенно и уже к 2–3 годам стабилизируется и становится похожей на микробиом взрослого человека [2]. Считается, что критичным периодом для правильного формирования микробиоты кишечника являются первые месяцы жизни младенца. Рядом исследователей показано, что дисбиоз в этот период жизни может быть связан с поздними осложнениями и, в частности, с нарушением формирования нормальной иммунной системы.
Значительная часть микробов попадает к ребенку от матери посредством тактильного контакта, а также за счет бактерий, находящихся в молоке [2]. Ряд факторов может нарушить процесс нормального заселения кишечника новорожденных бактериями матери. Из наиболее распространенных можно выделить рождение с помощью кесарева сечения, прием антибиотиков в первые дни жизни ребенка, замену грудного молока искусственными смесями [2].
Микробиота матери меняется во время беременности. Высказываются предположения, что эти изменения адаптивны и направлены на компенсацию увеличения энергозатрат матери и плода [3]. В работе [4] было показано, что у детей, матери которых принимали антибиотики во II или III триместре, риск ожирения был на 84% выше по сравнению с детьми, матери которых не принимали антибиотики.
Влияние здоровья матери на здоровье новорожденного
Здоровье роженицы вносит существенный вклад в процесс формирования микробиоты кишечника новорожденного [5]. Ассоциация заболеваний матери и состояния здоровья ребенка зависит от многих причин и включает генетические, эпигенетические и экологические воздействия.
Активно изучается влияние метаболического синдрома матери на здоровье ребенка. Эксперименты на грызунах, обезьянах и исследования на людях выявили влияние ассоциации ожирения или питания с высоким содержанием жиров во время беременности на состояние иммунной системы и микробиоту новорожденных [6]. Наблюдаемые изменения увеличивали предрасположенность детей к ожирению.
Наличие у беременной женщины диабета 1 или 2 типа увеличивает риск неблагоприятных исходов: необходимости оперативного вмешательства, преждевременных родов, преэклампсии, макросомии, врожденных дефектов у новорожденного [7].
Нарушения работы щитовидной железы матери могут стать причиной когнитивных нарушений у ребенка, поскольку гормоны щитовидной железы играют важную роль в своевременном формировании нервной системы [8, 9]. Гипотиреоз (длительный недостаток гормонов щитовидной железы) плода, возникающий вследствие нехватки йода у матери, может привести к развитию ряда патологий у ребенка: кретинизма с сильной отсталостью, глухоты, нарушению походки. Более того, материнский гипертиреоз многократно увеличивает акушерский риск, способствует низкому весу ребенка, а также в худшем варианте может привести к гибели плода или преждевременным родам [10, 11]. Также некоторые генетические заболевания щитовидной железы могут вызвать патологию в рецепторах гормонов, что, в свою очередь, может привести к повышенной чувствительности к хорионическому гонадотропину человека и резистентности к тиреоидным гормонам.
Заболевания надпочечников у матери могут замедлить развитие плода, а также способствовать возникновению ряда негативных последствий. Было показано, что гиперальдостеронизм (повышенная секреция альдостерона) ассоциирован с повышением артериального давления у детей, что также может спровоцировать развитие гипертонии [12]. Также известно, что повышенный синтез андрогенов может способствовать развитию преэклампсии [13], увеличению риска преждевременных родов и рождению детей с критически низким весом [14].
Как уже упоминалось ранее, различные заболевания, возникшие в эндокринной системе матери, также могут привести к преждевременным родам и недоношенности плода. Существует множество факторов, повышающих этот риск: возраст старше 40 лет, плохое питание, низкий вес, травмы шейки матки, сильный стресс, курение, напряженная работа, короткий интервал между беременностями и т.д. Недоношенность является фактором риска детской заболеваемости и смертности и связана с высоким риском бактериальных воспалительных заболеваний, таких как сепсис и некротизирующий энтероколит (НЭК). Такие дети имеют не до конца сформированный кишечник с недоразвитой перистальтикой, барьерной функцией и иммунитетом, что делает его потенциальным источником инфекций и воспалений [15]. Недоношенные дети, по сравнению с рожденными в срок, зачастую имеют нестабильный и менее разнообразный состав микробиоты кишечника [16]; это может способствовать заселению микрофлоры, находящейся в медицинской организации, в том числе внутрибольничных условно-патогенных и патогенных штаммов. Ряд исследований на небольших группах детей показал, что как НЭК, так и поздний сепсис связаны с изменениями в микробиоте [17], и при этом состав микробиоты коррелирует с клинической картиной [18].
Недоношенные дети, рожденные путем кесарева сечения, не контактируют c микробиомом влагалища матери, что не позволяет им получить необходимые микроорганизмы для нормального развития собственной микрофлоры. Нередким явлением для них является рождение с очень низкой массой тела, при которой кормление производится специальными стерильными питательными смесями вместо грудного молока матери. Кроме того, недоношенных детей первое время содержат в специальных отделениях, где риск развития патологических процессов, ассоциированных с дисбиозом, намного выше [19].
Наиболее часто курс антибактериальной терапии недоношенным новорожденным назначается для лечения предполагаемой неонатальной инфекции, однако в части случаев это не является оправданным, а служит лишь профилактической мерой. Исследования показали, что использование антибиотиков оказывает значимые воздействия на метаболом новорожденных [20].
Отметим, что, помимо заболеваний матери, на формирование здоровой микрофлоры ребенка влияет и процесс послеродового восстановления. Так, исследование [21] показало, что соблюдение специальных послеродовых условий способствует развитию правильной микрофлоры младенца. В этом же исследовании показано, что попадание в микробиом патогенных микроорганизмов и чрезмерное использование пробиотиков у здоровых новорожденных может спровоцировать развитие условно-патогенных агентов. Однако рациональная модификация микробиоты пробиотиками или грудным молоком может снизить риск развития НЭК у недоношенных детей [22]. Аналогичный положительный эффект будет оказывать назначение курса пробиотиков матери [23].
Таким образом, совокупность всех перечисленных факторов не позволяет сформироваться здоровой микробиоте младенца, а напротив, способствует развитию патогенных микроорганизмов. Метагеномные анализы микробиома младенцев показали, что в образцах кала недоношенных детей превалируют представители условно-патогенной микрофлоры: Enterobacteriaceae, Enterococcus, Staphylococcus [24].
Вопрос о влиянии патологий матери на формирование здоровой микробиоты детей практически никак не описан в литературе, особенно в отношении недоношенных детей, что вызывает особый интерес вследствие специфики колонизации микробиома. По этой причине целью нашей работы стала оценка влияния патологий эндокринной системы матери на процесс формирования микрофлоры у недоношенных младенцев.
Материалы и методы
Дизайн исследования
В период 2019–2020 гг. обследовано 59 детей, родившихся в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. В исследование были включены недоношенные дети со сроком гестации 25–36 недель, доношенные новорожденные 37–39 недель, рожденные от матерей с патологией эндокринной системы (заболевания щитовидной железы или сахарный диабет), и дети, рожденные от матерей без эндокринных нарушений (контрольная группа). В исследование не включали детей, рожденных от матерей с сопутствующим хроническим воспалительным процессом или онкологическими заболеваниями, а также получавших антибактериальную терапию во время беременности. Всем детям в соответствии с имеющимися клиническими рекомендациями проводилась одинаковая тактика ведения и выхаживания, вне зависимости от наличия или отсутствия эндокринной патологии у матери. Недоношенные дети с экстремально низкой, очень низкой и низкой массой тела, а также доношенные дети, имеющие дыхательные нарушения, которые требовали проведения респираторной поддержки, наблюдались в отделении реанимации и интенсивной терапии новорожденных. По показаниям детям проводились инфузионная, антибактериальная, симптоматическая, поддерживающая терапия, парентеральное и энтеральное питание. При выхаживании недоношенных детей использовались современные методы выхаживания, включающие соблюдение охранительного режима и раннее начало грудного вскармливания. Минимальное энтеральное питание сцеженным материнским молоком начинали с первого дня жизни. Охранительный режим включал соблюдение температурного режима, минимизацию болевых процедур и снижение воздействия шума, прямых лучей света, придание ребенку удобного положения в кювезе/кроватке, а также обязательный материнский уход и соблюдение санитарно-эпидемиологического режима. После стабилизации состояния новорожденные переводились на 2-й этап выхаживания, в отделение патологии новорожденных и недоношенных детей. Часть детей получали пробиотическую терапию.
Все матери подписывали информированное согласие на забор клинического материала.
У недоношенных детей собирались образцы кала в 4 временных точках: первый стул после рождения (меконий); стул через 1 неделю после рождения; стул через 2 недели после рождения; стул через месяц после рождения.
Сбор образцов
Образцы кала недоношенных младенцев собирались в пластиковые контейнеры и хранились в низкотемпературном морозильнике при -80°C. Транспортировка образцов в лабораторию осуществлялась на сухом льду.
Выделение ДНК
Выделение ДНК из образцов проводили с помощью набора QIAamp Fast DNA Stool Mini (Qiagen) согласно инструкции производителя. ДНК растворяли в 50 мкл буфера и хранили при температуре –18°С.
Приготовление библиотек и секвенирование
Для проведения метагеномного анализа бактериального сообщества использовали регион V3–V4 гена 16S pРНК. Приготовление библиотеки для секвенирования проводилось в соответствии с протоколом (16S Metagenomic Sequencing Library preparation) для MiSeq, Illumina. Секвенирование полученной библиотеки проводили на приборе MiSeq (Illumina), используя набор парных прочтений 2×250 b с добавлением 8% Phix в качестве контроля.
Обработка данных
Таксономический анализ проводился при помощи программы DADA2 [25]. Для дальнейшего анализа применялся язык R: для подсчета индекса альфа-разнообразия Шеннона применялась функция diversity из пакета vegan; для статистического анализа применялся тест Вальда, реализованный в пакете DeSEQ2 [26]; за значимые принимались различия, для которых p-value после поправки на множественное сравнение было меньше 0,05, значимость оценивалась для сравнения представленности бактерий у детей, рожденных от матерей с наличием либо отсутствием эндокринных заболеваний; подсчет расстояний для многомерного шкалирования проводился на основе метрики Брея–Кертиса при помощи пакета phyloseq [27].
Результаты
Всего в исследование вошли 143 образца кала, для которых был проведен метагеномный анализ. В анализ было включено 85 образцов с количеством прочтений выше 2,000.
Анализ альфа-разнообразия
На рисунке 1 показаны кривые прореживания, отражающие зависимость индекса альфа-разнообразия Шеннона от количества прочтений при выборе части от полного набора прочтений для каждого образца. Видно, что при количестве прочтений выше 2,000 практически выходят на плато. Образцы с количеством прочтений менее 1,000 были исключены из анализа.
Последующая обработка данных была направлена на выявление отличий в составе микробиоты кишечника младенцев, рожденных от матерей с эндокринными заболеваниями, от контрольной группы.
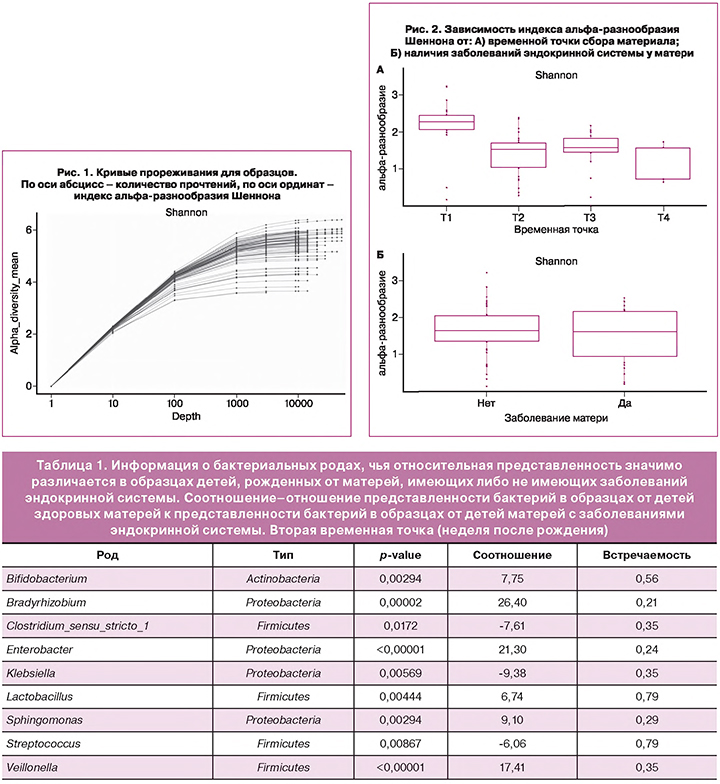
Анализ альфа-разнообразия сообществ
Разнообразие сообществ (индекс Шеннона) образцов кала было максимальным в первой временной точке (меконий), минимальным – во второй временной точке (неделя после рождения) (рис. 2А). Мы не обнаружили значимых различий в альфа-разнообразии у детей при наличии либо отсутствии эндокринных заболеваний у их матерей (рис. 2Б).
Анализ таксономического состава образцов
На рисунке 3 показано распределение таксономических профилей образцов по двум первым главным компонентам. Видно, что образцы, собранные в первой временной точке (меконий), значительно отличаются от образцов, собранных в последующих временных точках.

На рисунке 4 показана тепловая карта таксономических профилей собранных образцов, на которой также приведены данные о наличии заболеваний эндокринной системы у матери, недели рождения, оперативное родовспоможение.
Анализ влияния заболеваний матери на таксономический профиль образцов
Для поиска бактериальных родов, ассоциированных с наличием заболеваний эндокринной системы у матери, мы использовали пакет Deseq2 для языка R. На вход мы подавали набор таксономических профилей, а также следующую метаинформацию: 1) номер запуска секвенирования (1–3); 2) неделя рождения (25–39); 3) проводилось ли кесарево сечение (да/нет); 4) наличие заболеваний эндокринной системы у матери (да/нет).

Первая временная точка
Для первой временной точки (меконий) не было обнаружено статистически значимых ассоциаций с наличием эндокринного заболевания у матери.
Вторая временная точка
Для второй временной точки (неделя после рождения, табл. 1) наблюдалась дифференциальная представленность следующих родов: Lactobacillus, Streptococcus, Bifidobacterium, Clostridium_sensu_stricto_1, Klebsiella, Veillonella, Sphingomonas, Enterobacter, Bradyrhizobium (перечислены в порядке уменьшения встречаемости – доли образцов, в которых данный род был обнаружен).
Три рода, которые были статистически значимы и обнаружены более чем в половине образцов, это Lactobacillus, Streptococcus, Bifidobacterium. Представленность родов Lactobacillus и Bifidobacterium была выше у детей, рожденных от здоровых матерей, а представленность рода Streptococcus – у детей, рожденных от матерей, имеющих заболевание эндокринной системы.
Третья временная точка
Количество образцов, которые удалось собрать в третьей временной точке, было ниже, чем количество образцов во второй временной точке, что сделало невозможным учет всех метаданных при анализе. Ниже мы приводим список родов, который значимо ассоциирован с заболеванием матери при учете только двух факторов: номер запуска секвенирования (1–3) и наличие заболеваний эндокринной системы у матери (да/нет). Мы наблюдали большую представленность родов Enterobacter, Klebsiella, Veillonellа (табл. 2).
Обсуждение
В основе данного исследования лежит предположение, что заболевания эндокринной системы матери могут оказывать влияние на состав микробиоты кишечника новорожденных как на момент рождения, так и в последующий период. В рамках данной работы мы сконцентрировали внимание на роженицах, имеющих патологию со стороны щитовидной железы (гипотиреоз и тиреотоксикоз) или гестационный сахарный диабет, как наиболее часто встречающиеся эндокринные заболевания в этой возрастной группе (4,6% – гипотиреоз, 7% – гестационный сахарный диабет).
В первой временной точке (меконий) различия в составе микробиоты кишечника между группами детей не наблюдаются. Это может быть связано с компенсированным состоянием матерей, отсутствием влияния собственной иммунной и эндокринной систем плода либо с малым содержанием бактериальной ДНК в данном типе образцов и, как следствие, – с высоким уровнем контаминации.
Во второй временной точке (неделя после рождения) происходит активация собственной иммунной и эндокринной системы младенца. Также в этой временной точке не слишком значительным оказывается фактор длительного пребывания в стационаре. Мы наблюдали выраженную индивидуальную вариабельность в составе микробиоты кишечника, а также различия в представленности отдельных бактерий у младенцев, рожденных от матерей с патологией либо от здоровых матерей. У младенцев, рожденных от матерей с патологией эндокринной системы, наблюдается заселение условно-патогенной флоры (стрептококки), что характерно для случаев снижения иммунной компетенции [28]. При этом у младенцев, рожденных от здоровых матерей, в большей степени происходит заселение бифидо- и лактобактерий, что характерно для нормального развития микробиоты кишечника новорожденных [29].
В третьей временной точке (2 недели после рождения) также наблюдаются различия в составе микробиоты кишечника между группами. При этом в группе младенцев, рожденных от матерей с патологией эндокринной системы, наблюдалась повышенная представленность возбудителей инфекций, связанных с оказанием медицинской помощи, – родов Klebsiella и Enterobacter. Отметим, что эти же тенденции наблюдались и во второй временной точке.
Повышение относительной представленности рода Enterobacter может быть также связано с длительным курсом антибиотикотерапии, назначаемой недоношенным детям [30]. Данный род бактерий ассоциирован с развитием НЭК у недоношенных детей. Повышенная представленность рода Enterobacter у детей, рожденных матерями с патологией эндокринной системы, может быть связана с тем, что организм матери не способен в должной мере вырабатывать защитные антитела, в частности, секретируемые иммуноглобулины класса А (sIgA). У рожденных в срок детей выработка секреторного sIgA начинается через 7–30 дней после рождения. У недоношенных детей данный процесс запускается позже. В исследовании [31] собственные IgA в кале недоношенных детей, получавших в качестве питания только искусственные смеси, были обнаружены лишь спустя 40 дней после рождения.
Для более полной характеристики изменений микробиоты у новорожденных в зависимости от наличия эндокринных заболеваний требуется увеличение выборки. Это позволило бы, во-первых, найти большее количество ассоциаций и, во-вторых, разделить эффекты в зависимости от конкретной патологии матери. Также мы считаем целесообразным проведение дальнейших исследований с привлечением методов оценки иммунного и эндокринного статуса новорожденных.
Заключение
Выявленные различия в составе микробиоты кишечника недоношенных детей показывают, что состояние эндокринной системы матери может оказывать влияние на формирование микробиома кишечника младенца на ранних этапах его колонизации. Это, в свою очередь, может оказать влияние на формирование микробиома в последующие годы жизни и, как следствие, – склонность к некоторым заболеваниям.



