Плацента является барьером для вирусов и бактерий, что осуществляется главным образом посредством факторов неспецифической резистентности, одним из важных звеньев которой являются toll-подобные рецепторы (toll-like receptors, TLRs) [1]. TLR9 распознают неметилированные последовательности CpG-ДНК экзогенного и эндогенного происхождения: бактериальную и вирусную ДНК, а также поврежденные фрагменты клеток ДНК хозяина и ДНК плода [2, 3], чем инициируют сигнальный каскад, приводящий к активации NF-kB фактора и выработке провоспалительных цитокинов [1, 3]. Кроме того, TLRs посредством связи с белком AP-1 могут также регулировать не только уровень провоспалительного ответа, но и апоптоз, пролиферацию и дифференцировку клеток [4, 5].
Преэклампсия (ПЭ) – это мультисистемное осложнение беременности, выявляемое после 20 недели гестации, проявляющееся повышением давления и протеинурией, нередко – отеками [6, 7]. Хотя наиболее изученной причиной ПЭ является неполная трансформация спиральных артерий ввиду слабой инвазии трофобласта [6], ряд исследований показал, что для ПЭ характерно повышение цитокинов типа Th1 и Th17 и, соответственно, провоспалительный тип иммунного ответа [8].
Цель исследования: оценить уровень экспрессии TLR9 в ткани плаценты при ПЭ и задержке роста плода (ЗРП).
Материалы и методы
В исследование были включены 18 рожениц с тяжелой ПЭ, у 8 из них отмечалась ЗРП, а также 12 пациенток с умеренной ПЭ. Группу контроля составили 10 рожениц с неосложненной доношенной беременностью.
Критерии включения в группу с умеренной ПЭ: признаки артериальной гипертензии >140/90 мм рт. ст., протеинурии >0,3 г в сутки; для тяжелой ПЭ: артериальное давление >160/110 мм рт. ст. и протеинурия >5 г в сутки [6, 7]. Критериями включения при неосложненной доношенной беременности явились: физиологическое течение беременности, родоразрешение путем кесарева сечения по поводу неправильного положения плода, рубца на матке, а также патологии, не связанной с акушерским анамнезом (миопии тяжелой степени, угрозы отслоения сетчатки).
Критериями исключения из всех групп явились острые и хронические воспалительные заболевания, многоплодная беременность, тяжелая экстрагенитальная патология, состояние после трансплантации внутренних органов, применение вспомогательных репродуктивных технологий, онкологические заболевания в анамнезе, врожденные пороки развития плода, сахарный диабет, самопроизвольное родоразрешение.
На серийных парафиновых срезах было выполнено гистологическое исследование с окрашиванием гематоксилином и эозином, а также иммуногистохимическое (посредством иммуностейнера Ventana (Roche, UK) с закрытым протоколом для детекции) исследование с применением первичных поликлональных антител к TLR9 (1:300; GenTex) на образцах плацент, полученных от женщин на сроке 26–39 недель гестации, подвергнутых кесареву сечению [9]. Посредством системы анализа изображения NIS-Elements (Чехия) на базе микроскопа Nikon Eclipse было оценено мембранное и цитоплазматическое окрашивание продуктов реакции TLR9 в структурах плаценты в единицах оптической плотности. Для удобства представления все данные были умножены на 100. Учитывая техническую сложность и малый диаметр эндотелия сосудов промежуточных ворсин и мезенхимальных клеток стромы, была проведена оценка только цитоплазматического окрашивания.
Нами был выполнен анализ не менее 20 полей зрения (п./зр.) в каждом образце при увеличении х400. При помощи программы NIS-Elements измерен диаметр цитоплазматических гранул, окрашенных TLR9 в синцитиотрофобласте (СЦТ) и вневорсинчатом трофобласте (ВТ) в мкм, кроме того, произведена оценка количества гранул в СЦТ в соответствии с полуколичественной шкалой баллах: 0 – гранулы не определяются; 1 – единичные гранулы в отдельных ворсинах (в количестве от 50 до 100 в п./зр.), 2 – умеренное количество гранул в части ворсин (от 100 до 150 в п./зр.); 3 – умеренное количество гранул во всех ворсинах (от 150 до 200 в п./зр.); 4 – много гранул в большинстве ворсин (от 200 до 250 в п./зр.); 5 – много гранул во всех ворсинах (более 250 в п./зр.); п./зр., в пределах которого был произведен подсчет, равно 175х130 мкм). Наряду с этим количественный подсчет гранул во ВТ осуществлялся в расчете на одну клетку.
Статистический анализ
Статистическая обработка полученных результатов исследования проведена в пакете программ SPSS Statistics for Windows v.21. Анализируемые параметры проверялись на соответствие закону нормального распределения по значениям теста Шапиро–Уилка с критическим значением p<0,05. Значения численных данных, не являющиеся нормально распределенными, описывали в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3). Значения нормально распределенных численных данных описывали с применением арифметического среднего (M), а также стандартного отклонения (SD) в виде (M±SD). В качестве описательной статистики применялось сравнение медиан и средних значений в различных группах. Для оценки статистической значимости результатов использовался непараметрический тест Манна–Уитни с критическим значением p<0,05 для величин с распределением, отличным от нормального, и тест Стьюдента с критическим значением p<0,05.
Результаты
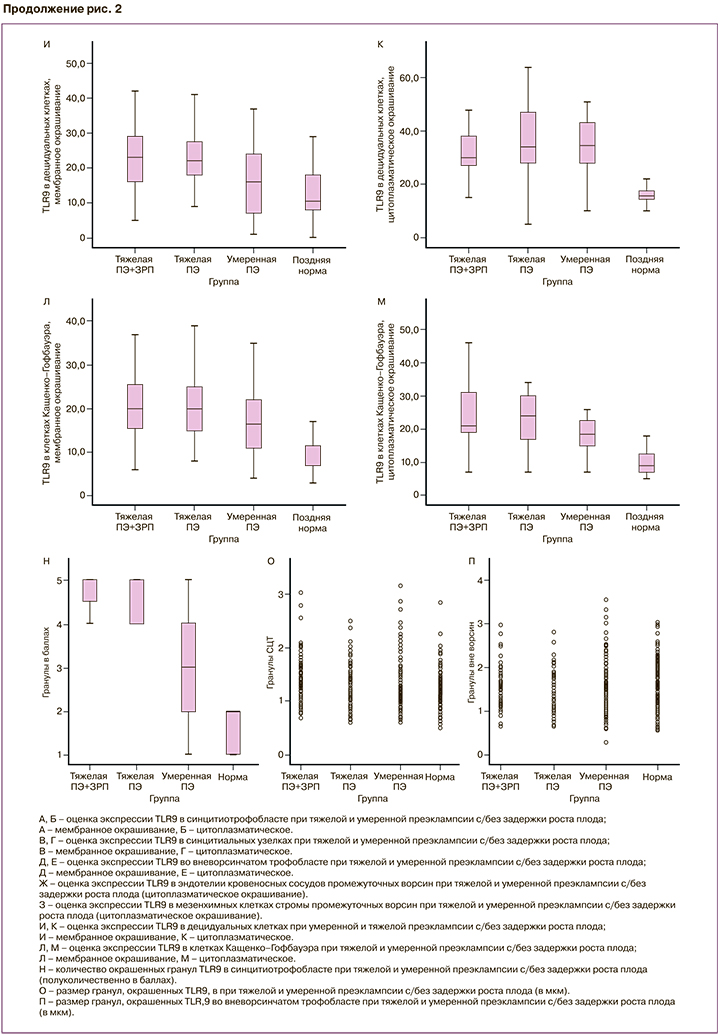
В результате исследования было выявлено значимое повышение мембранного и цитоплазматического окрашивания TLR9 в СЦТ в группе тяжелой ПЭ, осложненной ЗРП (мембранное 44 (37;49), цитоплазматическое 42 (35;47)), по сравнению с тяжелой ПЭ без ЗРП (мембранное 25 (20;31), цитоплазматическое 27 (22;32)), а также при умеренной ПЭ (р=0,02). Минимальное окрашивание было выявлено в группе контроля (мембранное 7 (4;17), цитоплазматическое 6 (4;16)) (рис. 1 A–З; рис. 2 A, Б).
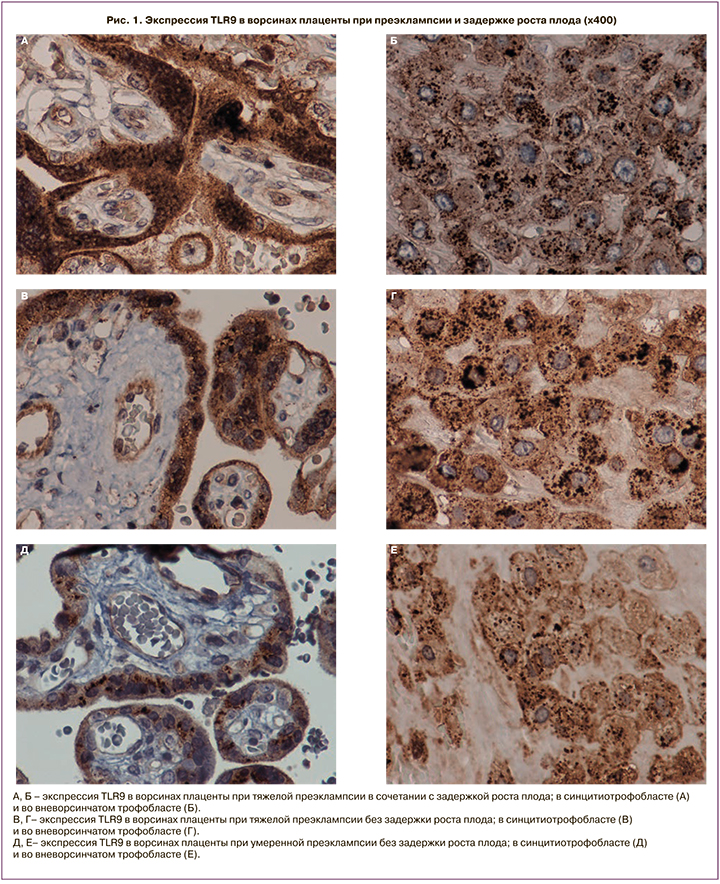
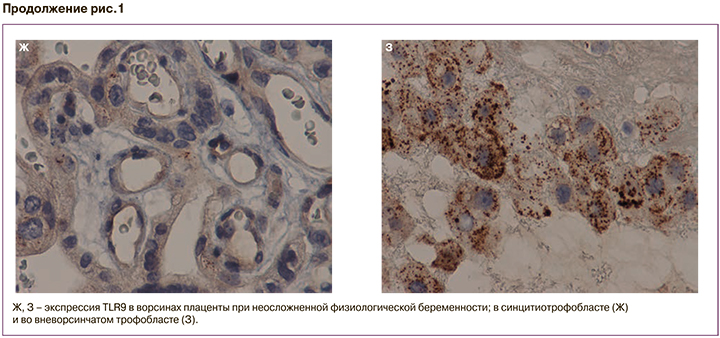
Сходная тенденция была обнаружена и при оценке мембраны и цитоплазмы в синцитиальных узелках (зонах пролиферации трофобласта), а также во ВТ: максимальное повышение при тяжелой ПЭ и ЗРП по сравнению с другими группами (мембранное 45 (30;60), цитоплазматическое 43 (40;58); р=0,03); (рис. 1 A–З; рис. 2 В, Г). Во ВТ максимальное цитоплазматическое окрашивание было при тяжелой ПЭ, медиана которой составила 38 (30;42), а при умеренной ПЭ – 19 (16;29), что было сопоставимо с группой контроля – 20 (5;26) (рис. 1 A–З; рис. 2 Д, Е).
В эндотелии сосудов цитоплазматическое окрашивание было максимальным в группе тяжелой ПЭ, осложненной ЗРП, – 23 (16;28) и тяжелой ПЭ без ЗРП – 22 (18;26), минимальная экспрессия – в группе контроля – 5 (3;10) (р=0,01) (рис. 1 A, Б, Д; рис. 2 Ж).
Экспрессия в децидуальных клетках, а также в мезенхимальных клетках стромы была значимо выше при тяжелой ПЭ без ЗРП – 25 (18;29), чем при тяжелой ПЭ с ЗРП – 21 (19;30) (р=0,04), минимальная экспрессия – в группе контроля (рис. 2 З–К). Экспрессия TLR9 в мембране и цитоплазме макрофагов в группе тяжелой ПЭ с ЗРП (20 (18;25)) и без ЗРП (20 (15;25)), хотя без значимых различий, но была выше, чем при умеренной ПЭ (15 (10;20)) (р=0,78) (рис. 1, рис. 2 Л, М).

Следует отметить, что в цитотрофобласте, СЦТ, а также ВТ и цитоплазме макрофагов (клеток Кащенко–Гофбауэра) имели место гранулы, окрашенные первичными антителами к TLR9. Количество гранул и их размер в СЦТ и ВТ были ассоциированы со степенью тяжести ПЭ (рис. 1 A–З; рис. 2 Н–П). В цитотрофобласте и СЦТ ворсин окрашенные гранулы располагались преимущественно в области ядерной мембраны, а также во ВТ.
Диаметр окрашенных гранул в СЦТ при тяжелой ПЭ, осложненной ЗРП, был значимо увеличен (1,27+0,41) по сравнению с тяжелой ПЭ без ЗРП (1,16+0,33) (р=0,05), а также в сравнении с умеренной ПЭ (1,13+0,41) (р=0,001) и группой контроля (1,09+0,30) (р=0,001) (рис. 1; рис. 2 О, П).
При ПЭ мелкие гранулы образовывали конгломераты, которые оптически сливались и наслаивались друг на друга, поэтому подсчет их был затруднен (рис. 1 Б, Г, Е, З). При тяжелой ПЭ, осложненной ЗРП, размер гранул во ВТ был 1,49+0,41, что было больше, чем в других группах исследования (р=0,001) (рис. 1 Б, Г, Е, З; рис. 2 П). При количественном подсчете в группе неосложненной беременности во ВТ присутствовало до 20 гранул, при ПЭ – от 20 до 50 гранул; при тяжелой ПЭ и ЗРП количество гранул достигало в отдельных клетках 100 (p<0,05).
Обсуждение
 Как известно, TLR9 относится к ДНК-распознающим рецепторам врожденного иммунитета, лигандом которого могут являться неметилированные последовательности CpG в молекулах как микробного, так и немикробного происхождения, а также фрагменты ДНК, в том числе фетальная ДНК. Таким образом, нуклеиновые кислоты можно рассматривать в качестве регуляторов иммунных реакций и уровня провоспалительного ответа в организме [1–3, 10].
Как известно, TLR9 относится к ДНК-распознающим рецепторам врожденного иммунитета, лигандом которого могут являться неметилированные последовательности CpG в молекулах как микробного, так и немикробного происхождения, а также фрагменты ДНК, в том числе фетальная ДНК. Таким образом, нуклеиновые кислоты можно рассматривать в качестве регуляторов иммунных реакций и уровня провоспалительного ответа в организме [1–3, 10].
В отличие от большинства TLRs, которые расположены на плазматической мембране, TLR9 – цитоплазматические детекторы, преимущественно экспрессирующиеся в эндоплазматическом ретикулуме [11, 12]. После активации TLR9 перемещаются из эндоплазматического ретикулума в аппарат Гольджи и лизосомы, где они взаимодействует с MyD88 [1, 11, 12]; также комплексы CpG-ДНК и TLR9 могут располагаться в эндосомальных везикулах (рис. 3) [13]. Формирование гранул TLR9 в цитоплазме клеток, по-видимому, связано как с эндоцитозом, так и c образованием комплекса с белками-переносчиками для распознавания лиганда (например с гранулином, а также с HMGB-1) [14]. Гранулин и другие белки способны связывать CpG-ДНК, образуя тем самым комплекс гранулин-ДНК-TLR9 [14, 15], что подтверждается повышением гранулина в плазме крови при ПЭ [16, 17]. Другими авторами [18] было обнаружено, что эндогенно экспрессируемый TLR9 сохраняется в эндоплазматическом ретикулуме. Напротив, TLR4 перемещается на поверхность клетки, что указывает на то, что удержание в эндоплазматическом ретикулуме не является общим свойством для всех TLRs. Поскольку TLR9 наблюдается в эндоцитарных везикулах после воздействия синтетических агонистов для CpG, можно предположить, что должен существовать специальный механизм для транслокации TLR9 в сигнальные компартменты, которые содержат CpG- ДНК [18].
Интересно, что при общих лигандах у TLR9 и TLR8 мембранное окрашивание у TLR9 менее выражено [19]. Экспрессия TLR9 представлена преимущественно цитоплазматическим и гранулярным окрашиванием; гранулярное окрашивание присутствовало как в ворсинчатом, так и во ВТ, единичные гранулы определялись также в плацентарных макрофагах (клетках Кащенко–Гофбауэра). Важно отметить, что количество и размер окрашенных гранул в трофобласте коррелировали с тяжестью ПЭ, что, по-видимому, связано с тяжестью воспалительного ответа (рис. 3), а для ПЭ повышение провоспалительного ответа является ведущим в патогенезе [8].
Учитывая, что иммунных клеток в плаценте достаточно мало по сравнению с другими органами (кишечник, матка), а уровень защиты плода от инфекции должен быть высоким, TLRs могут явиться важной составляющей этой защиты. Наряду с этим гранулы TLR4 (защита от бактериальной инфекции) описаны в нейтрофилах и являются частью внеклеточных ловушек (от англ. neutrophil extracellular traps) [20, 21]; при активации они выбрасываются из клетки, способствуя активации микробных агентов на расстоянии от клетки [20, 21]. Возможно, в плаценте существует аналогичный механизм защиты в виде TLR9, направленный на защиту от вирусов.
Сохранение мембранного окрашивания в цитотрофобласте и СЦТ при ПЭ, осложненной ЗРП, можно объяснить, вероятно, частичным сохранением мембран трофобласта ворсин, ввиду того, что для формирования ЗРП необходим некоторый временной промежуток, т.к. при более быстром наступлении плацентарной недостаточности ЗРП не успевает сформироваться и состояние женщины, страдающей ПЭ, требует срочного родоразрешения.
Посредством AP-1 рецепторы врожденного иммунитета, в том числе TLRs, помимо повышения провоспалительного фона, могут регулировать апоптоз и пролиферацию. Поэтому для физиологической регенерации необходим оптимальный уровень их экспрессии; при значимом повышении или снижении этого уровня регенерация клеток и тканей будет нарушена. В плаценте это касается прежде всего трофобласта и его способности к инвазии [22, 23].
Способность взаимодействия TLR9 с фрагментами ДНК и молекулами повреждения (DAMP – damage associated molecular patterns) имеет важное значение в генезе ПЭ [2, 16, 23, 24], а уровень фетальной ДНК, как было ранее показано [25], повышен в плазме крови матери при ПЭ [26]. Появление гранулярного окрашивания при ПЭ и увеличение диаметра и количества гранул в ворсинчатом и ВТ требует дальнейших исследований.
Ранее проведенные нами исследования показали, что в основе ПЭ лежат дистрофические изменения цитотрофобласта и СЦТ [19]. Повреждение его мембран, а также слущивание клеток с поверхности ворсин приводит к нарушению гематоплацентарного барьера, обусловливающему ухудшение газообмена между матерью и плодом. При повреждении СЦТ ворсин плаценты происходит увеличение уровней как общей, так и фетальной ДНК в материнском кровотоке. Фрагменты ДНК, связываясь с ДНК- и РНК-распознающими рецепторами, по-видимому, могут играть роль триггера активации воспалительных сигнальных путей, в том числе способствуя развитию эндотелиальной дисфункции как в плаценте, так и в организме матери, опосредуя формирование системного провоспалительного ответа и ПЭ [25, 26].
Заключение
Таким образом, при тяжелой ПЭ, в том числе осложненной ЗРП, выявлено значимое повышение цитоплазматического, а также гранулярного окрашивания TLR9 в ворсинчатом цитотрофобласте, СЦТ и ВТ. Наличие гранулярного типа окрашивания было специфичным только для цитотрофобласта, СЦТ, а также для плацентарных макрофагов (клеток Кащенко–Гофбауэра). Возможность взаимодействия фрагментов ДНК, в том числе фетальной ДНК и молекул, связанных с повреждением с TLR9, может лежать в генезе ПЭ и развитии системного провоспалительного ответа.



