В связи с широким использованием в акушерской практике операции кесарева сечения в последние десятилетия отмечается значительное увеличение частоты патологического прикрепления плаценты при повторных беременностях [1, 2]. По данным различных авторов, частота встречаемости врастания плаценты колеблется от 0,24 до 0,9% [3–6]. По степени инвазии врастание плаценты подразделяется на placenta accreta (ворсины хориона проходят через децидуальную оболочку и примыкают к миометрию), placenta increta (прорастание ворсин хориона в толщу миометрия) и placenta percreta (прорастание ворсин хориона сквозь толщу миометрия в серозную оболочку с возможной инвазией в соседние органы (мочевой пузырь, кишечник)). Рекомендуемые сроки родоразрешения при врастании плаценты варьируют от 34 до 36 недель, и тактика в основном зависит от риска преждевременных родов и наличия в анамнезе кровотечения [7, 8]. Сопоставление протоколов, представленных зарубежными ассоциациями врачей акушеров-гинекологов, демонстрирует отсутствие единого мнения об оптимальных сроках родоразрешения; разница между рекомендуемыми сроками составляет 2–3 недели [8].
В медицинской литературе недостаточно сведений о состоянии здоровья детей, рожденных у матерей с врастанием плаценты. Как правило, информация ограничивается сведениями о преобладании недоношенности, повышенной частоте задержки внутриутробного развития плода и необходимости в проведении интенсивной терапии таким новорожденных [6, 9–11].
Целью настоящего исследования явилось изучение частоты и особенностей дыхательных и сердечно-сосудистых нарушений в раннем неонатальном периоде у недоношенных детей, рожденных у матерей с врастанием плаценты, в сравнении с детьми аналогичного гестационного возраста (ГВ), родившихся у матерей без врастания плаценты.
Материалы и методы
Проведено ретроспективное сравнительное когортное исследование, в которое вошел 941 недоношенный новорожденный, поступивший в период с 1 января 2017 г. по декабрь 2019 г. в отделении реанимации и интенсивной терапии (ОРИТН) им. проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России.
Критериями включения в исследование являлись: ГВ 33–36 недель 6 дней (36/6). Из исследования были исключены дети с врожденными пороками развития (ВПР), хромосомными аномалиями, наследственными болезнями обмена и отечной формой гемолитической болезни новорожденных (ГБН) (n=98).
Из 843 недоношенных новорожденных ГВ 33–36/6 недель, вошедших в исследование, 59 детей родились у матерей с врастанием плаценты (основная группа). Контрольную группу составили 784 недоношенных новорожденных, у матерей которых не отмечалось врастания плаценты (рис. 1).

Новорожденным проводилась респираторная терапия инвазивными и неинвазивными методами в зависимости от тяжести дыхательных нарушений, при гемодинамических нарушениях использовались кардиотонические и вазопрессорные препараты. Период наблюдения продолжался от момента рождения до перевода новорожденных на второй этап выхаживания в отделение патологии новорожденных и недоношенных детей и составил минимум 2 дня, максимум – 33 дня. Критериями для перевода являлись: самостоятельное дыхание без дыхательных нарушений, стабильные гемодинамические показатели и отсутствие необходимости в кардиотонической поддержке, усвоение объема питания выше 50 мл/кг/сут, адекватный диурез. На 3-и сутки жизни новорожденным формулировался окончательный основной диагноз по заболеваниям дыхательной системы (респираторный дистресс-синдром (РДС), врожденная пневмония, транзиторное тахипноэ (ТТН)).
Оцениваемые переменные включали гестационный возраст, массо-ростовые показатели, гендерную принадлежность, оценку по Апгар на 1-й и 5-й минуте, структуру и частоту респираторных нарушений (РДС, врожденная пневмония, ТТН), частоту проведения и длительность традиционной искусственной вентиляции легких (ИВЛ) и высокочастотной осцилляторной вентиляции легких (ВЧОВЛ), частоту использования заместительной сурфактантной терапии, кардиотонической терапии (допамин, добутамин, адреналин), а также длительность пребывания в ОРИТН.
Статистический анализ
Статистическая обработка данных выполнялась с помощью программы IBM SPSS Statistics, version 26.0. При полученной в результате пилотного исследования частоте использования ВЧОВЛ у новорожденных в группе контроля, равной 19%, и у детей, рожденных у матерей с врастанием плаценты, равной 43,5%, для значений альфа-риска 5% и бета-риска 20% (мощность исследования 80%) необходимый объем выборки по формуле Лера составил 58 пациентов для основной группы. Перед проведением сравнительного анализа количественных данных в исследуемых группах проверяли соответствие нормальному распределению (тест Колмогорова–Смирнова, графический анализ данных). Учитывая отсутствие нормального распределения данных, применялись методы непараметрической статистики. Для количественных переменных определены медиана (Ме) и интерквартильный размах (IQR) 25–75 перцентиля. Для сравнения количественных величин между двумя группами использовался критерий Манна–Уитни, для сравнения бинарных переменных – критерий χ2 Пирсона, для вычисления которого использовалось построение таблицы «2×2», а также точный критерий Фишера (для небольших выборок). Для оценки влияния факторов риска были рассчитаны относительные риски (ОР) с 95% доверительным интервалом (ДИ). Статистически значимыми считались различия при р<0,05.
Результаты
Сравнительная характеристика новорожденных основной и контрольной групп представлена в таблице 1.
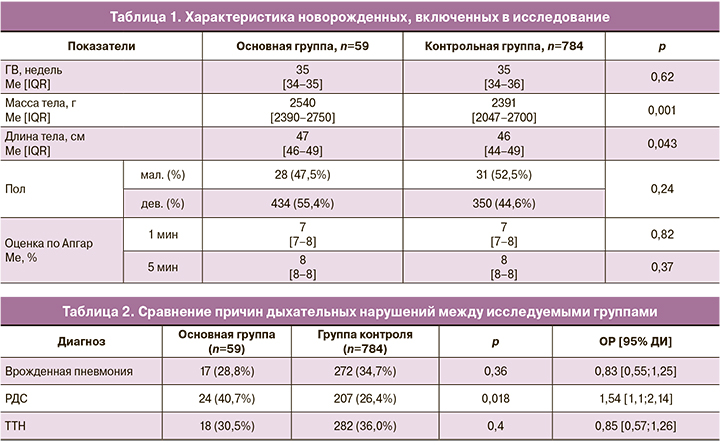
Несмотря на то что исследуемые группы были сопоставимы между собой по ГВ, при анализе антропометрических данных выявлено, что в основной группе у новорожденных отмечалась значимо большая масса и длина тела. Различий по соотношению мальчиков и девочек между группами не отмечалось. Оценка по Апгар не различалась между группами.
У 100% детей основной группы и 97% детей контрольной группы в первые часы после рождения отмечались дыхательные расстройства.
Структура частоты основных причин дыхательных расстройств в основной и контрольной группе представлена в таблице 2.
Как следует из данных, представленных в таблице, ведущей причиной дыхательных нарушений у новорожденных в основной группе являлся РДС, значимо превышающий частоту в контрольной группе. Установлено, что вероятность развития РДС у детей, рожденных у матерей с врастанием плаценты, в 1,5 раза выше (ОР=1,54), чем у новорожденных контрольной группы. Статистически значимой разницы в частоте заболеваемости врожденной пневмонией и ТТН не выявлено.
С целью сопоставления тяжести дыхательных нарушений у детей основной и контрольной групп нами проведен сравнительный анализ количества детей, которым в первые дни жизни требовалось проведение традиционной ИВЛ и ВЧОВЛ, а также заместительной сурфактантной терапии. Для сопоставления частоты и тяжести гемодинамических нарушений анализировалась частота использования вазопрессорных и кардиотонических препаратов (допамин, добутамин и адреналин) в основной и контрольной группах (табл. 3).
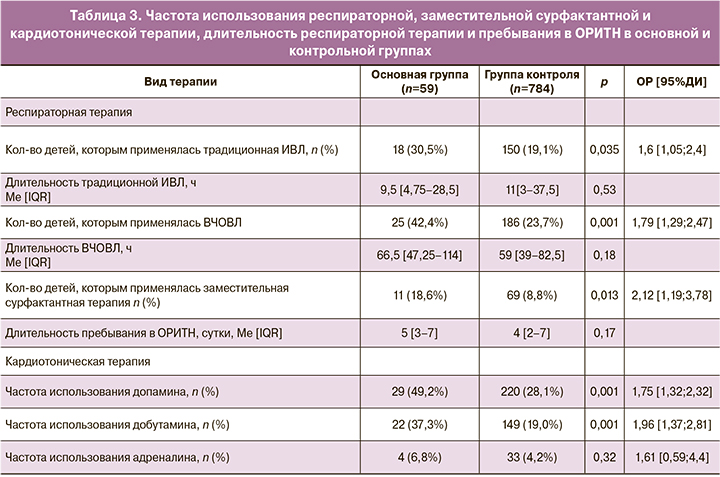
Установлено, что дети, рожденные у матерей с врастанием плаценты, значимо чаще нуждались в традиционной ИВЛ и ВЧОВЛ по сравнению с новорожденными аналогичного ГВ, матери которых не имели патологии прикрепления плаценты. Вместе с тем длительность ИВЛ существенно не различалась. Вероятность использования ВЧОВЛ и традиционной ИВЛ у недоношенных детей, рожденных у матерей с врастанием плаценты, была в 1,8 и в 1,6 раза выше соответственно, чем у детей аналогичного ГВ у матерей без врастания плаценты. Полученные данные свидетельствуют о более тяжелой степени дыхательной недостаточности у детей основной группы по сравнению с контрольной.
Эндотрахеальное введение препаратов сурфактанта проводилось чаще детям основной группы: 11/59 (18,9%) случаев против 69/784 (8,8%) в группе контроля. Полученные данные позволяют предполагать, что повышенная потребность в заместительной сурфактантной терапии отражает более выраженный дефицит эндогенного сурфактанта у детей, рожденных у матерей с врастанием плаценты. Вероятность использования сурфактанта в комплексной терапии у детей, рожденных у матерей с врастанием плаценты, оказалась в 2,1 раза выше, чем у новорожденных контрольной группы.
Сравнительный анализ потребности в кардиотонической и вазопрессорной терапии продемонстрировал более частое использование препаратов допамина и добутамина у новорожденных основной группы по сравнению с контрольной группой. При этом частота применения адреналина была низкой и не различалась между исследуемыми группами. Относительный риск развития гемодинамических нарушений, при которых новорожденные нуждались в вазопрессорной и инотропной терапии, был почти в 2 раза выше у детей, родившихся у матерей с врастанием плаценты, по сравнению с новорожденными контрольной группы. Несмотря на большую тяжесть дыхательных и сердечно-сосудистых нарушений у недоношенных детей основной группы по сравнению с контрольной, их, как правило, удавалось купировать в течение первых 3–7 суток, что позволяло перевести большинство этих детей на второй этап выхаживания в течение первой недели жизни. Длительность пребывания в ОРИТН существенно не различалась между группами.
Для уточнения зависимости частоты и тяжести дыхательных расстройств от ГВ новорожденные основной и контрольной групп были разделены на две подгруппы: ГВ 33–34 недели и 35–36/6 недель. В подгруппу «33–34 недели» вошли 28 новорожденных основной группы и 384 новорожденных контрольной группы, в подгруппу «35–36/6 недель» вошел 31 новорожденный основной группы и 400 новорожденных контрольной группы. Сопоставление данных соответствующих подгрупп представлено на рисунках 2 и 3.

Отмечается значимо большее количество детей, нуждавшихся в ИВЛ (традиционной ИВЛ (ОР [95% ДИ] 3,1 [1,97; 4,98]); ВЧОВЛ (ОР [95% ДИ] 1,73 [1,05; 2,85]) и в кардиотонической терапии среди новорожденных с ГВ 33–34 недели с материнским фактором врастания плаценты (допамин ОР [95% ДИ] 2,21 [1,54;3,18]; добутамин ОР [95% ДИ] 2,53 [1,56;4,1]) по сравнению с подгруппой детей соответствующего ГВ из контрольной группы. Сурфактантная терапия применялась одинаково часто у детей с ГВ 33–34 недели, что объясняется идентичной частотой РДС в данной возрастной группе (ОР [95% ДИ] 1,8 [0,96;3,37]). В основной подгруппе новорожденных с ГВ 33–34 недели отмечено значимо более длительное пребывание в ОРИТН (6,5 и 5 дней соответственно) по сравнению с детьми аналогичного ГВ, родившихся у матерей без патологии приращения плаценты.
В подгруппе новорожденных ГВ 35–36/6 недель дети, рожденные у матерей с врастанием плаценты, чаще нуждались в ВЧОВЛ (ОР [95% ДИ] 1,8 [1,2;2,79]) и в заместительной сурфактантной терапии (ОР [95% ДИ] 4,8 [1,35;17,3]) по сравнению с детьми соответствующего ГВ из контрольной подгруппы. Вероятность использования ВЧОВЛ была в 1,8 раза выше в основной группе, а заместительной сурфактантной терапии – в 4,8 раза по сравнению с контрольной группой, что обусловлено значительно более высокой частотой РДС (ОР [95% ДИ] 3,6 [2,3;5,8]). Вместе с тем не было выявлено значимой разницы в частоте применения вазопрессорной и инотропной терапии.
Длительность пребывания в ОРИТН в подгруппе новорожденных ГВ 35–36/6 недель не различалась.
Обсуждение
Несмотря на то что аномальное прикрепление плаценты увеличивает частоту осложнений, вплоть до гистерэктомии [12], литературные данные по перинатальным неонатальным исходам таких беременностей немногочисленны. Основными анализируемыми показателями являются наличие недоношенности, повышенная частота рождения детей с малым размером, наличие асфиксии при рождении, необходимость госпитализации и длительность пребывания в ОРИТН [3–5, 9–11, 13]. В исследованиях Moeini R. (2020), Gielchinsky Y. (2004), Mogos M. (2015) отмечено значимое преобладание недоношенных и новорожденных с малой массой и малым размером к сроку гестации у матерей с врастанием плаценты, что не согласуется с результатами нашего исследования [3, 4, 10]. Дети у матерей с врастанием плаценты, по нашим наблюдениям, имели значимо большую массу и длину тела (2540 г и 47 см в основной группе и 2391 г и 46 см в контрольной группе). В ряде исследований не выявлена разница в частоте рождения детей с внутриутробной задержкой развития плода при врастании плаценты за счет отсутствия нарушения маточно-плацентарного (МПК) и фето-плацентарного кровотока (ФПК). Авторами высказано предположение о повышении кровотока за счет ремоделирования артерий при врастании плаценты [14–16]. В нашем исследовании в группе контроля, состоящей из всех новорожденных соответствующего ГВ, родившихся и поступивших в ОРИТН, присутствовали дети с внутриутробными нарушениями МПК и ФПК, а также дети с задержкой внутриутробного развития, что продемонстрировало разницу в антропометрических показателях между группами. В исследованиях Kassem G. (2013), Baldwin H. (2017) и Moeini R. (2020) [5, 10, 11] демонстрируется меньшая оценка по шкале Апгар на 5-й минуте у детей, рожденных у матерей с врастанием плаценты; в то же время когортное исследование 310 пациентов, родившихся у женщин с врастанием плаценты, проведенное в Израиле [4], не обнаружило значимой разницы в данных показателях, что совпадает с нашими результатами. В двух исследованиях [9, 10] отмечено более длительное пребывание в ОРИТН детей, рожденных у матерей с врастанием плаценты, что частично согласуется с нашими данными. В подгруппе ГВ 33–34 недели длительность пребывания оказалась существенно выше, чем в контрольной группе соответствующего ГВ, – 6,5 дня и 5,0 дня соответственно. В то время как в подгруппе детей ГВ 35–36/6 недель различий между основной и контрольной группами не наблюдалось, длительность пребывания в обеих подгруппах составила 4 дня.
Полученные данные демонстрируют, что дети, рожденные у матерей с врастанием плаценты, имеют более выраженные признаки дыхательной и сердечно-сосудистой недостаточности, чем дети аналогичного ГВ, не имеющие материнский фактор врастания плаценты. Новорожденные основной группы в 1,6 раза чаще нуждались в проведении инвазивной ИВЛ, в том числе и ВЧОВЛ (в 1,8 раза), в 2,1 раза чаще использовалась заместительная сурфактантная терапия, и почти в 2 раза чаще применялись кардиотонические препараты для стабилизации гемодинамических нарушений. Наиболее выраженные нарушения течения периода ранней неонатальной адаптации регистрировались у детей ГВ 33–34 недели.
Несмотря на то что сравнение подгруппы ГВ 33–34 недели основной группы с новорожденными аналогичного ГВ группы контроля не выявило разницы в частоте использования заместительной сурфактантной терапии, у них отмечено более частое использование как вазопрессорных, так и инотропных препаратов. Высокая потребность в допамине и добутамине демонстрирует наличие у них нарушений не только сосудистого тонуса, но и сократительной функции миокарда. Напротив, у недоношенных детей основной и контрольной групп, родившихся на 35–36/6 неделях беременности, отличий в степени выраженности сердечно-сосудистых нарушений обнаружить не удалось. Вместе с тем у детей ГВ 35–36/6 недель, родившихся у матерей с врастанием плаценты, требовалось более частое (в 1,8 раза) использование ВЧОВЛ и сурфактантной терапии (в 4,8 раза), что отражало высокую частоту развития респираторных нарушений, обусловленных первичным дефицитом сурфактанта (в 3,6 раза выше, чем в контрольной группе).
Новорожденные ГВ 33–34 недели преимущественно родоразрешены не в плановом порядке, а в связи с начавшимся кровотечением либо дистрессом плода. В основном плановое родоразрешение проводилось в рекомендуемые международными ассоциациями сроки. Так, по протоколам Американского колледжа акушеров-гинекологов (ACOG, 2018), Общества медицины матери и плода (SMFM, 2019) и Общества акушеров-гинекологов Канады (SOGC, 2019) предпочтительным сроком планового родоразрешения у стабильного пациента является гестационный срок 34/0–35/7 недель [17, 18]. По рекомендациям Королевского общества акушеров-гинекологов Великобритании (RCOG, 2019), плановое родоразрешение при отсутствии кровотечения проводится на 35–36-й неделе беременности с учетом оптимального баланса между зрелостью плода и риском преждевременных родов в эти сроки [19]. Интернациональное общество по патологической инвазии плаценты (IS-AIP, 2019) рекомендует придерживаться выжидательной тактики до 36/0 недель беременности у женщин при отсутствии в анамнезе преждевременных родов и кровотечений, а в случае наличия последних или при преждевременном разрыве плодных оболочек во избежание ургентных осложнений производить плановое родоразрешение на 34/0 неделе беременности [20]. Интернациональная федерация акушеров-гинекологов (FIGO, 2018) не рекомендует конкретных сроков родоразрешения, а предлагает определять тактику ведения беременных в зависимости от местных ресурсов, которые включают в себя возможности трансфузиологической и неонатальной службы оказывать высококвалифицированную неотложную помощь. В случае недостаточности ресурсов рекомендуется родоразрешать беременных с врастанием плаценты ближе к сроку 37 недель [21].
Однако, по данным нашего исследования, родоразрешение на поздних (35–36 недель) сроках не приводило к уменьшению частоты использования ВЧОВЛ и сурфактантной терапии у новорожденных, что подтверждает незрелость системы сурфактанта, обуславливающей тяжесть состояния после рождения у данной категории новорожденных. Ограничением нашего исследования явилось отсутствие доношенных новорожденных у матерей с врастанием плаценты.
Влияние фактора врастания плаценты на преобладание гемодинамических нарушений у недоношенных новорожденных ГВ 33–34 недели и частоты РДС у поздних недоношенных новорожденных позволяет предположить возможное нарушение синтеза кортизола у плода при врастании плаценты. Данная гипотеза требует дальнейшего изучения.
Заключение
Таким образом, врастание плаценты увеличивает риск развития дыхательных и сердечно-сосудистых нарушений у недоношенных новорожденных. Преобладание нарушений дыхательной или сердечно-сосудистой системы у детей, рожденных у матерей с врастанием плаценты, зависит от сроков родоразрешения. Дыхательные нарушения у детей, рожденных у матерей с врастанием плаценты, в раннем неонатальном периоде обусловлены высокой частотой РДС, требующего применения ИВЛ, в особенности ВЧОВЛ, и заместительной сурфактантной терапии, и отмечаются преимущественно у новорожденных ГВ 35–36/6 недель. Сердечно-сосудистые нарушения, проявляющиеся снижением сосудистого тонуса и сократительной функции миокарда, требующие назначения вазопрессорной и инотропной терапии, отмечаются преимущественно у детей ГВ 33–34 недель, рожденных у матерей с врастанием плаценты. Родоразрешение женщин с врастанием плаценты на более поздних сроках 35–36 недель не позволяет избежать тяжелого течения раннего неонатального периода, что приводит к необходимости смещения сроков родоразрешения до доношенных при отсутствии иных показаний со стороны матери или плода. Требуется дальнейшее изучение данной проблемы, включая разработку методов профилактики РДС на поздних сроках беременности.



