Перекрут придатков матки (ППМ) (код N83.5 по МКБ-10) – пятое по частоте встречаемости неотложное состояние в гинекологии, требующее незамедлительного хирургического вмешательства. ППМ встречается в среднем у 15% девочек, составляет 2,7% всех случаев острой абдоминальной боли у детей, а также 0,3–3,5% случаев острой патологии брюшной полости в год [1–3]. ППМ называют вращение придатка на его сосудистой ножке, в который могут включаться яичник и маточная труба одновременно либо яичник или маточная труба изолированно [4].
Перекрут неизмененных придатков матки у детей встречается чаще (15–50%), чем у взрослых (8–18%) [4]. Среди перекрутов объемного образования у детей наиболее часто встречаются перекрут тератомы (20–30%), перекрут цистаденомы (20–30%) и перекрут функциональной кисты (20–25%) [4]. Наиболее часто наблюдается ППМ с правой стороны, вероятно, в связи с тем, что левый яичник имеет близкое расположение к относительно неподвижной сигмовидной кишке, в то время как правый располагается рядом с гипермобильными отделами слепой и подвздошной кишки [2]. Перекрут неизмененных придатков матки, встречающийся чаще у детей, как правило, является следствием врожденного удлинения связки яичника либо патологической слабости тазовых связок [5].
Специфических лабораторных показателей ППМ нет. Из проводимых в обязательном порядке при диагностике ППМ лабораторных исследований можно выделить общий анализ крови и определение уровня хорионического гонадотропина в крови (с учетом возраста пациентки и наличия половой жизни) для исключения внематочной беременности. По данным имеющихся крайне лимитированных опубликованных данных в библиотеках Medline, PubMed, Scopus и Cochrane по особенностям ведения ППМ у детей, лишь у небольшой части пациенток с ПММ было отмечено повышение уровня лейкоцитов (>12×109/л), при этом разные исследования демонстрируют разную частоту встречаемости данного симптома (от 20 до 56%) [5–8]. Также у пациенток с ППМ может наблюдаться повышение уровня С-реактивного белка, в том числе на стадии формирования некроза ткани придатка [9]; однако чаще повышение уровня данного белка острой фазы воспаления ассоциировано с аппендицитом, нежели с ППМ [10].
Наиболее чувствительным и специфичным методом диагностики ППМ остается ультразвуковое исследование (УЗИ) с цветовым допплеровским картированием кровотока (ЦДК) [11]. К ультразвуковым признакам ППМ относят увеличение размеров яичника, нарушение кровотока, отек и неоднородность паренхимы яичника [4, 6, 12]. Лучшими количественными детерминантами ППМ, по данным зарубежных исследований, названы площадь поверхности яичника (≥18,5 см2), отношение площади поверхности поврежденного яичника к площади поверхности контралатерального яичника (≥4,9), а также объем яичника (≥17 см3) [4, 6, 11–13]. Строма яичника может быть неоднородной из-за отека и в случае наличия кровоизлияний, возможно снижение дифференцировки тканей яичника [13]. Снижение или отсутствие кровотока при ЦДК, как правило, выявляется в большинстве случаев ППМ наряду с увеличением размеров яичника [4]. Ультразвуковая картина нарушенного кровотока при ППМ может быть разной и зависит от степени нарушения кровотока, которая, в свою очередь, определяется временем существования перекрута. В одном из исследований с участием пациентов с подтвержденным ППМ отсутствие артериального кровотока было обнаружено только в 73% случаев [12]. В другом исследовании у 60% пациенток определялся нормальный кровоток [14]. Кровоток может оставаться сохранным при неполном перекруте, при подкручивании яичника или в случаях, когда УЗИ проводится в самые ранние сроки перекрута [6]. Снижение или отсутствие артериального кровотока выявляется, как правило, с сопутствующим нарушением венозного кровотока (в 90–93% случаях) [12]. Это объясняется тем, что в первую очередь перекрут сосудистой ножки влияет именно на венозную систему придатка, а уже после – на артериальную [13].
Несмотря на то что снижение или отсутствие кровотока свидетельствует в пользу наличия перекрута, не во всех случаях при наличии данного признака диагностируется ППМ [15, 16]. Некоторые авторы описывают характерный диагностический признак ППМ – спиралевидный кровоток в закрученных сосудах придатка, который может иметь важное значение в определении жизнеспособности яичника [2, 17, 18]. Перекрученная сосудистая ножка визуализируется на УЗИ в виде эхогенной округлой или клювовидной массы с множественными концентрическими полосами. При допплеровском сканировании выявляются циркулярные или спиралевидные сосуды [17].
Кроме того, при ПММ по данным УЗИ определяются множественные мелкие кисты (от 8–12 до 25 мм) по периферии яичника в связи со смещением фолликулов при венозном застое, а также в связи с транссудацией жидкости в фолликулы при выраженном отеке [11, 12, 19]. Обнаружение мелких кист по периферии яичника в сочетании с увеличением размеров яичника на фоне боли в брюшной полости служит важной детерминантой возможного перекрута [19].
ППМ является неотложным состоянием и показанием к оперативному вмешательству [2]. В течение многих лет стандартным подходом в хирургической тактике лечения ППМ являлась аднексэктомия. Данному подходу противопоставляется консервативный, заключающийся в раскручивании перекрученной ножки придатка с сохранением органа [20–23]. По результатам исследований последних лет показано, что деторсия позволяет сохранить яичник даже в случаях сильно нарушенного кровоснабжения с изменением цвета ткани яичника на безжизненный и не ведет к повышению риска тромбоэмболии в послеоперационном периоде [22–25]. В ряде работ показано, что после деторсии придатков даже при сине-черной окраске ткани интраоперационно происходило восстановление функции яичника и кровотока в нем через 3 месяца после вмешательства в 88–93% случаев [5, 24, 26–28]. Темный цвет яичника во время вмешательства, вероятно, является проявлением венозно-лимфатического стаза, а не артериальной ишемии, что говорит о возможности его восстановления. При этом критически важно сократить время от момента развития перекрута до оперативного вмешательства, что позволит избежать некроза и добиться восстановления кровотока в придатке после деторсии [26, 29–31].
Таким образом, ППМ входит в группу патологий, проявляющихся острой болью в животе и не имеющих специфических симптомов. Из-за нередкой манифестации патологии симптомами «острого живота» госпитализация большого числа пациенток осуществляется в хирургические отделения больниц, и зачастую этап диагностики не включает консультацию врача акушера-гинеколога. Задержка диагностики и начала лечения могут привести к необратимым последствиям с потерей яичника и снижением репродуктивного потенциала, а также развитием гнойно-септических осложнений.
Цель настоящего исследования: изучить особенности диагностики и клинической картины пациенток с ППМ в подростковом возрасте.
Материалы и методы
В соответствии с поставленной целью и задачами в ретроспективное исследование случай-контроль были отобраны истории болезней 29 пациенток с 11 до 17 лет с ППМ, которые находились на стационарном лечении во 2-м гинекологическом отделении ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации с января 2017 г. по декабрь 2021 г. Группу контроля составили 27 соматически здоровых девочек аналогичного возраста первой группы здоровья, без гинекологической и эндокринной патологии. Исследование было одобрено Комиссией по этике биомедицинских исследований Центра, получено информированное согласие пациенток и их законных представителей на включение в исследование, использование персональных данных и публикацию полученных результатов.
На первом этапе проводился анализ анамнестических и лабораторно-инструментальных данных пациенток до проведения лапароскопии в сравнении с группой здоровых девочек (рис. 1). Обследование включало общеклинические методы (сбор анамнеза, оценка жалоб на боль, тошноту, рвоту, повышение температуры), лабораторные методы исследования (клинический анализ крови, биохимический анализ крови, уровень С-реактивного белка) и УЗИ органов малого таза с ЦДК.
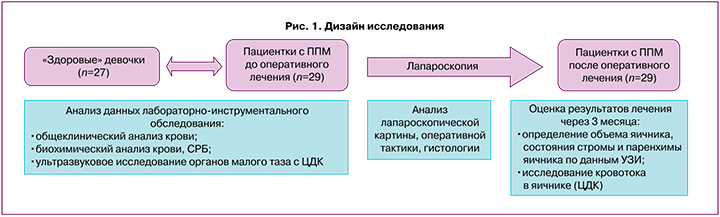
Затем проводился анализ данных лапароскопической картины в каждом клиническом случае и применяемой оперативной тактики с оценкой результатов хирургического лечения по данным повторного УЗИ органов малого таза, проводимого через 3 месяца после операции (с оценкой объема обоих яичников и показателей кровотока).
Изучены данные гистологического исследования резецированных во время лапароскопии тканей, проанализированы типы встречающихся объемных образований, вовлекаемых в перекрут.
Статистический анализ
Статистическая обработка данных проводилась в среде пакета Microsoft Excel и с помощью программы Statistica 13.3 (Statsoft Inc.). Оценка различий между двумя группами при непараметрическом распределении количественных переменных независимых выборок произведена с помощью U-критерия Манна–Уитни, в случае зависимых выборок применен критерий Уилкоксона. Сравнение переменных, имеющих нормальное распределение, при условии выполнения гомогенности дисперсий в нескольких независимых группах произведено методами дисперсионного анализа ANOVA. Оценка категориальных переменных произведена с вычислением частот и долей (%), для сравнения различий использовались таблицы сопряженности и вычислялся χ² тест. Оценка факторов риска произведена методами многофакторного анализа с использованием логистической регрессии.
Результаты
Среди 29 пациенток с диагнозом ППМ у 3 пациенток наблюдался рецидивирующий ППМ, при этом одна из пациенток имела рецидив дважды. В 19/29 (65,5%) случаях выявлялся перекрут придатков справа. Перекручивание объемного образования придатка матки обнаружено у 26/29 (89,7%), неизмененных придатков – у 3/29 (10,3%) подростков. В перекрут у 15/29 (51,7%) девочек попал весь придаток, у 7/29 (24,1%) – маточная труба с межсвязочным объемным образованием, у 2/29 (6,9%) – только яичник и у 1/29 (3,4%) – только маточная труба. Объемное образование у 12/29 (46,2%) было представлено параовариальной кистой, у 8/29 (30,8%) – зрелой кистозной тератомой, у 4/29 (15,4%) – серозной цистаденомой, у 1/29 (3,85%) – доброкачественной опухолью стромы полового тяжа и еще у 1/29 (3,85%) – фолликулярной кистой.
Анализ клинической картины позволил выявить следующие закономерности. На острую боль жаловались 10/29 (34,5%) девочек, у некоторых острая боль возникала на фоне периодической. Суммарно на периодически возникающую боль жаловались 13/29 (44,8%) пациенток. Среди пациенток с острой болью были девочки, обратившиеся в Центр в течение нескольких часов или дней с момента приступа, а также те, кто обратился в Центр спустя несколько месяцев. У 8/29 (27,6%) девушек боль отсутствовала, поводом к обращению было желание выяснить диагноз и лечебную тактику объемного образования придатков матки (рис. 2). Тошнота и рвота сопровождали приступ боли у 6/29 (20,7%), гипертермия выявлена у 2/29 (6,9%) пациенток.
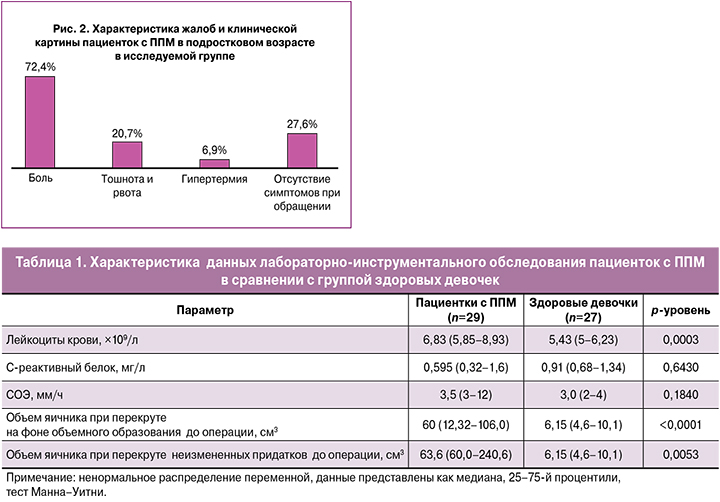
При анализе категориальных данных методами многофакторного анализа ANOVA выявлено, что к значимым факторам риска перекрута относятся острая боль в животе (F=11,4; p=0,001), тошнота и рвота (F=5,8; p=0,20). Гипертермия является незначимым фактором риска ППМ (p=0,21). При дальнейшем анализе выявлено, что у девочек с жалобой на периодическую боль выявлялся нетугой перекрут. Этим, вероятно, объяснялось отсутствие признаков стойкого нарушения кровоснабжения, а периодическая боль была связана с периодическим подкручиванием придатка.
Были проанализированы показатели содержания лейкоцитов, С-реактивного белка в крови и значения скорости оседания эритроцитов (СОЭ) в исследуемых группах. Превышение референсных значений лейкоцитов выявлено в 4/29 (13,8%) случаях в группе с ППМ; при этом в 2 из этих случаев наблюдались признаки нарушения кровоснабжения в придатке по данным УЗИ, в 1 случае – некротические изменения по данным лапароскопии и гистологии. У 3 пациенток из группы с ППМ выявлен более высокий уровень СОЭ (21,4%), у 2 из них наблюдались некротические изменения придатка. При сравнительном анализе содержания лейкоцитов в крови выявлено различие в значениях данного параметра у девочек с ППМ и у здоровых девочек (6,83 (5,85–8,93) против 5,43 (5,01–6,23), p=0,0003, Манна–Уитни тест) (табл. 1).
При анализе факторов риска с использованием логистической регрессии было показано, что параметры уровней лейкоцитов в крови, С-реактивного белка, СОЭ не являются значимыми предикторами наличия ППМ у пациенток подросткового возраста (χ2 =3,1443; p=0,7620).
По данным УЗИ в группе пациенток с перекрутом неизмененных придатков и с перекрутом на фоне объемного образования объем яичника был значимо выше в сравнении со здоровыми девочками (63,6 (60,0–240,6) и 60 (12,32–106,0) в сравнении с 6,15 (4,6–10,1)). По данным ЦДК признаки ППМ выявлены в 17/29 (58,6%) случаях. В 8/29 (37,9%) случаях было выявлено нарушение кровообращения по типу снижения либо отсутствия кровотока в яичнике. Спиралевидный кровоток визуализировался в 5/29 (17,2%) случаях. В 8/29 (27,6%) случаях кровоток при ЦДК определялся как сохранный, при этом в двух случаях при лапароскопии визуально определялись нарушения кровоснабжения придатка и в одном случае некротические изменения, подтвержденные гистологически (табл. 2).
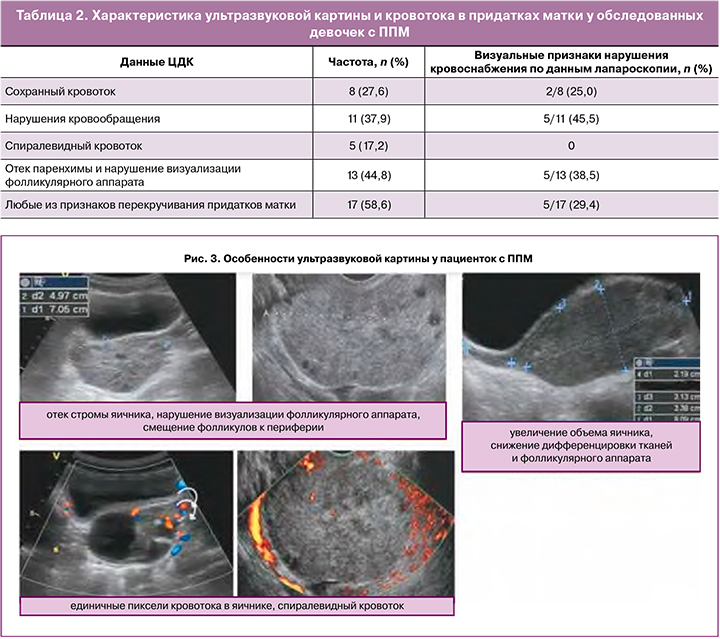
При наличии признаков нарушения кровоснабжения по данным ЦДК при лапароскопии чаще выявлялись визуальные признаки нарушения питания и/или некроз. В случаях, когда визуализировался спиралевидный кровоток, перекрут в среднем включал 2 оборота и был нетугим, с чем, вероятно, было связано отсутствие визуальных признаков нарушения питания придатка при лапароскопии.
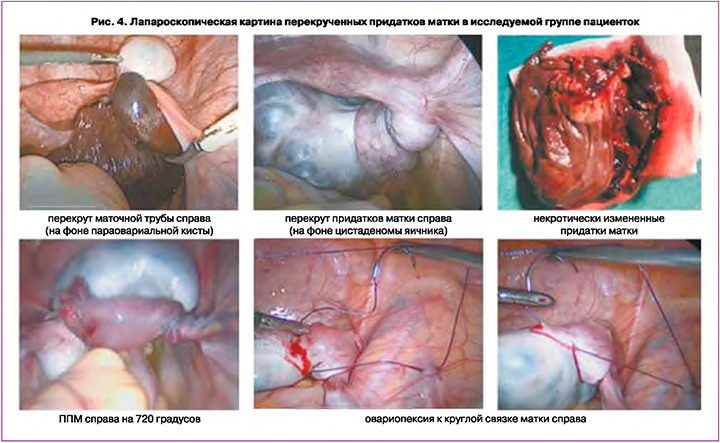
Всем пациенткам было выполнено оперативное вмешательство лапароскопическим доступом. Во время лапароскопии в 8/29 (27,6%) случаях диагностировался полный ППМ с визуальными признаками нарушения кровоснабжения придатка; при этом в 3/29 (10,3%) случаях наблюдались некротические изменения и в 5/29 (17,2%) случаях – признаки нарушения кровоснабжения в виде синюшной окраски тканей придатка. В случаях некротически измененных придатков ткани имели грязно-желтый цвет, зачастую находились в конгломерате с близлежащими тканями, некроз был подтвержден по данным патоморфологического исследования операционного материала. У 2 пациенток наблюдали некроз придатка, в связи с чем была выполнена аднексэктомия. У 1 пациентки диагностировали некроз маточной трубы, была выполнена тубэктомия. У 3 пациенток наблюдали полный перекрут придатка в несколько оборотов (более 720 градусов), однако с сохранением кровоснабжения. В 5 случаях были выявлены признаки нарушения кровоснабжения с отеком трубы и/или яичника, с сине-черной окраской придатка и формированием мелких кист по поверхности яичника.
Деторсия была выполнена всем пациенткам, у которых не наблюдалось некротических изменений (в 26/29 (89,6%) случаях). Во всех случаях с нарушением кровоснабжения придатков матки (8/26 (27,6%)) после деторсии наблюдалось некоторое восстановление окраски придатка при динамическом наблюдении в течение 10 минут. В остальных случаях (21/29 (72,4%)) визуализировались придатки без признаков ишемии или некроза. Овариопексия выполнена у 6/29 (20,7%) пациенток: у 1 девочки проведена овариопексия контралатерального яичника после аднексэктомии; у 2 – двусторонняя овариопексия и пликация воронко-тазовых связок в связи с патологическим увеличением их длины; у 1 – после тубэктомии; у 1 – при мультифолликулярных яичниках и у 1 пациентки – с рецидивом ППМ.
Далее мы проанализировали время от момента первого и последнего приступов боли до проведения лапароскопии. Из 10/29 (34,5%) пациенток с жалобами на приступ острой боли, наименьший отрезок времени до операции составил несколько часов и отмечен у 3. При этом у 1 из пациенток приступ случился впервые, и при лапароскопии у нее визуализировалось нарушение кровоснабжения придатка. У второй пациентки первый приступ случился за несколько дней до операции, и при лапароскопии у нее также визуализировалось нарушение кровоснабжения жизнеспособного придатка. У третьей пациентки первый приступ острой боли случился за 6 месяцев до оперативного вмешательства, но признаков ишемии на момент операции не наблюдалось в связи с нетугим перекрутом придатка матки. Две пациентки, у которых был выявлен некроз, имели приступы острой боли в одном случае за 2 недели до оперативного вмешательства, в другом – за 2 месяца до него. Еще у 5 пациенток с острой болью отрезок времени до обращения в стационар составлял от 10 дней до 2 месяцев. У одной из них выявились признаки ишемии жизнеспособного придатка, а время от приступа боли до операции составляло 10 дней. При отсутствии в клинической картине острой боли, но при наличии периодически возникающих тянущих болей внизу живота (у 13/29 (44,8%) пациенток) время, в течение которого боль присутствовала до операции, составляло от 3 недель до 7 месяцев. Ни у одной пациентки с периодической тянущей болью не было выявлено признаков нарушения кровоснабжения на фоне нетугого полного перекрута. В случаях бессимптомного ППМ (8/29 (27,6%) случаев) у 2 пациенток наблюдались признаки нарушения кровоснабжения с последующим его восстановлением и у одной из пациенток обнаружен некротически измененный придаток.
Сравнительный анализ данных объема перекрученного яичника до операции и данных УЗИ, выполненного через 3 месяца после операции, показал значимое уменьшение размеров яичника (60,0 (14,3–97,0) см3 против 16,7 (7,9–22,5) см3, р=0,0015, тест Уилкоксона). Даже в случаях с нарушением кровоснабжения в яичнике и при наличии черного окрашивания во время операции после деторсии наблюдалось уменьшение его размеров и восстановление дифференцировки стромы и кровотока в тканях яичника через 3 месяца.
Обсуждение
Проведенное исследование подтвердило актуальность проблемы своевременной диагностики ППМ у подростков. Полученные результаты нашего исследования согласуются с данными литературы по частоте встречаемости различных видов перекрутов у детей и подростков, в том числе неизмененных придатков и на фоне объемного образования яичника. При этом, как правило, ППМ наблюдался с правой стороны, наиболее часто в перекрут вовлекалась параовариальная киста или зрелая кистозная тератома [23, 31]. В клинической картине пациенток основным симптомом, с которым обращались большинство девочек, была боль в нижних отделах живота. Значимость данного симптома описана во многих работах, изучавших клиническую картину ППМ у взрослых [32–34], а также в имеющихся в литературе лимитированных работах о ППМ у подростков [3, 35]. Данное исследование подтвердило, что острая боль выявляется лишь у части пациенток [36]. В исследуемой группе острая клиническая картина присутствовала в меньшем количестве случаев, чем стертая, что, безусловно, обуславливало трудности при постановке диагноза у девочек.
Перекрут придатков матки является диагнозом, требующим особой настороженности со стороны врача акушера-гинеколога и врача-хирурга, поскольку из-за неспецифичности клинической картины пациентки с «острым животом» зачастую оказываются в хирургических отделениях и диагноз ППМ может быть пропущен. Кроме того, известно, что в связи с нарушением кровоснабжения клиническая симптоматика и жалобы на боль имеют тенденцию к снижению интенсивности вплоть до полного исчезновения жалоб у пациенток с некрозом придатков матки при длительно существующем ППМ. Анализ данных анамнеза пациенток выявил, что у 8/29 (27,5%) из них присутствовал в анамнезе приступ острой боли, с которым они были обследованы с целью исключения острого аппендицита, либо острого колита без подозрения на ППМ, и поступали в гинекологический стационар уже при возникновении повторного приступа. В связи с этим особую актуальность приобретает анализ ранней симптоматики ППМ для своевременной диагностики и оказания экстренной хирургической помощи. По результатам работы выделены значимые параметры в диагностике ППМ: острая боль в животе, тошнота и рвота на фоне приступов боли, а также данные УЗИ и ЦДК (снижение или отсутствие кровотока, наличие спиралевидного кровотока, увеличение объема и отек ткани яичника, нарушение визуализации фолликулярного аппарата в связи с отеком паренхимы), что согласуется с литературными данными [3, 6, 36, 37].
В исследуемой группе пациенток характер клинической картины был связан со степенью перекручивания придатков матки. Те пациентки, у кого симптоматика не была острой или отсутствовала, имели, как правило, нетугой, но полный перекрут или уже длительно существующий некроз придатков матки. У части пациенток ППМ был выявлен в связи с плановым оперативным вмешательством по поводу наличия объемного образования яичника, что подтверждает часто наблюдаемую в детском возрасте отложенную и пропущенную диагностику ППМ и несвоевременное оперативное вмешательство.
Несомненно, в диагностике ППМ большое значение имеют инструментальные методы исследования; при этом во время выполнения УЗИ органов малого таза обязательной является оценка кровотока с помощью ЦДК. При выполнении УЗИ в диагностике ППМ следует учитывать наличие таких признаков, как увеличенный объем яичника и нечеткая дифференциация стромы, нарушение кровотока или его спиралевидный характер.
Лабораторные методы в дифференциальной диагностике ППМ носят лишь вспомогательный характер. Хотя сравнение параметра содержания лейкоцитов в крови у пациенток с ППМ с группой здоровых девочек выявило значимое увеличение показателя, многофакторный анализ не подтвердил значимость концентрации лейкоцитов в крови, как и уровня С-реактивного белка и СОЭ в диагностике ППМ у пациенток подросткового возраста.
Оперативное лечение при ППМ показано в экстренном порядке, поскольку вследствие ППМ развиваются ишемия и некроз тканей. Задержка в постановке диагноза снижает шансы на сохранение жизнеспособного яичника, что в особенности актуально в детском возрасте. По результатам исследуемой выборки пациенток, в подавляющем большинстве случаев (27/29 (93,1%)) ППМ не сопровождался нежизнеспособностью яичника, в том числе при начавшемся развитии нарушений в системе кровоснабжения яичника. По данным литературы известно, что примерно в 88–93% грубые нарушения кровоснабжения яичника обратимы, и при ведении пациенток с ППМ обоснован органосохраняющий подход [5, 24, 26–28]. Анализ клинической картины и данных лапароскопии показал, что ишемия и некроз развиваются, как правило, в случае тугого перекрута, и при этом, как правило, имеется острая симптоматика. В случаях постепенного подкручивания придатка симптомы могут отсутствовать, что не исключает возможности развития некротических изменений. Ишемия и некроз придатка могут быть заподозрены по данным УЗИ и ЦДК. Но не во всех случаях нарушений кровотока по результатам допплерографии при лапароскопии наблюдались признаки ишемии, а в случаях наличия визуальных признаков нарушения питания яичник удавалось сохранить. Все это говорит в пользу того, что оперативная тактика должна основываться на органосохраняющем подходе даже в случаях наличия признаков нарушения питания, определяемых допплерографией или визуально. В клиническом исследовании с участием 58 женщин с ППМ, каждой из которых была выполнена деторсия, восстановление функциональной способности яичника наблюдалось в 94% случаев, в том числе при наличии сине-черной окраски яичника [27]. В настоящей работе у всех пациенток с сине-черной окраской яичника при лапароскопии наблюдалось восстановление физиологической окраски яичника в течение 10–15 минут после выполнения деторсии, а восстановление кровотока яичника, его размеров и дифференцировки стромы подтверждалось по данным повторного УЗИ с ЦДК через 3 месяца после операции. При этом после деторсии придатка даже в случае сине-черного окрашивания тканей не было зафиксировано ни одного случая развития тромбоэмболических или септических осложнений в послеоперационном периоде, что диктует максимально органосохраняющий подход при хирургическом вмешательстве у детей.
Таким образом, тактика ведения пациенток с ППМ в подростковом возрасте основана на органосохраняющем подходе с выполнением деторсии перекрученного яичника даже в случаях грубого нарушения его кровоснабжения. При врожденных формах удлиненных яичниковых связок, при рецидивах перекрута, при отсутствии явных причин перекрута яичников у подростков производились овариопексия к круглой связке матки, а также пликация и укорочение воронко-тазовых связок.
Выводы
1. В большинстве случаев у обследованных пациенток в подростковом возрасте наблюдали ППМ на фоне образования яичника (53,9%) и параовариальной кисты (46,2%), перекрут неизмененных придатков наблюдали в 10,3%, притом чаще наблюдали ППМ справа (65,5%).
2. Пациентки с ППМ в подростковом возрасте в 80% случаях предъявляли жалобы на приступы острой боли в животе (F=11,4; p=0,001), в трети случаев – в сочетании с тошнотой и рвотой (F=5,8; p=0,20), которые являются значимыми признаками в диагностике ППМ и показанием для экстренной лапароскопии.
3. У пациенток с ППМ по данным УЗИ выявлялись снижение или отсутствие кровотока при ЦДК в ткани яичника (F=15,6; p=0,000), а также спиралевидный кровоток, увеличение объема и отек ткани яичника, нарушение визуализации фолликулярного аппарата в связи с отеком паренхимы (F=8,42; p=0,005). Остальные параметры клинико-лабораторного обследования не отличались от группы здоровых девочек (гипертермия (p=0,21), лейкоцитемия (p=0,07), уровень С-реактивного белка (p=0,44)).
4. По данным лапароскопической картины в 27,6% случаев наблюдался тугой перекрут с признаками нарушения кровотока придатков матки, в 72,4% – нетугой перекрут с сохранением физиологической окраски тканей; в 89,7% случаев произведена деторсия придатков матки, в 6,9% наблюдений в связи с полным некрозом – аднексэктомия; у 20,7% пациенток органосохраняющая операция дополнена овариопексией и укорочением воронко-тазовых связок.
5. В послеоперационном периоде через 3 месяца у 80% пациенток отмечалось восстановление кровотока яичника по данным допплеровского сканирования и уменьшение размеров яичника (р=0,001), что подтверждает целесообразность органосохраняющей тактики ведения пациенток с ППМ в подростковом возрасте.



