В последние годы важная роль в патогенезе развития внутриутробной инфекции плода (ВУИ) отводится синдрому системного воспалительного ответа (ССВО), вызывающему комплекс метаболических расстройств в организме матери. Метаболические нарушения приводят к изменению как белкового и липидного спектров крови, так и стационарной концентрации активных форм кислорода и азота вследствие нарушения равновесия между про- и антиоксидантными процессами в периферической крови и тканях [1–4]. Однако, на сегодняшний день недостаточно данных, позволяющих определить вклад процессов, контролирующих окислительный стресс в системе «мать-плацента-плод», в индукцию развития ВУИ.
Известно, что даже физиологическая беременность характеризуется развитием состояния окислительного стресса, являющегося одним из центральных механизмов общей адаптации организма женщины к новым условиям, при которых наблюдается поддержание равновесия между прооксидантной и антиоксидантной системами на фоне параллельного повышении активности обоих процессов [5, 6]. Однако, на разных этапах гестации, подобное равновесие может нарушаться. К примеру, при физиологически протекающей беременности в период формирования артериальной циркуляции и увеличения напряжения кислорода в плаценте возникает состояние окислительного стресса, выполняющего роль триггера механизмов дифференцировки клеток, морфо- и органогенеза [5, 7]. В кратковременный период относительного дисбаланса между генерацией и элиминированием активных форм кислорода (АФК) происходит адаптация механизмов системы антиоксидантной защиты к сдвигу физиологического равновесия. Последующее нарушение этой адаптации приводит к неспособности системы антиоксидантной защиты противостоять нарастающим процессам свободно радикального окисления, что приводит к значительному ослаблению нарушению функции плаценты [5, 8].
Несмотря на высокую актуальность, на сегодняшний день до конца не изучена роль генерации АФК и антиоксидантной системы в формировании метаболических функций плаценты при ВУИ.
Вышеизложенное делает очевидной необходимость дальнейшего изучения этиологии и патогенеза развития ВУИ плода, в частности, характера системных метаболических расстройств в системе «мать – плацента – плод». Последнее позволит разработать новые принципы ранней диагностики ВУИ плода и, соответственно, определить тактику ведения беременных и родоразрешения при указанной патологии.
Целью исследования явилось изучение особенностей антиоксидантной защиты в система «мать-плацента-плод» при ВУИ.
Материал и методы исследования
В исследование было включено 47 беременных и их новорожденных детей. В результате проведенного клинико-лабораторного обследования беременных, изучения данных соматического и гинекологического анамнезов, паритета, данных амбулаторной и обменной карт о течении данной беременности, о состоянии новорожденного и клинико-лабораторных показателей ребенка, были определены критерии включения в группы. Все пациентки были ознакомлены c целью исследования и подписали добровольное информированное согласие в своем участии.
I группу составили 22 пары «мать-новорожденный» с реализацией ВУИ – основная группа; II группу – 25 пар условно здоровых – контрольная группа. Пациентки включались в исследование при установленном доношенном сроке беременности, в интервале от 37 до 40 недель 6 дней.
Критериями включения в основную группу служили: внутриутробная пневмония, гнойный конъюнктивит, гнойный омфалит, сепсис, развившиеся в течение первых трех суток раннего неонатального периода и зафиксированные документально в протоколах неонатологов.
Критериями исключения являлись: многоплодная беременность, пороки развития плода, тяжелая экстрагенитальная патология.
Определение содержания маркера перекисного окисления липидов – малонового диальдегида (МДА) в плазме крови матерей и новорожденных. Для определения концентрации МДА в плазме аликвоту крови центрифугировали в течение 10 мин при 4°С, 3000g. Плазму отбирали в отдельные пробирки, хранили при -80°С. Непосредственно перед измерением плазму размораживали на льду. Далее наносили в 1,5 мл пробирки в следующей последовательности:
- 150 мкл 40% трихлоруксусной кислоты (ТХУ);
- 150 мкл плазмы/PBS (1:1);
- 75 мкл 0,5% тиобарбитуровой кислоты (ТБК).
Для каждой пробы проводили контрольное измерение, при этом вместо ТБК наносили 75 мкл Н2О. Для калибровки вместо образца плазма/PBS использовали 0, 2, 4, 6, 8, 10 мкМ раствор 1,1,3,3-тэтраэтоксипропана.
Пробирки встряхивали и инкубировали при 85°С в течение 45 мин, далее переносили на лед, во все пробирки добавляли по 400 мкл бутанола, снова встряхивали и центрифугировали 20 мин, 1000 g. Супернатант отбирали и наносили на 96-луночные плашки по 150 мкл на лунку. Измерение проводили на спектрофотометре Thermo Scientific Multiskan GO с учетом коэффициента экстинции при 535 нм=1,56×105.
Определение ферментативной активности каталазы в плазме крови проводили полярографически с помощью электрода Кларка на оксиграфе (Hansatech, UK), прямым методом измерения напряжения кислорода, образующегося при распаде перекиси в ходе реакции: 2H2O2=2H2O+O2.
Все измерения проводили в термостатируемых условиях при постоянной температуре 25°С. В ячейку оксиграфа вносили 2 мл фосфатно-солевого буфера (pH=7,4). В буфер добавляли 100 мкл 6% H2O2. После того, как скорость выделения кислорода выходила на постоянный уровень, в ячейку добавляли 1 мкл плазмы крови и регистрировали приращение скорости выделения O2 (нмоль/мл/мин).
Активность каждого образца измерялась в двух повторностях. Исходя из полученных значений, рассчитывали каталазную активность в плазме крови в «Единицах активности в 1 мл» (Е/мл), где одна единица активности соответствует количеству фермента, катализирующего превращение одного микромоля субстрата в минуту.
Исследование содержания цитоплазматической (SOD1) и митохондриальной (SOD2) изоформ супероксиддисмутазы методом Вестерн-блот в вартоновом студне новорожденных. Образец ткани пуповины гомогенизировали в жидком азоте, проводили экстракцию белков в RIPA-буфере, а затем добавляли денатурирующий восстанавливающий буфер для нанесения образцов. Разделение белков проводили методом электрофореза по Лэммли в 10% полиакриламидном геле с дальнейшим переносом белков на поливинилиден-дифлуоридную мембрану. Для блокировки сайтов неспецифического связывания антител проводили инкубацию мембраны в 5% растворе обезжиренного молока (Biorad), приготовленном на основе трис-солевого буфера. Окрашивание белок-специфичными и антивидовыми антителами (Abcam, Invitrogen) проводили в тех же условиях. Проявку мембраны осуществляли набором Novex ECL (Invitrogen) в гель-документирующей системе ChemiDoc (Biorad). Анализ интенсивности хемилюминесценции проводили в программном обеспечении ImageLab. Полученные значения для SOD1нормировали на интенсивность сигнала для полос, соответствующих α-тубулину, а для SOD2 – белку внешней мембраны митохондрий VDAC1.
Определение достоверности различий полученных значений для анализируемых групп проводилось в программах MS Excel и STATISTICA по критерию Манна–Уитни. Данные представляли в виде средних значений ± стандартная ошибка среднего.
Результаты исследования
При изучении состояния здоровья беременных с анализом особенностей соматического и гинекологического анамнеза в основной группе было выявлено достоверное увеличение частоты хронического пиелонефрита 18,2% (n=4, p<0,05) и хронического цистита 13,6% (n=3, p<0,05), тогда как в группе контроля частота хронического пиелонефрита составила 9,1% (n=2). В структуре гинекологических заболеваний в I группе отмечалось достоверное увеличение хронического цервицита 50,0% (n=11, p<0,05), бесплодия 13,6% (n=3, p<0,05) и наличия в анамнезе двух и более медицинских абортов до 12 недель 31,8% (n=7, p<0,05).
При анализе спектра возможных возбудителей исходной инфекционно-воспалительной заболеваемости в основной группе достоверно чаще выявлялись хроническая рецидивирующая герпетическая инфекция 22,7% (n=5, p<0,05) и кандидозный вульвовагинит 27,3% (n=6, p<0,05).
Проведение анализа акушерских и перинатальных исходов выявило в первом триместре настоящей беременности у пациенток основной группы достоверное увеличение угрозы выкидыша 59,1% (n=13, p<0,05). При анализе инфекционно-воспалительной заболеваемости в I триместре среди пациенток основной группы достоверно чаще выявляли бактериальный вагиноз 18,2% (n=4, p<0,05). Во II триместре у пациенток группы I в 13,6% случаев (n=3, p<0,05) отмечалось формирование истмико-цервикальной недостаточности (ИЦН), плацентарная недостаточность – в 18,2% (n=4, p<0,05) и анемия беременных – в 22,7% (n=5, p<0,05). В группе контроля во II триместре также отмечались ИЦН (n=1, 4,0%) и анемия беременных (n=1, 4,0%), не достигшие статистической значимости (p>0,05). Из особенностей течения III триместра беременности следует отметить достоверное увеличение в группе I анемии беременных – 27,3% (n=6, p<0,05) и патологии околоплодных вод – маловодие 18,2% (n=4, p<0,05), а также задержка роста плода 22,7% (n=6, p<0,05) и преждевременный разрыв плодных оболочек (ПРПО) 40,9% (n=9, p<0,05). Во II группе в последнем триместре отмечались ПРПО 12,0% (n=3) и анемия беременных 8,0% (n=2), не достигшие статистической значимости (p>0,05).
Послеродовый период у пациенток основной группы в 13,6% (n=3) случаев протекал с осложнениями в виде субинволюции матки (p>0,05).
При изучении исхода родов для плода у детей I группы чаще диагностировалась асфиксия 31,8% (n=7), неонатальная желтуха – 36,4% (n=8), внутриутробная недостаточность питания – 18,2% (n=4) и гипотрофия – 9,1% (n=2, p>0,05).
Учитывая данные клинического обследования пациенток основной группы, относящие их к группе высокого инфекционного риска, интерес представляло дальнейшее исследование в данной группе факторов, обуславливающих влияние инфекционного агента на систему «мать-плацента-плод». С этой целью у пациенток, включенных в исследование, и их новорожденных была проведена оценка возможностей антиоксидантной защиты первой линии.
При определении уровня маркера перекисного окисления липидов в плазме крови не было выявлено достоверных различий для измеренных средних значений между группами I и II как для матерей (15,0±1,4/15,1±1,0 p=0,95), так и для новорожденных (12,4±0,4/13,5±0,0, p=0,25). Кроме того, различия содержания МДА в крови матери и ребенка также были недостоверны для обеих групп.
Для уточнения причины отсутствия различий в уровне маркера окислительного стресса для I и II групп была проведена оценка активности антиоксидантных ферментных систем в плазме крови матери и новорожденного, а также в ткани пуповины новорожденных.
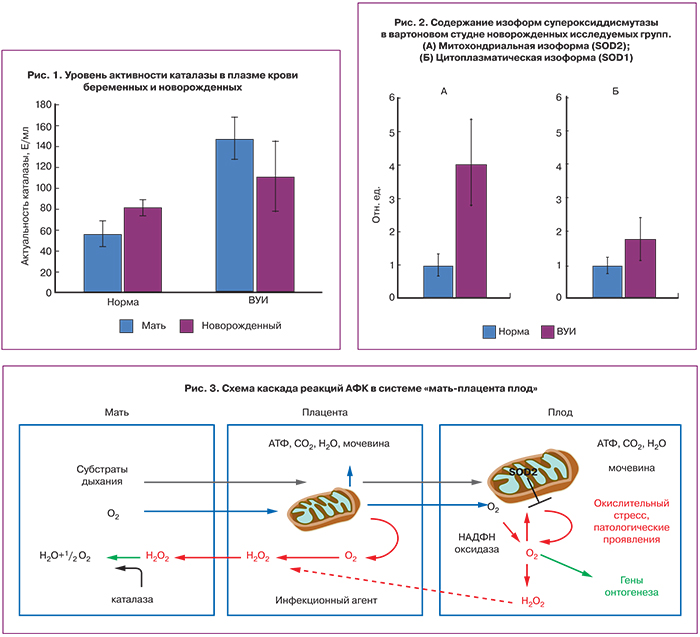
В образцах плазмы крови беременных с реализацией ВУИ было обнаружено достоверное увеличение ферментативной активности каталазы (р<0,009) (рис. 1), принимающей участие в контроле уровня перекиси водорода – относительно стабильного интермедиата в цепи свободно-радикальных реакций образования продуктов неполного восстановления кислорода. В то же время, не обнаружено достоверных различий в уровне активности каталазы в плазме крови новорожденных обеих групп.
При анализе уровня содержания фермента супероксиддисмутазы в ткани вартонова студня новорожденных были выявлены достоверные различия между группами I и II для изоформы митохондриального происхождения (SOD2) (рис. 2А). В то же время для исследуемых групп не выявлено достоверных различий в содержании цитоплазматической изоформы (SOD1) (рис. 2Б). Схема каскада реакций АФК в системе «мать-плацента плод» отображена на рис. 3.
Обсуждение
Частота ВУИ варьирует в больших пределах и зависит от многих факторов. Большинство авторов выделяют следующие факторы риска развития ВУИ: отягощенный акушерский анамнез (самопроизвольные аборты и мертворождения – 63%), патологическое течение беременности (преэклампсия – 80%, хроническая внутриутробная гипоксия плода – 72%, хирургическая коррекция ИЦН и др.), наличие хронических очагов инфекции у матери (75%), обострение хронического пиелонефрита (54%), анемия (64%) и др. [9, 10]. В нашем исследовании у пациенток с последующей реализацией ВУИ по сравнению с контрольной группой значительно чаще встречаются хронические заболевания мочевыводящих путей и хронические воспалительные заболевания органов малого таза, ряд осложнений гестационного периода: ИЦН, анемия беременных, угрожающий выкидыш, маловодие, ПРПО, задержка развития плода.
По данным литературы известно, что у данного контингента пациенток во время беременности под воздействием постоянной активности латентно персистирующих инфекционных агентов, происходит дисбаланс в системе иммунологического ответа с реализацией ССВО [11]. Реализация ССВО в системе «мать–плацента–плод» происходит на фоне активации макрофагальной и эндотелиальной систем, локального выброса провоспалительных цитокинов и лимфоцитов III типа с отсутствием адекватной компенсаторной реакции со стороны иммунной системы [12, 13]. Воздействие инфекционного агента на плаценту и плод во многом зависит от степени выраженности и характера изменений иммунного статуса беременной [14].
Одним из этапов формирования воспалительного ответа является взаимодействие лейкоцитов с сосудистой стенкой и последующая миграция в субэндотелиальный матрикс. При взаимодействии с эндотелием происходит активация лейкоцитов, направленная на усиление процессов фагоцитоза и элиминацию патогенного агента. Однако активированные лейкоциты выделяют большое количество свободных радикалов кислорода, протеаз, фосфолипаз, эластаз и др., которые способствуют прогрессирующему повреждению тканей [15]. Активация экспрессии молекул адгезии является ключевым в ответе организма на воздействие провоспалительных медиаторов. Постоянная экспрессия клеточных молекул адгезии на эндотелии и лейкоцитах отмечается при хроническом воспалении и обусловливает длительное существование процессов воспаления и тканевого повреждения [4, 5, 15].
При нормальном функционировании клетки скорости образования и удаления АФК относительно постоянны. Механизм поддержания окислительно-восстановительного баланса основан на запуске сигнального каскада, чувствительного к АФК, что приводит к увеличению экспрессии антиоксидантных ферментов. Запуск окислительно-восстановительной сигнализации происходит при нарушении баланса, либо концентрации АФК. Если инициирующее увеличение АФК относительно мало, клетка компенсирует его и возвращает систему в прежнее сбалансированное состояние. Хронический метаболический сдвиг в результате устойчивого дисбаланса между прооксидантами и антиоксидантами называется окислительным стрессом и инициирует вторичную продукцию АФК митохондриями, что приводит к индукции апоптотической и некротической гибели клеток и тканевой дисфункции [5, 16–18].
Как отражено на схеме, представленной на рис. 3, по нашим данным при реализации ВУИ повышение активности каталазы в периферической крови матери одновременно с повышением экспрессии митохондриальной супероксиддисмутазы носит характер адаптации, направленной на решение двух важнейших задач. Во-первых, необходимо поддерживать уровень АФК на невысоком, но достаточном для активации генов онтогенеза, уровне. В связи с этим достигается компромисс между циклом продукции АФК с положительной обратной связью, и блокирующим действием митохондриальной супероксиддисмутазы, предотвращающей повреждение митохондрий и массовую гибель клеток плода при индукции апоптоза. Во-вторых, образующаяся в результате конверсии аниона супероксида достаточно стабильная перекись водорода формирует градиент концентрации, падающий в направлении от плода к матери и диффундирует в обратном по отношению к кислороду направлении, поскольку в плазме периферической крови матери происходит быстрое разрушение перекиси каталазой. Таким образом, также снижается вероятность активации каскада программированной клеточной гибели в плаценте, что могло бы привести к плацентарной недостаточности и индукции преждевременных родов. Вероятно, срыв адаптации описанного типа при ВУИ, в определенной степени может служить причиной преждевременных родов и дальнейшие исследования в этой области с вовлечением в исследование группы женщин с преждевременными родами на фоне ВУИ может приблизить нас к пониманию механизма развития данной тяжелой патологии гестации.
Защита клеток от свободных радикалов представляет собой многоуровневую систему антиоксидантов. Так называемая первичная защита ослабляет реакции инициации свободно радикального окисления, за счет уменьшения концентрации свободных радикалов и организации их диффузии в определенных направлениях с целью снижения концентрации АФК в области наиболее уязвимых систем развивающегося плода.
В исследовании была проведена оценка возможностей ферментативного звена антиоксидантной защиты первой линии, так называемых «ловушек» первичных свободных радикалов. К ним относятся: супероксиддисмутаза – дисмутирующая супероксидный радикал и каталаза – удаляющая перекись водорода.
Заключение
Таким образом, полученные данные свидетельствуют о наличии компенсаторной реакции при реализации ВУИ, как на системном уровне в организме беременной, так и на локальном в плацентарном комплексе, направленной на снижение уровня продукции АФК со стороны антиоксидантного звена (каталаза) и потребления кислорода и продукции макроэргических соединений (АТФ) митохондриальным аппаратом плаценты. Нарушение в системе регуляции генерации АФК, возможно, свидетельствует об истощении адаптационных ресурсов матери и развивающегося плода.



