Осложнение беременности в виде преэклампсии сопровождается рядом характерных клинических изменений, включая гипертензию, протеинурию и, в более тяжелых случаях поражения центральной нервной системы, полиорганную недостаточность [1–4]. Все эти изменения тесно связаны с формированием системного воспаления с участием фагоцитов крови (нейтрофилов и моноцитов) [2], образующих и секретирующих многочисленные провоспалительные факторы (цитокины воспаления), протеолитические ферменты и радикалы кислорода [5, 6]. Однако следует отметить, что стимулированные фагоциты и, прежде всего, нейтрофилы участвуют не только в разрушении и удалении погибших и видоизмененных собственных клеток организма при асептическом воспалении, но и в таких патофизиологических процессах, как увеличение АД, повреждение клеток клубочков и канальцев почек [5–7]. Одним из наиболее важных процессов с участием фагоцитов крови является «дыхательный взрыв», связанный с резким увеличением потребления кислорода этими клетками, из которого с помощью ферментативной НАДФН-оксидазной системы генерируются супероксид анионы в результате одноэлектронного восстановления молекулярного кислорода [8]. «Дыхательному взрыву» предшествует ряд процессов, которые переводят клетки из состояния покоя в состояние предактивации (праймирования) [9]. Такая предактивация развивается под влиянием низких концентраций праймирующих агентов (10-10-10-9 М), создающих благоприятные условия для стимуляции «дыхательного взрыва» в результате последующего воздействия разрешающего агента [10]. В результате праймирования развивается сложный комплекс процессов, который заканчивается потенциированием ответа на стимулятор [9–11]. Разница в действующих концентрациях праймирующих агентов и стимуляторов может составлять два-три порядка [9]. Праймированные и покоящиеся фагоциты морфологически мало отличаются друг от друга. Праймированные нейтрофилы не образуют значительных количеств радикалов кислорода и не секретируют цитотоксические соединения, содержащиеся в гранулах, и могут циркулировать с током крови [11].
Механизмы праймирования носят сложный характер и в полной мере изучены недостаточно полно. В ряде исследований было предположено, что центральную роль в возникновении и развитии преэклампсии играет нарушение плацентации, гипоксически-ишемические изменения плаценты, гибель цитотрофобластов, клеток спиральных сосудов матки и клеток других видов, что сопровождается секрецией в кровь провоспалительных цитокинов, включая фактор активации тромбоцитов (PAF), фактор некроза опухоли (TNF-a), формил пептиды, образуемые не только бактериями, но и митохондриями (fMLP), эндотоксины (LPS) и др., которые первоначально праймируют нейтрофилы, а затем накапливаются и стимулируют эти клетки [12–14]. С током крови предактивированные фагоциты распространяются по всему организму, разрушают слой эндотелиальных клеток микрососудов, формируют порочные циклы, важную роль в которых играет подавление апоптоза нейтрофилов и, как следствие, увеличение продолжительности жизни этих клеток [15]. Необходимо отметить, что само праймирование, по-видимому, изменяет структуру, состав и свойства как белков (например, рецепторов), так и липидов плазматических мембран нейтрофилов, что усиливает чувствительность этих клеток к внеклеточным регуляторным воздействиям, влияющим на уровне плазматических мембран [16]. Подобные изменения, очевидно, не носят выраженного характера и развиваются до возникновения «дыхательного взрыва» вследствие адгезии нейтрофилов не только на эндотелии и других видах клеток, но и компонентах соединительной ткани и барьерах различных видов [17, 18].
Цель исследования. Изучить взаимосвязь содержания предактивированных (праймированных) нейтрофилов в периферической крови беременных с преэклампсией.
Материалы и методы исследования
В исследование включены 14 женщин с преэклампсией (основная группа – I), 15 женщин с физиологически протекающей беременностью (контрольная группа – II) и 11 небеременных женщин (для получения нормативных значения).
Группы были сопоставимы по исходной клинической характеристике. Всеми пациентками было подписано информированное согласие на участие в данном исследовании, которое было одобрено локальным этическим комитетом. Критериями включения в группах являлись: одноплодная беременность, родоразрешение на сроке гестации с 37 до 40 недель 6 дней, наличие преэклампсии в основной группе. Критериями исключения – тяжелая экстрагенитальная патология, многоплодная беременность, пороки развития плода, генетические и острые инфекционные заболевания матери, задержка роста плода.
Изолирование нейтрофилов. Венозную кровь получали из локтевой вены пациенток. В качестве антикоагулянта использовали гепарин (30 МЕ/мл). Для удаления эритроцитов к крови добавляли 3% раствор декстрана и выдерживали при 37˚С 30 мин. Кровь разводили культуральной средой Хенкса в отношении 1:1 и наслаивали на двух ступенчатый градиент фиколл-гипака (1,077 г/мл и 1,119 г/мл) и центрифугировали при 400 g × 30 мин. Собирали мононуклеарную (лимфоциты + моноциты) фракцию и фракцию нейтрофилов. От эритроцитов в суспензии нейтрофилов избавлялись с помощью гипотонического лизиса. Чистота используемой суспензии нейтрофилов составляла не менее 96%, содержание живых клеток в тесте с трипановым синим было равно 94—96%. Готовили суспензию изолированных нейтрофилов 2×106 клеток/мл в среде RPMI-1640, содержащей 1% FCS. Изменения проводили на суспензиях нейтрофилов в бесцветной среде Хенкса, содержащей буфер HEPES 20 мМ, рН7,4 (1×106 клеток/мл).
 В качестве люминофора использовали люцигенин (конечная концентрация в пробах 30 мкМ). Образование радикалов кислорода регистрировали на хемилюминометре Биотокс-7 (Россия) в виде имп/с в непрерывном режиме.
В качестве люминофора использовали люцигенин (конечная концентрация в пробах 30 мкМ). Образование радикалов кислорода регистрировали на хемилюминометре Биотокс-7 (Россия) в виде имп/с в непрерывном режиме.
Статистическая обработка. Результаты выражали в виде средних значений ± стандартная ошибка среднего. При сравнении использовали критерий Стьюдента. Достоверными значениями считались результаты с р<0,05.
Результаты исследования и их обсуждение
Все пациентки исследуемых групп были сопоставимы по возрасту. Клинико-анамнестическая характеристика, особенности течения беременности, родоразрешения, состояние новорожденных представлено в таблице.
Анализ структуры экстрагенитальной патологии показал, что у пациенток с преэклампсией в 1,5 раза чаще отмечались острые респираторные вирусные инфекции (ОРВИ), составляя 12,2% и 9,1% (по группам соответственно). Кроме того, в основной группе в 2 раза чаще выявлялась миома матки, составляя 12,2% и 5,5% (по группам соответственно), в 1,5 раза чаще хронические воспалительные заболевания органов малого таза, составляя 13,5% и 7,3% (по группам соответственно).
Течение беременности у пациенток с преэклампсией в 1,5 раза чаще осложнялось угрозой прерывания беременности во II триместре, составляя 22,9% и 16,4% (по группам соответственно) (OR=1,58; CI=0,64–3,88).
Значимая часть пациенток основной группы были родоразрешена в экстренном порядке – 44,1%, в группе сравнения данный показатель составил лишь 5,0%, что, по-видимому, обусловлено степенью тяжести преэклампсии. Экстренная операция кесарева сечения была выполнена в 3,8 раз чаще в основной группе, чем в группе сравнения – OR=5,65; CI=2,00–15,95.
Изучение послеродового периода в группах не выявило значимых различий. Средний объем кровопотери в основной группе составил 625,2±166,6 мл, в группе сравнения – 489,1±230,9мл.
Перинатальные исходы были проанализированы у всех пациенток. Все дети родились живыми. Средняя оценка новорожденного по шкале Апгар на 1-й минуте в основной группе составила – 7,2±1,0 баллов, в группе II – 7,9±0,5 баллов, оценка на 5-й минуте жизни составила 8,4±0,7 и 8,9±0,4 балла соответственно.
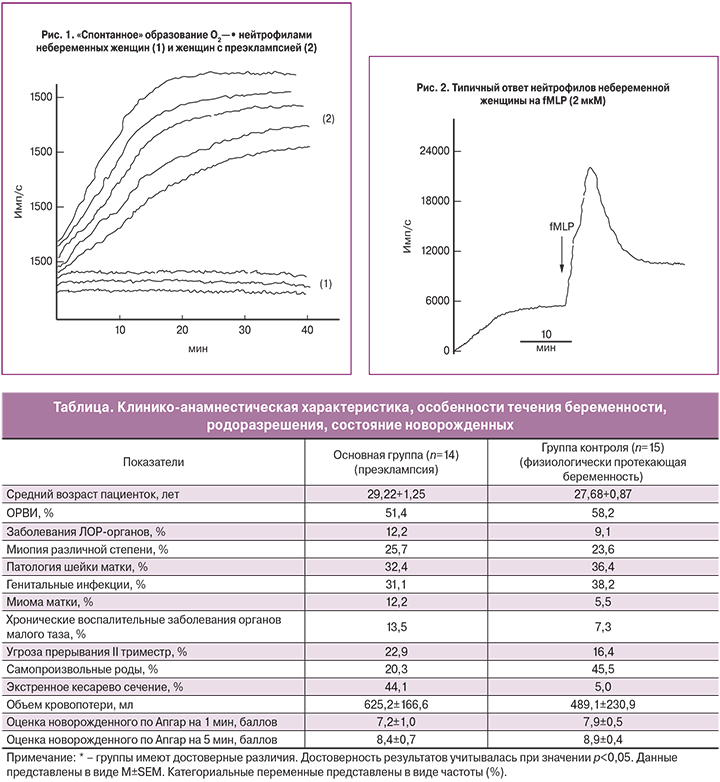
 Определение уровня супероксид анионов в суспензиях нейтрофилов, полученных из крови небеременных женщин, выявило увеличение его уровня со временем в пределах 1000–1500 имп/с (рис. 1–1). При преэклампсии нейтрофилы генерировали радикалы кислорода «спонтанно» и через 20–25 минут их уровень достигал максимальных значений (рис. 1–2). Отношение уровня плато радикалов «спонтанно» образуемых при преэклампсии к уровню радикалов у небеременных женщин составило 4 (6000 имп/с: 1500 имп/с = 4). По-видимому, такое «спонтанное» образование радикалов кислорода при преэклампсии является следствием стимуляции исходно праймированных нейтрофилов в результате взаимодействия клеток со стенкой кюветы и их адгезии.
Определение уровня супероксид анионов в суспензиях нейтрофилов, полученных из крови небеременных женщин, выявило увеличение его уровня со временем в пределах 1000–1500 имп/с (рис. 1–1). При преэклампсии нейтрофилы генерировали радикалы кислорода «спонтанно» и через 20–25 минут их уровень достигал максимальных значений (рис. 1–2). Отношение уровня плато радикалов «спонтанно» образуемых при преэклампсии к уровню радикалов у небеременных женщин составило 4 (6000 имп/с: 1500 имп/с = 4). По-видимому, такое «спонтанное» образование радикалов кислорода при преэклампсии является следствием стимуляции исходно праймированных нейтрофилов в результате взаимодействия клеток со стенкой кюветы и их адгезии.
У здоровых беременных нейтрофилы «спонтанно» генерировали супероксид анионы, уровни которых монотонно возрастали и на плато в среднем были равны х±s=2090±390; n=15, что было больше по сравнению с небеременными женщинами (х±s=1170±442; n=11), но достоверно ниже значений, наблюдаемых в суспензиях нейтрофилов при преэклампсиии (х±s=4540±913 (n=14) (р<0,05).
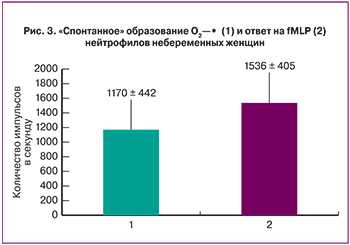
На следующем этапе исследования к суспензиям клеток женщин трех групп добавляли формил пептид (fMLP, 2 мкМ), который продуцируется бактериальными клетками, а также освобождается при гибели митохондрий [19]. Кроме того, он взаимодействует на поверхности нейтрофилов с двумя типами рецепторов, сопряженных с G-белками, которые c помощью протеинкиназ передают сигнал активации на компоненты НАДФН-оксидазного ферментативного комплекса, генерирующего супероксид анионы [7, 14]. Полученные нами данные свидетельствуют о том, что формил пептид увеличивает уровень супероксидов в суспензии нейтрофилов небеременных женщин в незначительной степени – в 1,3 раза (рис. 2; рис. 3). Максимальный ответ на формил пептид при беременности был больше по сравнению с небеременными женщинами, но никогда не достигал значений, наблюдаемых при преэклампсии.
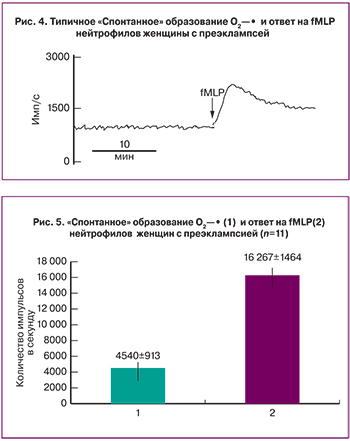
Кроме того, при преэклампсии после спонтанного образования супероксидов (рис. 1–2), формил пептид – fMLP (2 мкМ) индуцировал выраженный «дыхательный взрыв» в суспензиях нейтрофилов. Так, после достижения максимальных значений, уровень О2¾· снижался и выходил на некоторый постоянный уровень (рис. 4).
Из рисунка 5 видно, что при преэклампсии спонтанное образование радикалов кислорода выходило на плато 4540±1464 имп/с (n=14), а формил пептид индуцировал образование радикалов кислорода до максимально уровня, равного 16267±1464 имп/с (n=14).
Вышеуказанное позволяют предположить, что в крови женщин с преэклампсией имеются предактивированные нейтрофилы, которые циркулируют с током крови по организму и готовы в любой момент подвергнуться стимуляции под влиянием различных агентов.
Синергистическое усиление генерации радикалов кислорода нейтрофилами, подвергшихся предварительному воздействию низких доз различных праймирующих агентов, и последующему влиянию стимулятора (эффект праймирования) имеет важное значение для функциональных ответов нейтрофилов в условиях системного воспаления. В ряде исследований было высказано предположение о том, что феномен праймирования нейтрофилов развивается задолго до начала клинического проявления симптомов преэкламсии и может быть выявлен с помощью инструментальных методов в образцах крови пациенток [9, 12]. Такое праймирование возникает под влиянием различных по своей природе агентов, которые генерируются при нарушении плаценто-образования, в том числе – TNF-a, LPS, IL-8, гормона лептина, частиц погибших синцититрофобластов и др. [9–13].
Результаты, полученные в работе, показывают, что часть нейтрофилов, выделенных из крови женщин с преэклампсией, находится в предактивированном (праймированном) состоянии. Следует отметить, что такие клетки не только синергистически отвечали на стандартный стимулятор – fMLP, но и «спонтанно» генерировали радикалы кислорода с большей скоростью и до более высокого уровня по сравнению с нейтрофилами, полученными от небеременных и условно здоровых беременных женщин. В качестве рабочей гипотезы было предположено, что «спонтанное» образование радикалов кислорода является следствием стимуляции исходно праймированных нейтрофилов в результате их адгезии на стенке кюветы. В пользу такого предположения свидетельствуют ранее полученные результаты, которые показали, что адгезия нейтрофилов на эндотелиальных клетках микрососудов сопровождается их обоюдной активацией, экспрессией адгезионных рецепторов и их лигандов, а также последующей стимуляцией [18]. Этот процесс подавлялся с помощью антител против таких белков [17] и воздействия разнообразных химических агентов [18]. Более того, показано, что адгезия и активация нейтрофилов на пластике не связана с адгезивными клеточными рецепторами, а происходит по другим механизмам и примерно в два раза более выражена по сравнению с адгезией на эндотелии [17].
Для предупреждения неблагоприятного влияния неадекватно стимулированных нейтрофилов на нормальные клетки окружающих тканей используют несколько подходов:
Удаление образовавшихся радикалов с помощью прямых антиоксидантов;
Предупреждение генерации радикалов кислорода, образуемых НАДФН-оксидазным ферментативным комплексом, с помощью агентов, нарушающих его формирование (опосредованные или косвенные антиоксиданты);
Снижение поступления нейтрофилов в пораженную область при подавлении их хемотаксиса или взаимодействия с эндотелиальными клетками микрососудов.
Все эти подходы неизбежно сопровождаются подавлением защитных эффектов нейтрофилов, что играет неблагоприятную роль, особенно при длительном их применении. Один из новых подходов связан с переводом нейтрофилов из состояния предактивации (праймирования) в состояние покоя. Важно отметить, что такой перевод не подавляет последующего повторного праймирования и полностью сохраняет весь защитный потенциал нейтрофилов.
Возникновение праймирования формируется до появления клинических признаков системного воспаления, что позволяет выявлять его с помощью инструментальных методов исследования, в том числе по регистрации образования радикалов кислорода в совокупности с другими методами определения уровня и активности праймирующих агентов, включая разнообразные цитокины.
Заключение
Таким образом, определение маркеров системного воспаления и образования значительных количеств радикалов кислорода в процессе дыхательного взрыва в результате генерации и стимуляции праймированных клеток в крови беременных женщин in vitro, при исключении других потенциально возможных причин активации нейтрофилов позволяет с определенной вероятностью выявлять беременных, угрожаемых по развитию преэклампсии. Кроме того, установленный высокий уровень свободнорадикального окисления и наличия нейтрофилов, предактивированных к респираторному взрыву, обосновывает целесообразность разработки профилактических подходов, направленных на уменьшение оксидативного стресса и предупреждение его неблагоприятных последствий.



