В последние годы отмечается неуклонный рост частоты генитального эндометриоза в структуре гинекологической заболеваемости [1–4]. Данное заболевание справедливо рассматривается как типичный представитель мультифакторных заболеваний с распространенностью от 2 до 60% среди женщин репродуктивного периода [5–8]. Молодой возраст пациенток, длительное и прогрессирующее течение заболевания, формирование синдрома хронической тазовой боли, дисменореи, стойкое нарушение репродуктивной функции, снижение трудоспособности и качества жизни в целом определяют как медицинское, так и социальное значение эндометриоза [6, 7].
Несмотря на значительное число исследований, посвященных эндометриозу, многие вопросы этиологии, патогенеза, диагностики и лечения до сих пор остаются нерешенными.
Среди всех локализаций наружного генитального эндометриоза ведущая роль принадлежит эндометриозу яичников, который встречается в 17–44% наблюдений. Для эндометриоза яичников характерна высокая частота рецидивов (от 2% до 67%) и формирование бесплодия (чаще первичного) в репродуктивном периоде [8–10]. Наличие множества теорий возникновения и развития данного заболевания показывает отсутствие полноценных объяснений патогенеза и особенностей его течения.
По мнению ряда авторов, клинические особенности эндометриоза яичников коррелируют с некоторыми данными морфологических и иммуногистохимических исследований, подтверждающих генетически детерминированные варианты течений эндометриоза – рецидивирующий и нерецидивирующий [11–13]. Данный факт имеет большое практическое значение, поскольку при определении иммуногистохимических показателей в полученном материале после хирургического лечения (цистэктомии) с учетом других клинико-морфологических данных можно достоверно прогнозировать рецидивирование процесса [9, 11, 13, 14].
Ранняя диагностика эндометриоза яичников чрезвычайно сложна как из-за значительной вариабельности проявления, отсутствия патогномоничных симптомов, многогранного характера нарушений, связанных с субъективной интерпретацией данных инструментальных методов обследования, так и по причине отсутствия единых иммуногистохимических и морфологических концепций оценки полученных результатов.
Правильная интерпретация полученных гистологических данных, использование определенных иммуногистохимических методов обследования позволяет выявить риск развития рецидива эндометриоза яичников, заподозрить развитие онкологических процессов и в последующем разработать верную тактику ведения данных пациенток.
Значимыми проблемами в ведении пациенток с эндометриозом яичников являются применение в экстренной хирургии агрессивных факторов физического воздействия, в частности – монополярной коагуляции, и низкая частота назначения противорецидивной терапии.
Важно помнить, что в ходе проведения оперативного лечения удаляются лишь видимые и доступные очаги эндометриоза. Микроскопические и атипические очаги остаются незамеченными и могут продолжить свое персистирование с дальнейшим возникновением рецидива заболевания. Поэтому без послеоперационного назначения медикаментозной противорецидивной терапии эффективность хирургического лечения снижается [14–18].
Частота рецидивов наружного генитального эндометриоза достигает 67%. В течение первых 2-х лет после лечения рецидив эндометриоза возникает в среднем в 21,5%, а в течение 5 лет в 40–50%. Это подтверждает факт увеличения частоты рецидивов с течением времени (приблизительно на 10% в год) [1–3, 6, 8, 9]. Вышеизложенная статистика показывает, что эффективность проведенного оперативного лечения снижается при отсутствии регулярного наблюдения за пациентками в послеоперационном периоде и отсутствии дальнейшего назначения медикаментозной терапии [10, 15, 16].
Стратегия медикаментозного лечения эндометриоза направлена на подавление функции яичников с ятрогенным созданием состояния менопаузы или псевдобеременности. Гормональные препараты являются первой линией терапии и назначаются в целях уменьшений клинической симптоматики, предотвращения рецидива эндометриоза после ранее проведенного оперативного лечения, либо у пациенток с противопоказаниями к оперативному лечению [17–20].
Применение нестероидных противовоспалительных препаратов (НПВС) оправдано для уменьшения интенсивности боли (дисменореи) путем снижения секреции простагландинов и других провоспалительных медиаторов [21–24]. Кокрейновский анализ демонстрирует недостаточную убедительность данных о значительном уменьшении эндометриоз-ассоциированной боли при применении НПВС [2, 10, 17].
Имеются убедительные доказательства снижения риска развития рецидива эндометриоза на фоне применения агонистов гонадотропин рилизинг-гормона (аГнРГ). Использование аГнРГ в течение 3 или 6 месяцев считается «золотым» стандартом медикаментозной терапии. Это лечение наиболее эффективно при эндометриоз-ассоциированной тазовой боли, тяжелых и инфильтративных формах эндометриоза, в рамках комплексной противорецидивной терапии эндометриоза яичников в послеоперационном периоде [16, 17, 19]. Высокая частота нежелательных явлений (симптомы постменопаузальных расстройств, снижение минеральной плотности костной ткани на 1% в месяц и других) ограничивает продолжительность приема данных препаратов до 6 месяцев [4, 10, 18, 22]. Применение аГнРГ совместно с add-back терапией (возвратная терапия или терапия прикрытия). Например, тиболон 2,5 мг/сутки, норэтистерон ацетат 5 мг/сутки, МГТ (менопаузальная гормональная терапия), позволяют уменьшить проявление побочных эффектов и увеличить длительность терапии [19, 21–25]. В качестве терапии прикрытия также используют фитоэстрогены, витамин Д3, мелатонин. В то же время, результаты мета-анализа демонстрируют, что частота побочных явлений, требующих прекращения терапии, преувеличена и составляет 1–8% [18, 22, 26]. В дальнейшем риск рецидивирования значительно не отличается от риска у пациенток, которые не получали медикаментозного лечения [22, 26].
Наиболее эффективными в лечении различных форм генитального эндометриоза по-прежнему считаются агонисты гонадотропин-рилизинг-гормона (аГнРГ). Агонисты ГнРГ уникальны в своей универсальности воздействия на все гормонозависимые ткани. Базисными препаратами противорецидивной терапии эндометриоза яичников являются а-ГнРГ (Бусерелин-депо 3,75 мг) [2, 10, 15]. При этом многолетний опыт применения препарата Бусерелин-депо демонстрирует сопоставимую с зарубежными аналогами эффективность и безопасность [16–20].
Через 1–2 недели после начала применения данных препаратов концентрация эстрадиола падает до уровня, наблюдающегося в постменопаузе, и остается пониженной до конца терапии [1, 2, 6, 10, 15, 18, 19].
Бусерелин-депо – отечественный синтетический препарат группы агонистов ГнРГ, применяется в России с 1998 года. С середины 90-х годов прошлого века накоплен успешный опыт применения аГнРГ для терапии многих гинекологических заболеваний: он успешно применяется в терапии эндометриоза, миомы матки, гиперпластических процессов эндометрия, предменструального синдрома, бесплодия (в программах ЭКО) [16, 17, 19, 22].
Депо – форма препарата отличается от назальной меньшей кратностью введения (1 раз в 28 дней) и лучшим контролем применяемых доз (так как степень всасывания препарата слизистой носа индивидуальна и может значительно варьировать у разных пациентов, кроме того, при назначении депо-формы нет пропусков в приеме препарата) [19, 22, 23]. Среди положительных свойств Бусерелин-депо – метаболическая инертность в отношении липидного и углеводного обмена, отсутствие влияния на гепато-билиарную систему, отсутствие андроген-зависимых побочных реакций (акне, себорея, гирсутизм), препарат не приводит к увеличению массы тела и тромбоэмболическим осложнениям. Так называемая «возвратная» (add-back) терапия с использованием препаратов для МГТ с целью профилактики снижения плотности костной ткани необходима после 3-го месяца лечения аналогами агонистами Гн-РГ [21, 24, 25].
Применение Бусерелин-депо при проведении программ ЭКО в протоколах контролируемой гиперстимуляции яичников позволяет добиться синхронизации созревания большого числа фолликулов, предотвратить «паразитарный пик» ЛГ, повысить имплантационный потенциал эмбрионов, адекватно подготовить эндометрий к последующей имплантации, добиться более высокой частоты наступления беременности [10, 11, 15, 16]. Применение Бусерелина-депо не оказывает отрицательного влияния на сохранение овариального резерва и наступление беременности.
При лечении наружного генитального эндометриоза предпочтение отдается комбинированному лечению – операции с последующей гормональной терапией с целью профилактики рецидивов. По мнению большинства исследователей [1–3, 6–9, 15–17] хирургическое лечение без последующей гормональной терапии не обеспечивает полной ликвидации эндометриоидных очагов и у 20% больных не предотвращает рецидива заболевания.
Назначение предоперационной гормональной терапии не исключает назначение аналогичной терапии после оперативного вмешательства. Длительность послеоперационной гормональной терапии Бусерелин-депо также составляет 3 месяца (3 инъекции препарата через каждые 28 дней).
Материал и методы исследования
На протяжении 2014–2017 гг. на базе ГБУЗ ГКБ имени братьев Бахрушиных ДЗ г. Москвы нами проведено сравнительное исследование эффективности Бусерелин-депо в противорецидивной терапии эндометриоза яичников. Было проведено обследование 147 пациенток с подтвержденным диагнозом эндометриоза яичников. Критерием включения являлся также репродуктивный возраст больных: в исследуемой группе преобладал возраст в диапазоне от 27 до 35 лет, а средний возраст пациенток составил 31,76±5,84 лет. Критерием исключения служило наличие сопутствующей патологии гениталий.
При поступлении в стационар 108 пациенток (73,5% из 147 обследуемых предъявляли жалобы на нарушения менструального цикла (14,97%), тазовую боль (36,7%), бесплодие (43,5%). Жалобы на отсутствие наступления беременности при регулярной половой жизни без контрацепции предьявило 66 пациенток (44,9%).
Среди обследованных паценток роды были лишь у каждой четвертой (26,5%). Самопроизвольные выкидыши в анамнезе имелись у 5,4% пациентов.
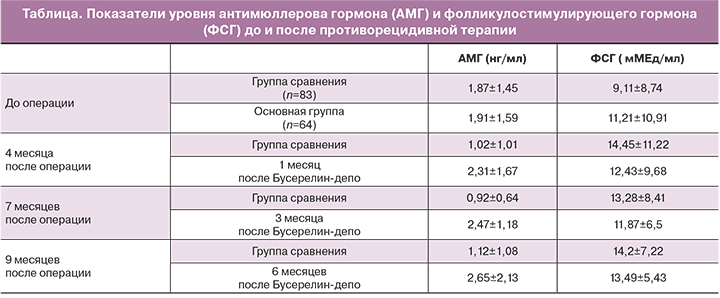
До и после хирургического лечения проводили оценку овариального резерва с помощью определения уровня антимюллерова гормона (АМГ) и фолликулстимулирующего гормона (ФСГ).
Всем пациенткам был выполнен лапароскопический доступ и в 53,3% наблюдений проведена унилатеральная резекция яичника (8 пациенток, С меньшей частотой выполнялись билатеральная резекция яичников – 33,3% и унилатеральная аднексэктомия – 3 13,3%.
После проведенного оперативного лечения всем пациенткам проводилась антибактериальная, противовоспалительная и симптоматическая терапия в условиях стационара. При выписке дальнейшее медикаментозное лечение было назначено 64 пациенткам (43,5% наблюдений). Медикаментозное лечение включало применение аГнРГ (Бусерелин-депо) по 1 внутримышечной инъекции 3,75 мг препарата 1 раз в 4 недели на протяжении 3 месяцев. После отмены Бусерелин-депо оценивали уровни АМГ и ФСГ через 1, 3 и 6 месяцев. Не получали противорецидивную терапию 83 пациентки (56,5%), которые составили группу сравнения.
Результаты исследования
Частота рецидива эндометриоза яичников на протяжении одного года наблюдения составила 19,3% (16 случаев) в группе сравнения и 4,7% (3 случая) у пациенток, получавших Бусерелин-депо.
До операции уровень АМГ у пациенток, заинтересованных в реализации репродуктивной функции, находился в пределах значений от 0,01 до 4,78 нг/мл.
Контроль в течение всего периода лечения показал, что средние значения онкомаркеров находились в пределах нормативных значений. Пациентки группы сравнения имели достоверно более низкие средние показатели АМГ по сравнению с женщинами, получавшими Бусерелин-депо (таблица).
Результаты УЗИ органов малого таза свидетельствовали о незначительном уменьшении объема резецированного яичника, но отчетливом определении фолликулярного аппарата. Только в 6,8% случаев было зафиксировано формирование невыраженного спаечного процесса в области оперированного яичника, что позволяет сделать вывод о важности дифференцированного подхода к хирургическому лечению пациенток с эндометриозом яичников. Данный подход определяет дальнейший репродуктивный потенциал пациенток.
Среди нежелательных явлений на фоне применения Бусерелин-депо (64 пациента) отмечены редкие реакции: нарушение ночного сна – бессонница (3–4,7%), головная боль (4–6,25%), депрессия (1–1,6%). Не наблюдались: потливость и изменение либидо, сухость слизистой оболочки влагалища, боли внизу живота, менструальноподобные кровотечения. Вероятно, низкая частота гипоэстрогенных побочных эффектов по данным анкетирования, была связана с высокой мотивацией пациентов на реализацию репродукции в связи с коротким курсом терапии. Следует отметить, что все нежелательные реакции удалось купировать назначением перорального мелатонина. Это требует дальнейших исследований. Представление клиницистов о высокой частоте нежелательных реакций на фоне применения Бусерелин-депо не соответствовало полученным данным. В проведенном исследовании не было немотивированных отказов от продолжения терапии Бусерелин-депо.
Обсуждение
После хирургического лечения эндометриоза яичников большинство исследователей обсуждают эффективность различных препаратов (комбинированные оральные контрацептивы, прогестины, агонисты ГнРГ, антигестагены, антагонисты ГнРг, ингибиторы ароматаз) для лечения болевого синдрома.
Корейское общество эндометриоза (KSE) рекомендует агонист ГнРГ для лечения боли, связанной с эндометриозом (уровень рекомендаций A) [6]. Различные лекарственные средства, такие как прогестин, эстроген, эстроген + прогестин, тиболон и т.д. могут использоваться в качестве дополнительной терапии. Необходимы дополнительные исследования относительно того, какой препарат наиболее подходит (класс С).
Влияние агониста ГнРГ на боль, связанную с эндометриозом, изучалось широко. Доказано, что агонисты ГнРГ превосходят плацебо в лечении болевого синдрома [14]. Пациентам репродуктивного возраста необходимо назначать поддерживающую терапию для коррекции симптомов, связанных с дефицитом эстрогенов и для профилактики снижения минеральной плотности костной ткани [15]. Большинство исследований рекомендуют назначение агонистов ГнРГ на протяжении менее шести месяцев для женщин старше 18 лет.
Именно поэтому в проведенном исследовании продолжительность назначения Бусерелин депо была короткой и составила 3 месяца. В связи с этим не потребовалось терапии поддержки (add-back), а частота симптомов гипоэстрогении составила 12,5%.
Даназол и гестринон эффективны для лечения боли, связанной с эндометриозом, но клиницисты должны знать о побочных эффектах (класс C) [14]. Даназол был первым лекарством, одобренным Управлением по контролю за продуктами и лекарствами (FDA), для лечения эндометриоза. Он подавляет овуляцию мощным антиэстрогенным и андрогенным эффектом. Тем не менее, рекомендуется ограничение его применения из-за побочных эффектов, таких как вазомоторные симптомы, нарушение функции печени и дислипидемия.
Антагонисты ГнРГ не подходят для общего использования (класс C) [14].
Если другие лекарства неэффективны, может использоваться ингибитор ароматазы в сочетании с другими лекарственными средствами [14].
Агонист ГнРГ Бусерелин-депо был выбран для снижения риска рецидива эндометриоза яичников, а не купирования дисменореи. Пациенткам репродуктивного возраста, желающим реализовать детородную функцию, показано назначение Бусерелина-депо коротким курсом (на протяжении 3 месяцев). Это позволяет не использовать поддерживающую терапию и уменьшает симптомы дефицита эстрогенов.
Заключение
Применение препарата агониста-ГнРГ (Бусерелин-депо) снижает риск рецидива эндометриоза яичников после хирургического лечения в 4,1 раза, не оказывает негативного влияния на овариальный резерв и позволяет повысить комплаентность лечения.



