Эндометриоз представляет собой сложный синдром, обусловленный эстрогензависимым хроническим прогредиентным воспалительным процессом, который поражает в основном яичники, а также другие органы и ткани малого таза [1]. Эндометриоз имеет огромную социальную значимость, поскольку встречается у 6–10% женщин, в т.ч. моложе 20 лет [2]. При этом заболеваемость неуклонно растет, достигая показателя распространения почти 15% женщин во всем мире [3]. Патология клинически проявляется хронической тазовой болью, дисменореей и бесплодием, причем последнее регистрируется в 30–50% случаев; и у 20–25% пациенток наблюдается длительное бессимптомное течение эндометриоза [4].
Одна из теорий патогенеза эндометриоза связана с миграцией фрагментов эндометрия за пределы слизистой оболочки матки, преимущественно в нижнюю часть брюшной полости, в результате повторяющихся овуляторных менструальных эпизодов [2]. Более того, и рецидивы эндометриоза на послеоперационном рубце могут быть следствием ретроградной менструации [5]. Однако примерно 90% женщин, у которых также наблюдается ретроградная менструация, не страдают эндометриозом [6].
В соответствии с данными [7], развитие эндометриоза может быть связано с сохранением внематочных «примитивных» клеток эндометрия с периода органогенеза; по мере полового созревания эти клетки дифференцируются в эстрогензависимые функционально-активные эндометриальные имплантаты, или гетеротопии. Имеется также мнение [8], что основным источником очагов экстрагенитального эндометриоза являются стволовые клетки костномозгового происхождения, которые способны мигрировать в системном кровотоке и вызывать эндометриоз различных внетазовых органов.
Тем не менее для персистенции эндометриоидных гетеротопий, независимо от источника их происхождения, необходимы не только определенный уровень эстрогенов, но и специфические условия микроокружения, которые во многом зависят от крупных молекул внеклеточного матрикса – протеогликанов [9].
Гепарансульфат протеогликаны (HSPGs) представляют собой белково-углеводные молекулы, каждая из которых состоит из корового (или сердцевинного) белка, к которому ковалентно присоединены неветвящиеся углеводные цепи сульфатированных гликозаминогликанов, несущие отрицательный заряд [9]. Одним из представителей HSPGs является синдекан-1 (SDC1), хорошо известный как CD138 – маркер плазматических клеток, а также хронического эндометрита [10].
Внимание к роли внеклеточного матрикса и протеогликанов в репродуктивной функции человека неуклонно возрастает [11, 12]. В экспериментах на мышах с дефицитом или нокаутом по основным белкам протеогликанов или ферментам их биосинтеза показана роль данных молекул в нарушениях репродуктивной функции, что можно экстраполировать на патологию человека [10].
HSPGs обеспечивают регуляцию сигнальных процессов, управляющих клеточной пролиферацией, дифференцировкой, миграцией, а также опухолевой трансформацией [13]. Трансмембранные и перицеллюлярные HSPGs (в частности, SDC1, глипикан (GPC1) и перлекан (HSPG2/Perl)) играют важнейшую роль в эмбрионально-морфогенетических, физиологических и патологических процессах, благодаря своей способности связывать и модифицировать активность многочисленных факторов роста и цитокинов, участвующих в межклеточных и клеточно-матриксных взаимодействиях [14,15].
Ферментом биодеградации HSPGs является гепараназа (HPSE), единственная эндогликозидаза у человека, которая укорачивает внеклеточные углеводные цепи HSPGs. Это приводит к высвобождению факторов роста, в т.ч. ангиогенных. Затем матриксная металлопротеиназа-9 «срезает» с клеточной поверхности коровые белки SDC1 [16].
Цель работы: изучить содержание HSPGs и HPSE в эутопическом и гетеротопическом эндометрии у пациенток с эндометриозом яичников (ЭЯ) III стадии.
Материалы и методы
Исследовано содержание трех представителей семейства HSPGs и HPSE в операционном материале 11 пациенток в возрасте 30,7±6,3 года с эндометриоидными кистами яичников III стадии (по критериям Л.В. Адамян и соавт. [17]), прооперированных в период с 2016 по 2017 гг. в гинекологическом отделении ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», являющемся клинической базой кафедры акушерства и гинекологии ФГБОУ ВО НГМУ. Оперативное лечение проведено в объеме удаления эндометриоидных кист, иссечения очагов эндометриоза в малом тазу и разъединения спаек.
Критерии включения в исследование: показания к плановому оперативному лечению в соответствии с клиническими рекомендациями [18], в т.ч. наличие эндометриоидных кист яичников диаметром более 3 см, пролиферативная фаза менструального цикла, гистологически верифицированный ЭЯ и информированное согласие пациентки. Критерии исключения: беременность, прием гормональных препаратов минимум за 3 месяца до операции, онкопатология, иммунодефицитные состояния, декомпенсированная экстрагенитальная патология.
Исследование содержания в крови маркера СА125 проведено с помощью набора реагентов ARCHITECT CA125 II Reagent Kit (Abbott, США).
От каждого образца резецированных эндометриоидных кист и биоптатов эндометрия немедленно отсекали фрагменты объемом примерно 0,3 см3 и помещали раствор RNALater (ThermoFisher Scientific), затем охлаждали до +4°С и хранили при -20°С для последующего исследования с помощью полуколичественной полимеразной цепной реакции (ОТ-ПЦР) в реальном времени. Оставшиеся фрагменты нативной ткани сразу фиксировали в забуференном формалине и заливали в гистомикс для гистологического и иммуногистохимического (ИГХ) исследования.
Выделение РНК из образцов проводили с помощью QIAzol Lysis Reagent (Qiagen, США) с доочисткой на колонках RNeasy Plus Mini (Qiagen, США) согласно инструкции производителя. Качество полученной РНК оценивали с помощью электрофореза в агарозном геле; после этого для синтеза кДНК использовали 0,2 мкг РНК и RevertAid First Strand cDNA Synthesis kit (ThermoFisher Scientific, США). Экспрессию исследуемых генов (SDC1, GPC1, HSPG2 и HPSE) анализировали с помощью ПЦР в реальном времени в трех повторах с использованием «БиоМастер» HS-qPCR SYBR Blue («Биолабмикс», РФ) и амплификатора CFX-96 Touch (Bio-Rad, США). Использовали следующие условия ПЦР: первичный прогрев при 95°C в течение 3 минут, затем 40 циклов 95°C в течение 10 с, 59°C в течение 20 с и 72°C в течение 30 с; суммарный объем реакции составлял 25 мкл. Экспрессию оценивали по методу 2ΔCt, в качестве гена сравнения использовали глицеральдегид-3-фосфатдегидрогеназу (GAPDH). Рабочие праймеры приведены в таблице.
Для ИГХ-исследования парафиновые срезы толщиной 4–5 мкм депарафинировали в сменах ксилола и этилового спирта. Антигены демаскировали в растворе цитратного буфера (рН 6,0; 10 mM цитрат натрия, 0,05% Tween-20) при нагревании до 95–98°C в течение 20 мин в микроволновой печи.
Для визуализации суммарных HSPGs в качестве первичных антител использовали мышиные моноклональные антитела к углеводным цепям гепарансульфата (HS) млекопитающих (Millipore, IgG1, клон T320.11, cat. N MAB2040, разведение 1:100). ИГХ-окрашивание проводили с использованием первичных мышиных антител к коровому белку SDC1 (ThermoScientific, IgG1/κ, клон Ml15; cat. N MS-1793-RQ, готовые к использованию); мышиных моноклональных антител к HSPG2/перлекану человека (Abcam, IgG1, клон А74, cat.N ab23418, 1:100); кроличьих поликлональных антител к GPC-1 человека (Abcam, IgG, cat. N ab226855, 1:100) и кроличьих поликлональных антител к HPSE (Abcam, IgG, cat. N ab85543, 1:100). Специфичность ИГХ-окрашиваний подтверждали использованием положительных контролей, указанных в инструкциях к антителам. Отсутствие неспецифического связывания антител было проверено с использованием негативных контролей в условиях эксперимента.
Продукты ИГХ-реакции на SDC1 визуализировали с помощью набора UltraVision Quanto Detection System HRP (ThermoScientific), для всех остальных HSPGs и НPSE – c помощью набора Mouse and Rabbit Specific HRP/DAB (ABC) Detection IHC kit (Abcam, cat. N ab64264) с диаминобензидином (DAB); ядра клеток докрашивали гематоксилином. Продукты ИГХ-реакции изучали с помощью микроскопа Axio Scope.A1 с фотокамерой AxioCam MRc5 (С.Zeiss) при увеличении 400.
Статистический анализ
Статистическую значимость отличий между группами оценивали с помощью критерия Манна–Уитни (критический уровень значимости p<0,05), используя программное обеспечение OriginPro 8.5. Для оценки корреляции между экспрессией HPSE в гетеротопиях и онкомаркера СА125 в сыворотке крови использовали коэффициент корреляции Спирмена.
Результаты и обсуждение
По данным ПЦР, у пациенток с ЭЯ III стадии в пролиферативную фазу цикла в операционном материале гетеротопий, по сравнению с их же эутопическим эндометрием, относительная экспрессия коровых белков трех ключевых представителей HSPGs – трансмембранных (SDC1 и GPC1) и локализующегося в эпителиальных базальных мембранах HSPG2/перлекана – характеризовалась статистически значимо более высокими показателями только для HSPG2/перлекана (p=0,047). Для двух других представителей семейства HSPGs значимые изменения не выявлены (рис. 1). При этом наличие мРНК указанных представителей семейства HSPGs показано также в эутопическом эндометрии у женщин репродуктивного возраста без патологии [10].
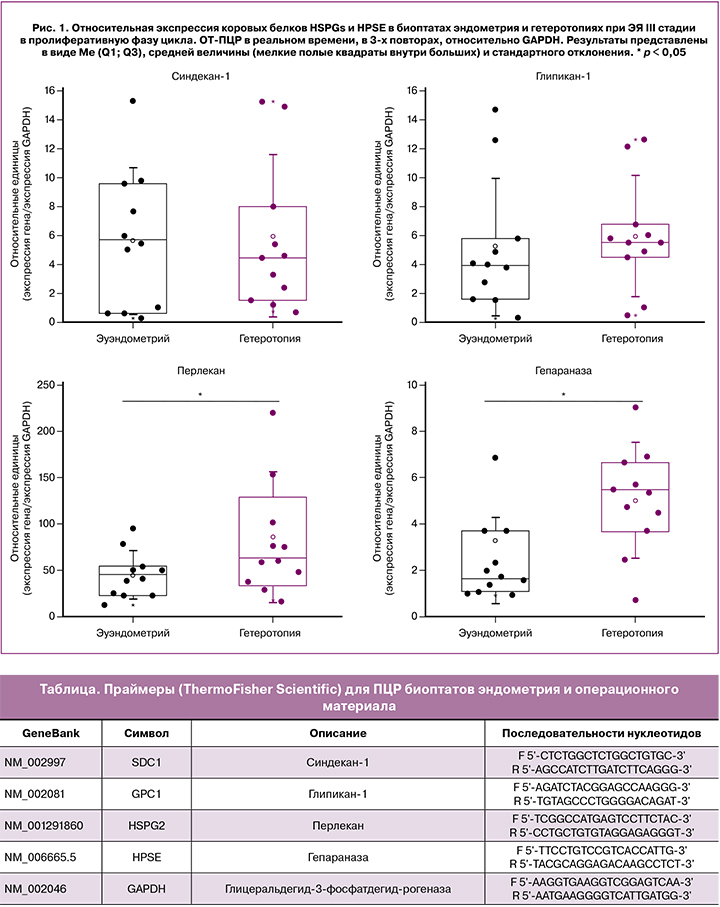
Наряду с HSPG2/перлеканом, в образцах гетеротопий, по сравнению с эутопическим эндометрием, значительно (в 2 раза, p=0,001) повышена экспрессия HPSE – фермента биодеградации углеводных цепей всех HSPGs. Ранее показано, что его экспрессия и на уровне мРНК, и на уровне белка значительно повышена в опухолях с агрессивным течением и в тканях с активной пролиферацией [9]. Другие ферменты биодеградации внеклеточного матрикса, например, металлопротеиназы, рассматриваются как важный и перспективный в отношении неинвазивной диагностики компонент патогенеза эндометриоза [19]. Авторы данного обзора делают вывод об актуальности дальнейшего поиска панелей биомаркеров эндометриоза, так как надежды исключительно на протеомику или геномику не оправдались, и пока не идентифицированы изолированные биомолекулы или группа биомаркеров с достаточной специфичностью и чувствительностью.
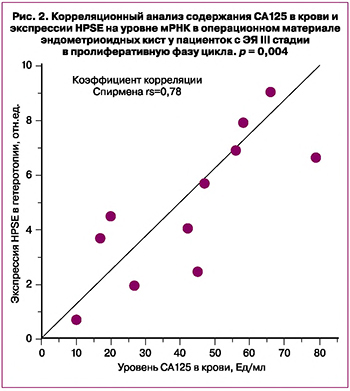 Возможная взаимосвязь между экспрессией коровых белков HSPGs с уровнем CA125 не была ранее изучена. Нами проанализированы результаты анализа ПЦР эндометриоидных гетеротопий M (SD)=5,56 (2,59) (от 0,70 до 9,04) и уровня скринингового маркера СА125 в сыворотке крови у пациенток с ЭЯ III стадии (41,64 (23,05)), который варьировал в пределах от 10 до 79 Ед/мл. Установлена положительная корреляция между относительной экспрессией HPSE в патологических очагах и содержанием указанного скринингового маркера (коэффициент корреляции Спирмена rs=0,78; 95% ДИ 0,168–1; p=0,004) (рис. 2), что требует дальнейших исследований.
Возможная взаимосвязь между экспрессией коровых белков HSPGs с уровнем CA125 не была ранее изучена. Нами проанализированы результаты анализа ПЦР эндометриоидных гетеротопий M (SD)=5,56 (2,59) (от 0,70 до 9,04) и уровня скринингового маркера СА125 в сыворотке крови у пациенток с ЭЯ III стадии (41,64 (23,05)), который варьировал в пределах от 10 до 79 Ед/мл. Установлена положительная корреляция между относительной экспрессией HPSE в патологических очагах и содержанием указанного скринингового маркера (коэффициент корреляции Спирмена rs=0,78; 95% ДИ 0,168–1; p=0,004) (рис. 2), что требует дальнейших исследований.
Оставшиеся фрагменты биоптатов эндометрия пациенток изучены с помощью ИГХ-исследования. В пролиферативную фазу цикла выявлен гетерогенный характер экспрессии суммарных HSPGs в эпителии желез – от выраженного до незначительного (рис. 3, а), при этом строма эндометрия содержала большое количество продуктов ИГХ-реакции. Анализ экспрессии коровых белков трех представителей семейства HSPGs обнаружил лишь следы SDC1 во внеклеточном матриксе эндометрия (рис. 3, б) и явную реакцию в плазмоцитах; неравномерную эпителиальную локализацию HSPG2/перлекана (рис. 3, в); а также умеренно выраженную экспрессию GPC1 в эпителии и строме эндометрия (рис. 3, г). Несмотря на то что суммарные HSPGs в пролиферативной фазе цикла у пациенток с ЭЯ III стадии были визуализированы с помощью антител к углеводным цепям, они также содержат и коровые белки GPC1 и HSPG2/Perl в составе сложной молекулы. Эти данные в целом согласуются с результатами ПЦР тех же клинических образцов (рис. 1).
HPSE – фермент биодеградации углеводных цепей HS – в эутопическом эндометрии выявлен в одиночных поверхностных эпителиоцитах и мелких очагах перигландулярной стромы (рис. 3, д), что подтверждает результаты ИГХ-исследования [20] о том, что у пациенток с эндометриозом экспрессия HPSE в эутопическом эндометрии в первую фазу цикла находится на минимальном уровне и нарастает к концу секреторной фазы цикла, способствуя десквамации.
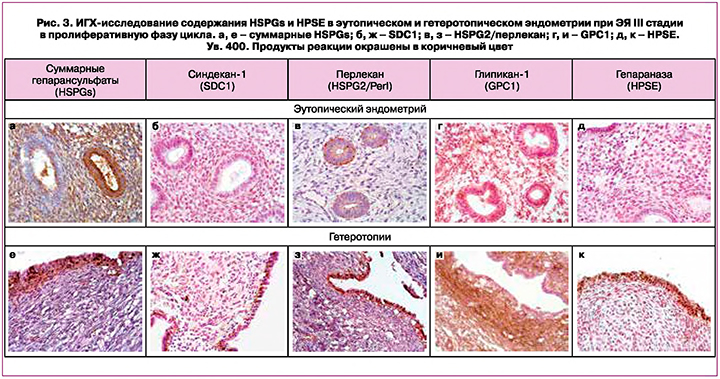
При ИГХ-исследовании резецированных эндометриоидных кист яичников основное внимание уделяли эпителию и цитогенной строме, где и обнаруживались DAB-позитивные суммарные HSPGs (рис. 3, е). Экспрессия SDC1 была незначительной, выявлялась преимущественно в базальных и базолатеральных цитолеммах эпителиоцитов (рис. 3, ж). Наибольшей в эпителии гетеротопий была реакция на HSPG2/Perl (рис. 3, з) при очень слабой реакции в цитогенной строме и фиброзной части капсулы. Напротив, реакция на GPC1 была выраженной в этих зонах при отсутствии реакции в эпителии (рис. 3, и).
Следует отметить, что HSPG2/Perl может действовать как мощный проангиогенный фактор, либо непосредственно представляя фактор роста эндотелия сосудов (VEGFA) их рецепторам VEGFR2, либо косвенно – после частичного расщепления HPSE углеводных цепей HSPGs (аналогичным способом – и другие факторы роста, связанные c HSPGs). Оба механизма могут инициировать передачу сигналов VEGFR2 со стимуляцией пролиферации, миграции и усиления проницаемости сосудов [21].
При этом экспрессия HPSE в эпителиальной компоненте гетеротопий была повышенной (рис. 3, к). По данным [20], HPSE высокоэкспрессирована в гетеротопиях независимо от стадии цикла. Ранее нами показано [22], что выраженная экспрессия HPSE в эпителии овариальных эндометриоидных кист у пациенток раннего репродуктивного возраста с ЭЯ III стадии ассоциирована с воспалительно-клеточной инфильтрацией и наличием болевого синдрома. Однако экспрессия SDC1 в эпителии была снижена, хотя статистически значимые закономерности не были выявлены. По данным ИГХ-исследования [23], в эутопическом эндометрии уровень экспрессии SDC1 в эпителии выше в секреторную фазу цикла, чем в пролиферативную, при этом стромальные фибробласты не отличались между фазами цикла.
Заключение
Таким образом, при ЭЯ III стадии относительная экспрессия коровых белков HSPG2/перлекана и HPSE в эндометриоидных гетеротопиях в пролиферативную фазу цикла достоверно превышает их относительную экспрессию в биоптатах эндометрия тех же пациенток. Установлена положительная корреляция между относительной экспрессией (по мРНК) HPSE в эндометриоидных гетеротопиях и содержанием онкомаркера СА125 в сыворотке крови.
Результаты исследования свидетельствуют о вовлеченности в патоморфогенез наружного генитального эндометриоза внеклеточных гликозилированных молекул семейства HSPGs. Эндогликозидаза HPSE, расщепляя углеводные цепи HSPGs, модифицирует внеклеточный матрикс ткани эндометрия, что может способствовать распространению эндометриоидных гетеротопий.



