Хронический эндометрит (ХЭ) – воспалительное заболевание, характеризующееся наличием маркера плазматических клеток CD138+ в строме эндометрия [1–4]. ХЭ встречается в 9–44% случаев у женщин с бесплодием, ассоциированным с неудачами имплантации и повторными потерями беременности [2, 3, 5, 6]. ХЭ трудно диагностировать, поскольку это заболевание не проявляется типичными клиническими или ультразвуковыми симптомами. В последнее время диагностика и лечение ХЭ привлекают больше внимания репродуктологов из-за его потенциальной связи с различными подгруппами репродуктивных неудач [4]. Гистероскопия остается «золотым стандартом» в диагностике ХЭ, однако процедура оценки зависит от оператора, что может снизить достоверность положительных результатов [7]. На сегодняшний день Syndecan-1 (CD138), трансмембранный гепаринсульфатпротеогликан, который специфично экспрессируется в плазматических клетках, используется для диагностики ХЭ и имеет 99% чувствительности [1, 8]. Локальное воспаление эндометрия является основным признаком при этом заболевании, сопровождающемся присутствием плазматических клеток, наличием отека, диссоциированным созреванием эпителиальных клеток и фибробластов [9]. Эти изменения на уровне микросреды эндометрия могут повлиять на рецептивность эндометрия, которая играет главную роль в имплантации эмбриона. Прием антибиотиков пероральным путем является основным методом лечения ХЭ; однако, несмотря на стандартизированное лечение, не всегда можно добиться 100% эффекта и восстановить функцию эндометрия. Таким образом, наряду со сложной диагностикой и лечением ХЭ, а также связанным с ним бесплодием, данная патология требует передовых терапевтических подходов.
В нашем исследовании мы оценили эффективность применения бовгиалуронидазы азоксимера в комплексном лечении ХЭ и решении вопроса повторных неудач имплантации (RIF).
Материалы и методы
Обследованы 84 женщины с ХЭ и RIF, которым провели лечение методом ЭКО/ИКСИ в Международном клиническом центре репродуктологии PERSONA с января 2020 г. по январь 2022 г. и наблюдение в течение 9 месяцев после лечения. Этическое одобрение было получено от Локальной этической комиссии клиники в декабре 2019 г. Все женщины дали информированное согласие на анонимное использование своих данных для исследовательской цели.
Критерии включения: возраст женщины до 38 лет или использование донорских ооцитов; наличие ХЭ по данным иммуногистохимического окрашивания образцов эндометрия CD138+, показывающее наличие ≥5 плазматических клеток на 10 HPF (наличие более 5 клеток является клинически значимым по развитию имплантационных неудач, что подтверждало ХЭ в соответствии с последними опубликованными критериями [3]): нормальный кариотип; отрицательный тест на антифосфолипидные антитела и нормальная полость матки, оцененная с помощью гистероскопии; перенос единственного эмбриона высокого качества ≥4АВ по Гарднеру [10].
Критерии исключения: возраст старше 38 лет и собственные ооциты; тяжелый мужской фактор; женщины без ХЭ, с наличием СD138 ≤5 клеток на 10 HPF; патологический кариотип; положительный тест на антифосфолипидные антитела; наличие патологии полости матки (эндометриоз, миомы, синехии, полипы, опухоли) по данным гистероскопии; перенос более 1 эмбриона, качество эмбриона ниже 4АВ по Гарднеру [10].
Всем включенным пациентам была проведена диагностическая офисная гистероскопия с биопсией и иммуногистохимическим исследованием CD138+. Женщины были разделены на 2 группы. В 1-ю группу вошли 50 женщин, получивших антибактериальную терапию в сочетании с бовгиалуронидазы азоксимером; во 2-ю группу – 34 пациентки, получившие только курс антибиотикотерапии.
Офисная гистероскопия и иммуногистохимическое исследование
Всем пациентам гистероскопия (Karl Storz, Tuttlingen, Германия) и биопсия эндометрия проводились в секреторную фазу менструального цикла на 7-й день после пика уровня лютеинизирующего гормона (ЛГ) или на 6-й день приема прогестерона в циклах заместительной гормональной терапии. Образцы эндометрия фиксировали в формалине, затем готовили парафиновые срезы толщиной 5 мкм. Предметные стекла окрашивали с применением моноклональных антител CD138 (Thermo scientific-STP-120, Mass, USA) по стандартному протоколу. Наличие ХЭ оценивалось по количеству плазматических клеток CD138+ в строме эндометрия. Образцы биопсии для нашего исследования считались клинически значимым по развитию имплантационных неудач для ХЭ, если ≥5 плазматических клеток было идентифицировано на 10 HPF в соответствии с последними опубликованными критериями [3].
Лечение хронического эндометрита
В комплексное лечение ХЭ основной группы пациенток входил курс фторхинолонов (офлоксацин 400 мг, Zentiva, Чехия) в течение 10±4,5 дня в дозе 800 мг/сут и курс бовгиалуронидазы азоксимера (Лонгидаза, НПО «Петровакс Фарм»). После курса антибиотикотерапии был назначен препарат бовгиалуронидаза азоксимер в дозе 3000 МЕ в 2 мл 2% раствора лидокаина внутримышечно, с интервалом 3 дня, всего 10 инъекций. Лечение было рассчитано на 2 цикла. В контрольной группе женщины получали только курс антибиотикотерапии.
Повторная биопсия эндометрия и иммуногистохимическое исследование
Всем пациентам после лечения повторно проводили биопсию эндометрия также в секреторную фазу менструального цикла на 7-й день после пика ЛГ или на 6-й день приема прогестерона в искусственном цикле с помощью катетера для биопсии Pipelle de Cornier. Мы связались с женщинами по телефону и спросили об итогах их первого цикла вспомогательных репродуктивных технологий (ВРТ) в течение 9 месяцев после лечения.
Характеристика программы ВРТ
Стимуляцию яичников проводили с использованием длинного протокола с агонистами гонадотропин-рилизинг-гормона (ГнРГ), короткого протокола с агонистами ГнРГ или протокола с антагонистами ГнРГ [11]. Начальная доза фолликулостимулирующего гормона выбиралась в соответствии с возрастом пациентки и овариальным резервом, прогнозируемым по уровню антимюллерова гормона (АМГ) и количеству базальных фолликулов. Для индукции окончательного созревания ооцита использовали хорионический гонадотропин человека (ХГЧ) в дозе 10 000 МЕ (Chorapur 5000 IU, Ferring Pharmaceuticals, Германия) при достижении фолликулом диаметра более 18–21 мм по данным трансвагинального ультразвукового исследования. Забор яйцеклеток проводили через 36 ч после введения ХГЧ. Используемые протоколы были основаны на предпочтениях врача. Все эмбрионы были криоконсервированы.
Эмбрион высокого морфологического качества ≥4АВ по строгим критериям Гарднера был перенесен на 6-е сутки введения прогестерона (Утрожестан вагинальные капсулы 200 мг, OLIC Limited, Таиланд) в искусственном цикле или на 7-е сутки после пика ЛГ в естественном цикле. Лютеиновая фаза поддерживалась вагинальным прогестероном.
Статистический анализ
Данные, полученные при исследовании, были подвергнуты статистической обработке методом вариационной статистики с использованием бесплатной версии программы Jamovi. Среднее арифметическое (М) и стандартное отклонение (SD) рассчитывались для количественных показателей, данные представлялись в виде M±SD. Двусторонний t-критерий Стьюдента использовался при сравнении средних значений. Абсолютными (n) и относительными (%) значениями описаны качественные переменные. Критерий χ2 использовался для сравнения частот и качественных переменных. Критический уровень значимости (р) при проверке статистических гипотез принимался за 0,05.
Результаты и обсуждение
Всего в исследования были включены 84 женщины с ХЭ и RIF. Демографические и клинические характеристики были сравнены в группах (табл. 1). Возраст, индекс массы тела, длительность бесплодия, уровень АМГ, паритет и количество выкидышей, абортов, количество RIF, встречаемость воспалительных и невоспалительных заболеваний органов мало таза, а также воспалительных заболеваний любой локализации существенно не отличались между двумя группами. Частота первичного бесплодия была выше в основной группе – 22 (44%) против 11 (33,3%). Частота внематочной беременности была значительно выше в контрольной группе – 11 (33,3%) против 9 (18%) (табл. 1).
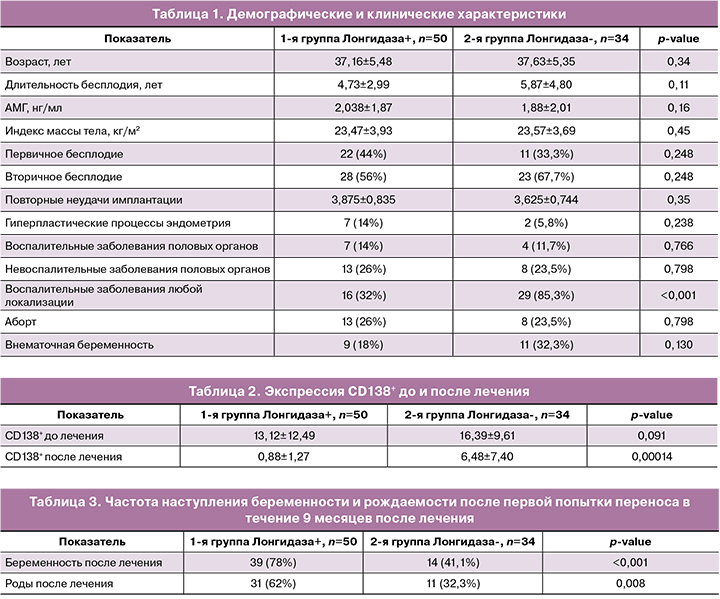
Уровень экспрессии CD138+ клеток до начала лечения в группах статистически не отличался (13,12±12,49 и 16,39±9,61 соответственно, Р=0,091). После проведенного лечения в группе с лонгидазой отрицательный результат на CD138+ после лечения был значительно выше, чем в группе контроля (0,88±1,27 против 6,48±7,40, р=0,00014) (табл. 2).
Всем 84 женщинам в первом цикле после лечения перенесли единственный оттаянный эмбрион высокого морфологического качества ≥4АВ по критериям Гарднера. Частота наступления клинической беременности на один перенос была значительно выше в группе 1 по сравнению с группой 2 (78% против 41,1%; р<0,001). Соответственно, частота живорождений была значительно выше в основной группе (62% против 32,3%; р=0,008) (табл. 3).
Во время исследования не было побочных реакций на лечение Лонгидазой и осложнений, связанных с гистероскопией, включая значительное кровотечение, инфекцию или абсорбцию жидкости. Среди 34 женщин в контрольной группе, чьи результаты анализов на ХЭ все еще были положительными в конце их участия, 13 женщинам был предложен курс лечения Лонгидазой.
Поиски оптимального лечения ХЭ продолжаются до сих пор на различных уровнях. ХЭ характеризуется наличием плазматических клеток в строме эндометрия [1–3], а также зачастую фиброзированием стромы эндометрия. Ремоделирование соединительной ткани посредством бовгиалуронидазы азоксимера позволяет улучшить репаративные процессы, нормализовать кровообращение и рецепторный аппарат в полости матки.
Заключение
Повышение результативности программ ВРТ является сложной задачей, решение которой, с одной стороны, определяется качеством эмбриона, его имплантационным потенциалом, с другой – рецептивностью эндометрия. При этом на качество эмбриона наше влияние ограничено. Напротив, возможность диагностики и лечения патологии эндометрия представляется более реальной. Добавление в схемы лечения ХЭ ферментативных препаратов, таких как бовгиалуронидаза азоксимер, ускоряет процесс нормализации эндометрия, что сокращает время достижения желанной беременности. Безусловно, хорошо спланированные рандомизированные плацебо-контролируемые исследования с ослеплением позволят более точно определить вклад ферментативных препаратов в лечение патологии эндометрия.



