Широкий спектр патологии эндометрия в свете вопросов реализации репродуктивной функции ассоциирован с хроническим эндометритом (ХЭ) (бесплодие, невынашивание беременности, плацентоассоциированная патология) [1–4].
Несмотря на доказанную значимость ХЭ в генезе репродуктивных неудач, продолжаются дискуссии в отношении самого эндометрита, его влияния на звенья морфогенеза (рецепторное, сосудистое, иммунологическое) и отдаленных последствий длительно текущего воспалительного процесса в полости матки.
Можно полагать, что данный факт связан с исторически сложившейся ситуацией отрицания ХЭ как нозологии в связи с ежемесячной десквамацией эндометрия и предполагаемой стерильностью полости матки. Более того, в отечественных работах многие авторы основываются на данных только зарубежных исследователей, которые не всегда точно и в полном объеме отражают диагностические подходы и не опираются на достижения многочисленных отечественных исследований по проблеме верификации и методов лечения ХЭ.
Необходимо отметить, что не только разногласия относительного влияния ХЭ на возможность реализации репродуктивных планов, но и сами лечебные мероприятия в отношении данной патологии оспариваются разными специалистами, несмотря на большое количество исследований с высоким уровнем доказательной базы [5–7]. Возможно, это способствует несвоевременному лечению заболевания и формированию вторичных органических повреждений в эндометрии, что влечет стойкое нарушение его имплантационных характеристик [8, 9].
Основной проблемой при ХЭ является не просто наличие факта присутствия патологического агента в эндометрии, а длительность течения заболевания, степень дисбаланса локальной иммунной системы, дисрегуляции сосудистого русла и рецепторного профиля эндометрия [10–13].
Рецепторный профиль эндометрия, а именно эстрогеновые рецепторы (ER) и прогестероновые рецепторы (PR), в течение овуляторного менструального цикла и при бесплодии различного генеза полностью верифицирован и характеризуется следующими паттернами экспрессии: динамическими – характерными для ER и PR в железистом компоненте и постоянными – характерными для экспрессии PR в строме в течение всех фаз менструального цикла. ХЭ нарушает все звенья морфогенеза циклической трансформации эндометрия и в первую очередь экспрессию ER и PR, изменяя клеточный ответ на стероиды, что способствует дисфункциональным состояниям эндометрия и влияет на успешность имплантации, в том числе в программах вспомогательных репродуктивных технологий (ВРТ). При ХЭ верифицируются существенные изменения экспрессии ER и PR как в стромальном, так и в железистом компоненте по сравнению со здоровыми женщинами [8, 14–16].
Следует подчеркнуть, что в клинической практике уделяется недостаточно внимания значимости рецепторного профиля эндометрия в патологии репродуктивной функции, ассоциированной с маточным фактором, несмотря на широкое применение гормональных препаратов (в прегравидарном периоде, протоколах ВРТ, при сохранении беременности и гинекологических заболеваниях), напрямую воздействующих именно на ER и PR.
Ключевую роль в морфогенезе эндометрия играют половые стероидные гормоны, которые опосредованно или непосредственно влияют на все звенья трансформации эндометрия. Циклическая трансформация эндометрия основана на полноценном функционировании и балансе взаимодействия рецепторов и координируется 17β-эстрадиолом (E2), который является предиктором роста эндометрия, оптимальной пролиферативной активности эпителиальных и стромальных клеток во время фолликулярной фазы, а также прогестероном (P4), ответственным за формирование полноценной секреторной трансформации [17–19].
E2 взаимодействует с рецепторами эстрогена и IL-1β через NF-κB (ядерный фактор каппа-легкой цепи-энхансером активированных В-клеток) и увеличивает экспрессию комплекса генов, участвующих в последующем в имплантации. Кроме непосредственно геномных путей, регуляторное влияние эстрогенов может реализоваться через негеномные пути через активацию рецептора GPER1, находящегося на мембране клеток [20–22].
Через геномные механизмы прогестерон изменяет экспрессию большого числа генов, вовлеченных в трансформацию эндометрия. Через негеномные пути прогестерон, как и эстроген, взаимодействует с тирозинкиназами и регулирует экспрессию через мембранные рецепторы mPRα, mPRβ и mPRγ [23].
На сегодняшний день накоплены данные об этиотропной терапии ХЭ, кроме того, широко применяются стандартные схемы терапии при неустановленном этиологическом факторе. Однако утверждать о высокой эффективности лечебных мероприятий в отношении ХЭ и восстановлении морфофункциональных характеристик эндометрия не представляется возможным без верификации степени выраженности воспалительного процесса, оценки рецепторного профиля, сосудистого компонента до и после проведения терапии.
Цель исследования: оценка рецепторного профиля эндометрия (ER, PR) на фоне терапии ХЭ с использованием экзогенных природных противомикробных пептидов и цитокинов (препарат «Суперлимф»).
Материалы и методы
Проведено исследование рецепторного профиля эндометрия у 130 пациенток с маточным фактором бесплодия и выраженным ХЭ, установленным гистологическим и иммуногистохимическим методами в отделе патоморфологии ФГБНУ «НИИ АГиР им. Д.О. Отта» с 2021 по 2024 гг. при наличии информированного согласия пациенток.
Критерии включения в исследование: возраст 25–38 лет; бесплодие, ассоциированное с маточным фактором; нормальное содержание овариальных и гипофизарных гормонов; менструальный цикл (28 дней); средняя стадия фазы секреции; гистологически и иммуногистохимически верифицированный выраженный ХЭ.
Критерии исключения из исследования: эндометрий пролиферативной фазы; гиперплазия эндометрия; генитальный эндометриоз независимо от степени; миома матки независимо от формы; наступление беременности во время проведения исследования; перенесенный SARS-CoV-2 за 3 месяца до биопсии; прием любых гормональных препаратов за 2–3 месяца до включения в исследование.
Методы лечения. Все пациентки получали антибактериальную терапию (доксициклина моногидрат 100 мг 2 раза в день в течение 10 дней) в сочетании с иммуномодулирующей терапией комплексом экзогенных природных противомикробных пептидов и цитокинов (препарат «Суперлимф», ООО «Альтфарм», Россия). Суппозитории 25 ЕД применяли в течение трех менструальных циклов с 5-го по 25-й дни 1 раз в сутки вагинально вечером. Через 2 месяца после проведения терапии произведена повторная пайпель-биопсия эндометрия на 19–22-й дни цикла.
Исследование было одобрено этическим комитетом ФГБНУ «НИИ АГиР Д.О. Отта».
Гистологическое исследование биоптатов эндометрия проведено по стандартной методике с фиксацией материала в 10% нейтральном формалине (рН 7,2) и гистологической проводкой в гистопроцессоре Histo-Tek VP1 (Sakura, Япония), материал заливали в парафин и из полученных блоков изготавливали срезы толщиной 3–4 мкм с последующей окраской их гематоксилином и эозином («БиоВитрум», Россия). При световой микроскопии оценивали соответствие строения эндометрия дню менструального цикла, состояние желез, стромы и сосудистого компонента эндометрия, наличие гистологических признаков воспалительных и патологических изменений. Исследование проводили на микроскопе Olympus CX31 (Япония) при увеличении ×100, ×200, ×400.
Иммуногистохимическое исследование проводили на парафиновых срезах по стандартной методике с одноэтапным протоколом демаскировки антигена. Иммуногистохимический метод исследования включал количественную и качественную оценку экспрессии эстрогенов и прогестерона (ERα и PR) в биоптатах эндометрия с использованием антител к рецепторам ERα (клон 1D5) и рецепторам PR (клон PR 636) в стандартном разведении 1:50 производства Dako Cytomation (Дания). Для диагностики ХЭ использовали антитела СD8+ [клон СD 8/144B], СD20+ [клон L26], СD4+ [клон 4 В12], СD138+ [клон М115], в стандартном разведении производства Dako Cytomation (Дания). В качестве системы визуализации использовали Dako Cytomation LSAB2 System-HRP (Dako, Дания). Верификацию ХЭ осуществляли комплексным методом с учетом данных гистологического исследования (инфильтрация эндометрия лимфоцитами, моноцитами, плазмоцитами, фиброз стромы, склероз сосудистого русла), а также иммуногистохимического метода путем подсчета количества иммунопозитивных клеток при увеличении микроскопа ×400 во всех полях зрения эндометрия. Степень выраженности ХЭ определяли по классификации Толибовой Г.Х. [3]. Оценку экспрессии эстрогеновых и прогестероновых рецепторов проводили на основании Histochemical Score (H-Score)=ΣP(i)×I, где I – интенсивность окрашивания, выраженная в баллах от 0 до 3; P(i) – процент клеток, окрашенных с разной интенсивностью. Интенсивность окрашивания: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание. Максимальное значение счета соответствует 300 единицам. Учитывали характер распределения экспрессии рецепторов в исследуемом материале (равномерно, неравномерно). Экспрессию рецепторов половых гормонов (эстрогена и прогестерона) ниже 70 баллов расценивали как снижение [3].
Статистический анализ
Статистический анализ результатов исследования проводили с помощью программы STATISTICA 10.0 (StatSoft, Inc.). Качественные признаки представлены в виде абсолютных (количество) и относительных (частота в %). Данные были проверены на нормальность распределения с помощью критерия Шапиро–Уилка. При сопоставлении зависимых показателей, измеренных в номинальной шкале, применяли тест Мак-Немара, эффективность лечения оценивалась с помощью вычисления отношения шансов (OR) с 95% доверительным интервалом (95% CI). Сравнение количественных непрерывных признаков зависимых выборок выполнено с помощью непараметрического критерия Вилкоксона, независимых выборок – с помощью критерия Манна–Уитни. Результаты представлены как медианы (Me) и интерквартильный размах [Q1; Q3]. Корреляционный анализ был выполнен с помощью оценки ранговой корреляции Спирмена (rs). Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным 0,05.
Результаты и обсуждение
Диапазон возраста обследованных составил от 25 до 38 лет. На наличие беременности в анамнезе указали 101/130 (77,7%) пациенток, прерывание беременности хирургическим путем по желанию женщины имело место у 60/130 (46,2%), неразвивающаяся беременность и самопроизвольный выкидыш I триместра – у 41/130 (31,5%) пациенток. На наличие доброкачественных заболеваний шейки матки в анамнезе указали 91/130 (70,0%), урогенитальной инфекции в анамнезе – 61/130 (46,9%) обследованных, носителями вируса папилломы высокого онкогенного риска были 29/130 (22,3%), генитального герпеса – 8/130 (6,2%) женщин.
Результаты гистологического исследования (таблица) показали, что у пациенток с бесплодием, ассоциированным с маточным фактором, и выраженным ХЭ, после терапии верифицировано статистически значимое снижение морфологических признаков ХЭ: фолликулоподобных инфильтратов (р<0,001), периваскулярного фиброза (р<0,001), фибропластических изменений стромального компонента (р<0,001) и склероза сосудистой стенки спиральных артерий (р<0,001).
Полученные результаты согласуются с данными других авторов, что после проведения терапии с использованием препарата «Суперлимф» разрешались признаки ХЭ [24–26].
Данные иммуногистохимического исследования после терапии ХЭ также демонстрируют значимое снижение степени выраженности заболевания. У пациенток преобладал слабо выраженный ХЭ (88/130 (67,7%)) и умеренно выраженный ХЭ (36/130 (27,7%)), при этом выраженный ХЭ после терапии верифицирован только у 6/130 (4,6%) женщин.
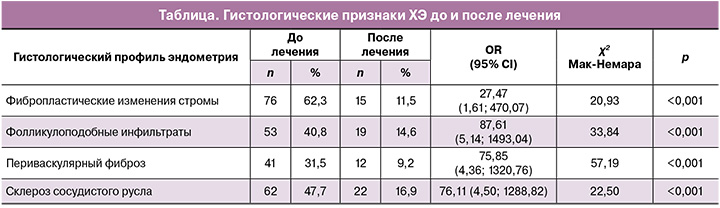
В биоптатах эндометрия до лечения ХЭ при оценке экспрессии ER в железистом компоненте эндометрия средней стадии фазы секреции предполагаемого «окна имплантации» верифицировано неравномерное распределение и мультифокальное повышение экспрессии рецепторов. После терапии в железистом компоненте отмечалось статистически значимое снижение экспрессии ER (р<0,001). В стромальном компоненте верифицировано статистически значимое повышение экспрессии ER (р<0,001). Данные представлены на рисунке 1.
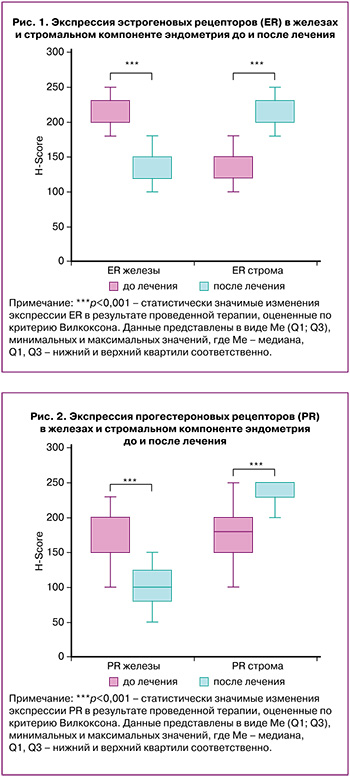
При анализе экспрессии PR после лечения верифицировано статистически значимое снижение (р<0,001) в железистом компоненте и статистически значимое повышение (р<0,001) в стромальном компоненте эндометрия (рис. 2).
Следует отметить, что в исследованиях Доброхотовой Ю.Э. и соавт. после проведенной аналогичной терапии верифицировано увеличение экспрессии рецепторов прогестерона в строме эндометрия в 2,7 раза [26].
На рисунках 3 и 4 представлен морфологический профиль эндометрия до и после лечения ХЭ.
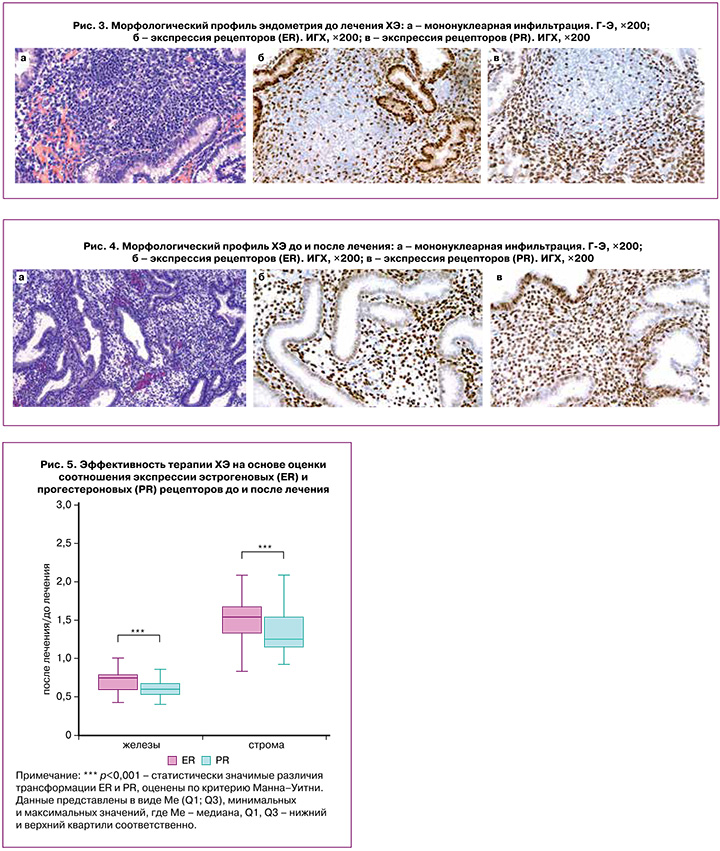
Полученные результаты показали, что после терапии ХЭ диагностировано восстановление рецепторного профиля эндометрия с равномерным распределением ER и PR в стромальном компоненте эндометрия. На основании соотношения экспрессии ER и PR была оценена относительная эффективность терапии ХЭ (рис. 5).
Показано, что после антибактериальной терапии в сочетании с препаратом «Суперлимф» экспрессия ER в строме повысилась в 1,53 [1,33; 1,66] раза, что более выражено по сравнению с экспрессией PR, которая в строме после лечения увеличилась в 1,25 [1,15; 1,53] раза (p<0,001).
При этом после терапии экспрессия PR в железах имеет более выраженное снижение в 1,67 [1,50; 1,88] раза по сравнению со снижением экспрессии ER в 1,33 [1,28; 1,67] раза (p<0,001). Кроме того, показана взаимосвязь между экспрессией ER и PR в железистом и стромальном компонентах до начала лечения и степенью изменения ee после лечения (отношение экспрессии после лечения к экспрессии до лечения). Наблюдается обратная корреляционная зависимость между экспрессией ER и PR в строме до лечения и степенью повышения ее после лечения, rs=-0,91 и rs=-0,92, (p<0,001) соответственно.
Таким образом, при более выраженном снижении экспрессии ER и PR в строме до лечения наблюдается более значимое ее повышение после лечения. При этом в железах эндометрия более высокие значения экспрессии ER и PR до лечения эффективнее снижаются после лечения, rs=-0,50 и rs=-0,71 (p<0,001) соответственно.
В норме экспрессия ER достигает максимума в ранней пролиферативной фазе с небольшим снижением в поздней пролиферативной и ранней секреторной фазах как в железах, так и в строме функционального слоя эндометрия. Затем экспрессия ER заметно снижается в поздней секреторной фазе в железистых клетках больше, чем в стромальных клетках. Экспрессия PR постепенно повышается в течение пролиферативной фазы и ранней стадии фазы секреции в железах эндометрия, достигая нулевых значений в средней и поздней стадиях фазы секреции. Данная закономерность согласуется с динамикой секреции половых гормонов и реакции эндометрия на их влияние [14, 15, 27, 28].
Повышенная экспрессия ER и PR в железах на фоне снижения экспрессии ER и PR в стромальном компоненте эндометрия на 19–22-й дни цикла у пациенток с ХЭ подтверждалась, в том числе, в ряде зарубежных исследований [15, 16]. Нарушение соотношения экспрессии ER и PR в железах и строме эндометрия приводит к дисбалансу секреторной трансформации эндометрия и неготовности к имплантации бластоцисты. Соответственно экспрессия PR, зависимая от экспрессии ER, является субоптимальной для имплантации оплодотворенной яйцеклетки. Поэтому повышение экспрессии ER с одновременным снижением экспрессии PR в клетках эндометрия в раннюю секреторную фазу может нарушать способность эндометрия к имплантации оплодотворенной яйцеклетки и приводить к бесплодию. При ХЭ смещение максимального пика экспрессии ER и PR в строме в сторону пролиферативной фазы характеризуется более ранним истощением рецепторного профиля с существенным снижением ER в раннюю секреторную фазу.
Снижение экспрессии ER и PR в железистых клетках и повышение экспрессии в строме после проведенной терапии с применением препарата «Суперлимф» по сравнению с исходными данными указывают на восстановление рецепторного профиля эндометрия в соответствии с клеточными процессами, происходящими в секреторную фазу цикла, от «неравномерного» исходно до «равномерного» после лечения. Более того, положительные изменения экспрессии ER и PR коррелировали со степенью выраженности ХЭ, и при слабой выраженности наблюдалась самая значимая положительная динамика. Учитывая, что на долю «слабо» и «умеренно» выраженного ХЭ после лечения в исследовании приходилось 124/130 (95,4%) случаев, можно утверждать, что восстановление рецепторного профиля эндометрия вследствие применения комплекса противомикробных пептидов и цитокинов увеличивает шансы на успешную имплантацию и репродуктивные исходы.
Наступление беременности является достоверным показателем эффективности проводимой терапии, а критерии живорождения указывают на восстановление не только морфофункциональных характеристик эндометрия, но и всех звеньев морфогенеза гравидарной трансформации, включая рецепторный профиль эндометрия.
В ранее проведенных клинических исследованиях продемонстрировано, что в комплексе со стандартной терапией применение препарата «Суперлимф» приводит к увеличению частоты наступления беременности в 3 раза у пациенток с бесплодием более 5 лет. Частота рождения жизнеспособного плода увеличилась в среднем на 20%, а потери беременности в I триместре снизились в 6 раз. Кроме того, доказано, что сочетанная терапия способствует снижению частоты преждевременных родов в 2,5 раза и акушерских осложнений при беременности (преэклампсии, антенатальной гипоксии и задержки роста плода) – в 2 раза [29]. Отсутствие плазматических клеток в биоптатах эндометрия было выявлено у 79,3% обследованных. Отмечено увеличение частоты наступления беременности в программах ВРТ в 1,5 раза с показателем живорождения 45,3%. Особо значимыми являются данные об увеличении частоты наступления беременности среди пациенток с продолжительностью бесплодия 5 лет и более (в 1,4 раза) и частоты живорождений (в 2,7 раза) [25]. Учитывая, что в проспективном рандомизированном плацебо-контролируемом ослепленном исследовании комплексного лечения ХЭ с использованием препарата «Суперлимф» у пациенток с бесплодием в группе, где применялась только антибиотикотерапия, отмечалось меньшее снижение удельного веса выраженного ХЭ [24], вероятно, нарушения рецептивного профиля сохранялись чаще, чем в основной группе, что также могло приводить к снижению результативности лечения бесплодия.
Заключение
Проведенное исследование дает основание утверждать, что применение экзогенных природных противомикробных пептидов и цитокинов в комплексном лечении ХЭ оказывает выраженное положительное влияние на иммунологический компонент морфогенеза трансформации эндометрия с уменьшением количества провоспалительных клеток и предупреждением реализации каскада сложных патогенетических путей органического повреждения эндометрия. Именно снижение степени выраженности ХЭ приводит к восстановлению рецепторного профиля эндометрия у пациенток с патологией репродуктивной функции маточного генеза.



