Повышенный интерес к проблеме истинного врастания плаценты (placenta accreta) можно объяснить
несколькими причинами: 1) число беременных данной группы неуклонно растет из-за значительного
увеличения числа операций кесарева сечения во всем мире; 2) родоразрешение этой категории пациенток сопровождается массивным, угрожающим жизни кровотечением; 3) стремительное развитие эндоваскулярной хирургии дает возможность не только контролировать интраоперационную кровопотерю, но и способствовать проведению органосохраняющих вмешательств, избегая гистерэктомии. В настоящее время placenta accreta встречается с частотой 1 на 2500–7000 родов [5, 9, 14, 16, 23, 24]. Рубец на матке после кесарева сечения и предлежание плаценты – два ведущих фактора в формировании placenta accretа [5, 20, 22]. В течение длительного времени существовало положение о необходимости плановой гистерэктомии во время кесарева сечения без попыток отделения плаценты у пациенток с placenta accretа во избежание массивного кровотечения [1, 2, 12,
13, 21, 27]. Однако не следует забывать, что гистерэктомия, проводимая в условиях геморрагического шока и продолжающегося кровотечения, может привести к гибели женщины [28].
В последние годы появились сообщения об успешном «консервативном» лечении placenta accrete [6, 8, 11, 15, 18, 25, 26, 29], заключающемся в оставлении плаценты in situ с последующей: 1) локальной резекцией плацентарного ложа и применением метотрексата [3, 17, 19]; 2) метропластикой; 3) эмболизацией маточных артерий и/или парентеральным введением метотрексата.[4, 7].
Поиск нового подхода к ведению пациенток с врастанием плаценты обусловлен, в первую очередь, стремлением минимизировать кровопотерю, неизбежно сопровождающую данную патологию и достигающую 5000–7000 мл. Кроме того, для качества дальнейшей жизни пациенток имеет большое значение сохранение репродуктивной функции. Селективная эмболизация маточных артерий является альтернативой хирургическому лечению массивных кровотечений в ситуациях неэффективности стандартной акушерской тактики и утеротонической терапии. Эмболизация маточных артерий при placenta accreta оказывается эффективной у 50–87% пациенток [3, 6]. Современная и наиболее широко применяемая методика родоразрешения беременных с врастанием плаценты подробно отражена в работе T. Angstmann и соавт. [2 ].
В Центре планирования семьи и репродукции эмболизация маточных артерий при родоразрешении пациенток с врастанием плаценты стала внедряться в 2006 г. С 2009 г. разрабатывается органосохраняющая методика, основными хирургическими этапами которой являются: катетеризация бедренной артерии, установка проводников в маточных артериях; срединная лапаротомия; продольный разрез в дне матки для извлечения плода, плацента остается in situ – донное кесарево сечение; зашивание матки; эмболизация маточных артерий; удаление плаценты и иссечение скомпрометированного миометрия вместе с вросшей плацентой через разрез в нижнем маточном сегменте; метропластика. Была предпринята попытка консервативного ведения пациенток с врастанием плаценты, у которых хирургический этап ограничивался донным кесаревым сечением, оставлением плаценты in situ, эмболизацией маточных артерий. Удаления плаценты в момент родоразрешения не проводилось, на 52–69 сут послеродового периода происходила ее экспульсия.
Целью данной работы стало обобщение опыта ведения пациенток с истинным врастанием плаценты с использованием перевязки внутренних подвздошных артерий, эмболизации маточных артерий и определение возможности проведения органосохраняющих операций при placenta accreta.
Материал и методы исследования
Мы проанализировали 30 историй родов пациенток, у которых диагностировано предлежание и врастание плаценты в рубец после предшествующих операций кесарева сечения. Врастание плаценты выявлено с частотой 1 на 1328 родов. У всех родильниц удалось избежать удаления матки, осуществив органосохраняющие операции. У 15 пациенток (1-я группа) с целью гемостаза применена перевязка внутренних подвздошных артерий. Разрез на матке для извлечения плода и плаценты проводился в нижнем маточном сегменте. У 15 пациенток (2-я группа) извлечение плода осуществлено путем разреза в дне матки с последующей эмболизацией маточных артерий. Диагноз врастания предлежащей плаценты устанавливали по данным ультразвукового исследования (УЗИ) на основании допплерографии и подтверждали при магнитно-резонансной томографии.
Результаты исследования и обсуждение
Все 30 пациенток, включенных в исследование, были в активном репродуктивном периоде от 26 до 42 лет, половина из них – моложе 35 лет. Обследованные женщины обеих групп не отличались по возрасту, числу беременностей в анамнезе, паритету, числу предыдущих кесаревых сечений, среднему сроку гестации на момент родов, средней массе тела новорожденных. Беременность у всех была одноплодной. При анализе соматической патологии не было выявлено высокой заболеваемости, частота болезней женской половой сферы соответствовала средним популяционным значениям. Средний возраст менархе составил 13,8±1,3 года. Особенностей менструальной функции не отмечено.
У всех обследованных в анамнезе была операция кесарева сечения, что подтверждает данные литературы о рубце на матке как основном факторе риска патологического прикрепления плаценты. Рубец после одной операции имел место у 18 (60%), после двух – у 7 (23,3%), после трех – у 3 (10%), после четырех – у 2 (6,7%) пациенток. В качестве показаний к первой операции лидирующие позиции занимали: тазовое предлежание плода – 5 (16,7%), слабость родовой деятельности – 5 (16,7%), клинически узкий таз – 4 (13,3%). Повторное кесарево сечение проводилось у 2 пациенток по поводу миопии высокой степени, у 10 – по поводу несостоятельности рубца на матке.
У пациенток с истинным врастанием плаценты помимо кесарева сечения нельзя исключить такой неблагоприятный фактор. как аборты в анамнезе – у 24 (80%) пациенток. Об аномальной нидации плодного яйца свидетельствовала длительная угроза прерывания беременности, которая наблюдалась у 18 (60%) обследованных. Диагноз предлежания плаценты амбулаторно был поставлен всем беременным. В стационаре, по данным УЗИ и допплерографии, врастание плаценты диагностировано у 24 из 30 пациенток. В зарубежных публикациях [5, 9, 10, 23] отражены основные эхографические признаки placenta accrete. В нашей работе наиболее частыми эхопризнаками были: 1) разной формы лакуны в ткани плаценты с турбулентным током крови при допплерографии – у 17 (70,8%); 2) расширение сосудов миометрия в зоне плацентации – у 5 (20,8%).
Менее чувствительным критерием является истончение или отсутствие миометрия над плацентой [10]. Однако в нашем исследовании этот признак, именуемый «маточной грыжей», имел место у 16 из 24 пациенток. У 6 (20%) беременных эхографических признаков врастания плаценты не отмечено. У них placenta accreta была выявлена интраоперационно, при вскрытии брюшной полости обнаружен выраженный сосудистый рисунок в области нижнего сегмента матки (рис. 1, см. на вклейке).
У 7 из 30 беременных для подтверждения патологической инвазии плаценты выполнена магнитно-резонансная томография. Аномальное выбухание передней стенки матки в нижнем сегменте обнаружено у 2, истончение миометрия в этой зоне имело место у 2, множественные извитые сосуды, выходящие за контур матки, выявлены у всех 7 обследованных.
Все пациентки родоразрешены путем кесарева сечения в различные сроки гестации. ( от 31 до 39 нед). В плановом порядке родоразрешены 20 (66,7%) пациенток, в экстренном – 10 (33,3%). Экстренная операция предпринята у 1 пациентки в связи с началом родовой деятельности в 37 нед беременности, у 9 – по поводу кровотечения. Объем кровопотери до родоразрешения у 4 обследованных был до 20 мл, у 5 – достигал 100–250 мл.
Крупных детей при рождении не было. Родились 29 живых детей в удовлетворительном состоянии, 1 ребенок – в состоянии асфиксии средней тяжести.
При гистологическом исследовании иссеченного миометрия передней стенки матки и плацент отмечено врастание ворсин в мышечную ткань.
У пациенток 1-ой группы гемостаз производился с использованием перевязки внутренних подвздошных артерий. Кесарево сечение на фоне общей анестезии с интубацией трахеи выполнено у 3 родильниц, у 7 – методом обезболивания была выбрана эпидуральная и у 3 – комбинированная спинально-эпидуральная анестезия. У 2 пациенток было сочетание эпидуральной и общей анестезии. У 12 обследованных проведено кесарево сечение в нижнем маточном сегменте поперечным разрезом, у 3 – корпоральное кесарево сечение. Трансплацентарно плод извлекался у 6 пациенток, что инициировало начало массивного кровотечения.
У беременных с истинным врастанием плаценты, не диагностированным до операции, после попытки отделения плаценты одномоментно происходила массивная кровопотеря, обусловленная врастанием плаценты и нарушением сократительной способности нижнего сегмента, где располагается плацентарная площадка. У 1 из 15 родильниц объем кровопотери был в пределах 2000 мл, у 10 – от 2001 до 5000 мл, а у 4 – превышал 5001 мл. Известно, что успех интенсивной терапии массивного кровотечения зависит от слаженной работы акушера-гинеколога, обеспечивающего хирургический этап лечения и анестезиолога-реаниматолога. У всех пациенток производилась катетеризация центральной вены, осуществлялся адекватный объем инфузионной терапии под контролем центрального венозного давления. Использовали свежезамороженную плазму 850–2400 мл, аутоплазму 300–1200 мл, донорскую эритромассу 203–790 мл, у 4 родильниц проводилась аппаратная реинфузия аутоэритровзвеси объемом 498–3027 мл (табл. 1).
Таблица 1. Кровопотеря и гемотрансфузия у пациенток 1-й группы.
Избежать удаления матки удалось, применив перевязку внутренних подвздошных артерий (ВПА), часто в комбинации с гемостатическими швами на матку (табл. 2).
Таблица 2. Органосохраняющие операции у пациенток 1-й группы.
После рождения ребенка у 14 (93,3%) родильниц производили поэтапное отделение плаценты с последующим наложением гемостатических швов на отслаивающийся участок миометрия. После зашивания матки у 5 (33,3%) накладывали компрессионный шов на нижний маточный сегмент, у 4 (26,7%) применяли «матрасные» швы на тело матки. Перевязка внутренних подвздошных артерий была произведена у всех 15 родильниц после осуществления локального гемостаза в области плацентарной площадки и зашивания матки. Продолжительность операции варьировалась от 1 ч 14 мин до 3 ч 05 мин.
Послеоперационный период осложнился пельвиоперитонитом у 1 пациентки, проводилась санационная лапароскопия, выписана на 18-е сут. У 1 пациентки выявлена подапоневротическая гематома, проводилась консервативная терапия, выписана на 20-е сут. У 1 родильницы сформировался абсцесс малого таза, на 8-е сут произведена пункция заднего свода влагалища с целью аспирации гноя, выписана на 20-е сут. У 12 (80%) пациенток послеоперационный период протекал без осложнений, они выписаны на 7–13-е сут.
Во 2-ю группу были включены 15 женщин, у которых извлечение плода осуществлялось через разрез в бессосудистой зоне в дне матки, не затрагивая плаценту. С целью гемостаза применяли эмболизацию маточных артерий. В данной группе кесарево сечение на фоне эпидуральной анестезии выполнено у 9 родильниц, у 6 – применена комбинированная спинально-эпидуральная анестезия. На операционном столе перед разрезом передней брюшной стенки катетеризировалась бедренная артерия, проводник установлен в маточных артериях. Чревосечение по Джоэл-Кохену произведено у 1 пациентки, нижнесрединная лапаротомия –у 4, срединная – у 10. Продольный разрез в дне матки для извлечения плода с целью избежать повреждения плаценты произведен у 13 женщин, корпоральный – у 1 и высокий поперечный разрез в теле матки – у 1. После извлечения ребенка плаценту не отделяли. Разрез матки ушивали двухрядным викриловым швом, затем проводили эмболизацию маточных артерий.
Как и в 1-й группе у всех пациенток катетеризировали центральную вену, под контролем центрального венозного давления проводили адекватную инфузионную терапию. У 6 женщин использовалась свежезамороженная плазма 850–2400 мл, у 2 – аутоплазма 600 мл. Аллогемотрансфузию не проводилиь ни одной из пациенток, 8 родильницам проводили аппаратную реинфузию аутоэритровзвеси объемом 243–4100 мл.
У 2 женщин была предпринята попытка «консервативного» лечения оставленной в матке placenta
accreta. Это потребовало повторной эмболизации маточных артерий на 23-е сут (1-я пациентка)
и 42-е сут (2-я пациентка). На 69-е сут (1-я пациентка) и 52-е сут (2-я пациентка) произошла частичная экспульсия плаценты. Остатки плацентарной ткани удалены рукой, проводилось
выскабливание матки. Кровопотеря составила 1000 мл (1-я пациентка) и 1500 мл (2-я пациентка). Оба случая с благоприятным исходом.
У остальных 13 родильниц после редуцирования кровотока в маточных артериях выполняли разрез в нижнем маточном сегменте с целью удаления плаценты, иссечения измененного миометрия и проведения метропластики (рис. 2, см. на вклейке).
Эмболизацию маточных артерий у всех 15 родильниц иногда сочетали с дополнительным хирургическим гемостазом (табл. 3).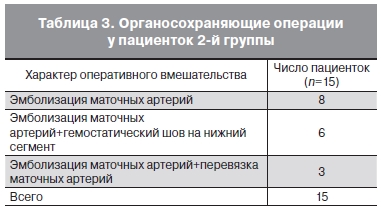
У большинства пациенток при использовании эмболизации маточных артерий объем кровопотери был меньше такового, чем при применении перевязки внутренних подвздошных артерий ( у 6 – менее 1000 мл, у 7 – 1000–2000 мл). Продолжительность операции варьировалась от 56 мин до 3 ч 35 мин.
Послеоперационный период осложнился тромбофлебитом притока v.s. magna у 1 пациентки, проводилось консервативное лечение, выписана на 11-е сут. Пациентки с оставленной плацентой и «консервативной» терапией выписаны на 14-е и 18-е сут; 12 (80%) пациенток, у которых послеоперационный период протекал без осложнений, выписали на 6–13-е сут.
Представленные нами данные свидетельствуют о возможности проведения органосохраняющих операций при истинном врастании плаценты. Родоразрешение таких пациенток должно осуществляться в акушерских стационарах III уровня при обязательном наличии достаточного количества свежезамороженной плазмы, эритроцитарной массы, интраоперационном применении аппаратной реинфузии аутоэритровзвеси. Разрез матки вне расположения плаценты с целью извлечения плода позволяет снизить объем кровопотери, однако переводит последующие беременности в разряд высокого риска. Наши наблюдения по оставлению плаценты in situ недостаточны для формирования окончательных выводов. Однако в экстренной ситуации у акушера есть возможность отсрочить удаление плаценты, дождавшись профессионалов и сосудистых хирургов. При наличии условий для эмболизации маточных артерий следует считать ее методом выбора, способствующим лучшему гемостазу.



