В структуре гинекологических заболеваний у девочек в периоде полового созревания расстройства менструаций занимают второе место, составляя 41% [1]. Нарушение функциональной активности яичников и надпочечников сказывается на защитных свойствах слизистой половых путей, поскольку эпителий влагалища и шейки матки является гормонозависимым [2]. Доказано, что у женщин с нарушениями ритма менструаций частота доброкачественных процессов шейки матки в 5–6 раз превышает таковую в популяции. У девственниц указанная взаимосвязь не изучалась.
У девочек-подростков 85–90% всех состояний шейки матки составляет эктопия. Однако характерная для этого возрастного периода метаплазия цилиндрического эпителия является благоприятным фактором для персистенции микроорганизмов, в том числе вирусов, инвазии которых трудно избежать с учетом стиля сексуального поведения современных подростков [3–5].
Рисковое поведение подростков обусловливает крайне высокую распространенность папилломавирусной инфекции в этой возрастной группе с кумулятивной частотой инфицирования 17% в течение первого года и 35,7% в течение последующих трех лет половой жизни, притом, что среди обнаруженных типов вируса папилломы человека (ВПЧ) преобладают высокоонкогенные. Частота цервикальной неоплазии II и III степени у девочек-подростков, имеющих аномальную цитологию, существенно не отличается от взрослых женщин [6–8]. В последние годы обозначился рост заболеваемости раком шейки матки у женщин в возрастной группе до 29 лет, в которой прирост этого показателя составил 150%.
В настоящее время недостаточно изучены молекулярно-биологические механизмы, контролирующие процессы пролиферации, апоптоза и ангиогенеза в эпителии шейки матки в периоде полового созревания, роль динамического изменения уровня стероидных гормонов в регуляции этих процессов, а также зависимость состояния эпителия шейки матки от типа нарушений менструаций и наличия инфекционных факторов [9–12]. Крайне интересным у девочек, не имевших опыта половой жизни, представляется исследование соотношения интенсивности процессов пролиферации и гибели клеток, нарушение которого может приводить к неопластической трансформации эпителия шейки матки.
Литературные данные о влиянии гормональных препаратов на состояние шейки матки при эктопии у женщин репродуктивного возраста и сексуально активных девочек-подростков весьма противоречивы [13, 14]. В то же время, у сексуально неактивных девочек-подростков при отсутствии инфекционного компонента, как дополнительного фактора риска развития патологических изменений цервикального эпителия, эта проблема вообще не изучалась.
Целью настоящего исследования явилась оценка кольпоскопических, цитологических и иммуноцитохимических особенностей эпителия шейки матки у девочек-подростков, не имевших сексуальных контактов, с первичным дефицитом эстрогенов, принимавших с лечебной целью препарат, содержащий 17-β-эстрадиол и дидрогестерон, в постоянно-последовательном режиме.
Материал и методы исследования
В соответствии с целью исследования нами было проведено обследование 24 девочек-подростков, проходивших лечение во 2-м гинекологическом отделении (детского и юношеского возраста) ФГБУ НЦАгиП им. В.И. Кулакова Минздрава России, у которых выявлен первичный дефицит эстрогенов.
Критериями включения в исследование явились: возраст 15–18 лет, наличие первичного дефицита эстрогенов, отсутствие опыта сексуальных контактов, информированное добровольное согласие пациентки на проведение комплексного обследования. Критериями исключения явились: наличие вульвовагинита, инфицирование ВПЧ, наличие пороков развития внутренних половых органов, отказ от полного обследования со стороны пациентки.
В контрольную группу были включены 24 соматически здоровые девочки с правильным ритмом менструаций с менархе, не имевшие опыта сексуальных контактов и обратившиеся в научно-поликлиническое отделение Центра для консультации по поводу вакцинации против ВПЧ.
Всем 24 пациенткам основной группы была назначена развивающая и поддерживающая гормональная терапия (РПГТ) – двухфазные эстроген-гестагенные препараты, содержащие 17β-эстрадиол и дидрогестерон, в постоянно-последовательном режиме. Обследование проводили перед назначением РПГТ и в динамике через 9 месяцев в процессе их использования.
Состояние шейки матки оценивалось по результатам расширенной кольпоскопии (РКС), цитологического и иммуноцитохимического исследований мазков-отпечатков с экзо- и эндоцервикса. Прицельно проанализирована экспрессия α рецепторов к эстрогенам (α-ER), А- и В-рецепторов к прогестерону (PR), эпидермального фактора роста (EGF), Ki-67, фактора некроза опухоли (TNF) – α и Cas.
Исследование было одобрено этическим комитетом, все пациентки подписали добровольное информированное согласие на участие в исследовании.
Полученные количественные данные обрабатывались методом вариационной статистики. Для сравнения параметрических данных использовался метод ANOVA для нескольких групп, затем осуществлялось попарное сравнение с помощью t-критерия Стъюдента для двух независимых выборок. Для оценки достоверности различий непараметрических данных применялись методы Крускала–Уоллиса и медианный тест (для нескольких групп), попарное сравнение осуществляли с помощью критерия Манна–Уитни (для двух несвязанных совокупностей). Для выявления различий между качественными показателями использовали метод χ2 (с поправкой Йетса на непрерывность и критерий χ2-Пирсона максимального правдоподобия), а также точный критерий Фишера для небольших выборок. Статистически значимыми считались отличия при р<0,05 (95% уровень значимости) и при р<0,01 (99% уровень значимости). Связь между изучаемыми показателями оценивалась по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (r) или Спирмена (R) с последующим установлением его значимости по критерию t с 95% уровнем надежности (р<0,05).
Результаты и обсуждение
При оценке результатов расширенной кольпоскопии выявлено наличие нормальной кольпоскопической картины у 15 из 24 (62,0%) девушек с первичным дефицитом эстрогенов, в том числе: эктопия шейки матки у 8 (34,0%) пациенток, эктопия с нормальной зоной трансформации (НЗТ) у 6 (23%) девочек и многослойный плоский эпителий (МПЭ) у 1 (5%) пациентки.
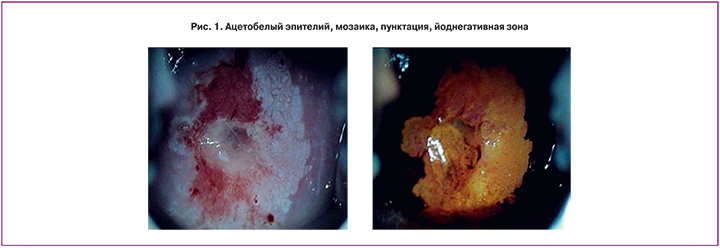
В контрольной группе эктопия выявлена у 18 (75%) соматически здоровых девственниц с регулярным ритмом менструаций с менархе. Интересной находкой было обнаружение аномальной кольпоскопической картины в виде зоны трансформации в сочетании с нежным ацетобелым эпителием, мозаикой, пунктацией, йоднегативными участками у 1 (4,1%) пациентки из группы контроля (рис. 1).
При цитологическом исследовании мазков-отпечатков с наружной поверхности шейки матки и цервикального канала у 23 девочек контрольной группы выявлена нормальная цитологическая картина: поверхностные и промежуточные клетки плоского эпителия, клетки цилиндрического эпителия, клетки метапластического эпителия.
У описанной выше пациентки контрольной группы с атипической зоной трансформации (АЗТ) в мазке-отпечатке с наружной поверхности шейки матки и цервикального канала часть клеточных элементов плоского эпителия были с дистрофическими изменениями, присутствовали ороговевшие безъядерные и единичные двуядерные клетки, в том числе выявлялись клетки с псевдодискариозом на фоне комплексов клеток плоскоклеточной метаплазии.
Следует отметить, что кольпоскопическая картина у девочек-подростков 15–18 лет не отличается от таковой у женщин репродуктивного возраста.
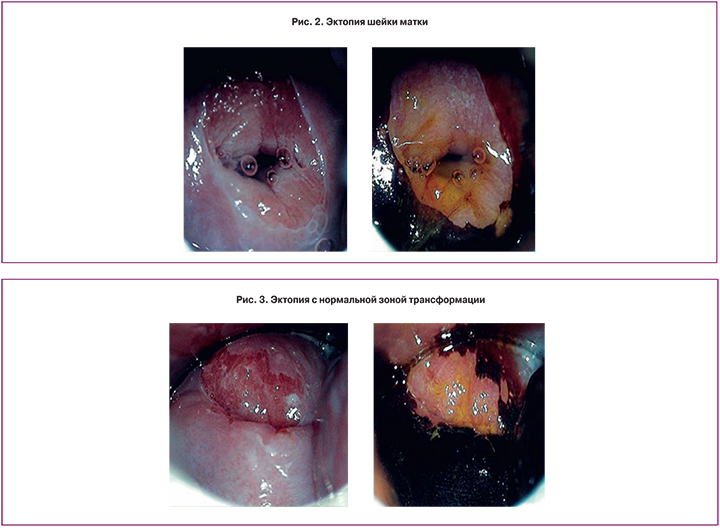
При кольпоскопическом исследовании эктопия шейки матки характеризовалась наличием участков цилиндрического эпителия вокруг наружного зева в виде гроздьевидных образований различных размеров и формы, создающих неровную сосочковую поверхность красного цвета, белеющих после обработки раствором уксусной кислоты и практически не окрашивающихся раствором Люголя (в связи с отсутствием гликогена в клетках цилиндрического эпителия) (рис. 2).
НЗТ характеризовалась наличием метапластического эпителия различной степени зрелости, открытых и закрытых желез, островками цилиндрического эпителия с нечеткими контурами (рис. 3). Кольпоскопическая картина при наличии НЗТ зависела от степени замещения цилиндрического эпителия МПЭ. При тонком (незрелом) слое МПЭ поверхность имела красный цвет за счет просвечивания полнокровной подлежащей ткани. При восстановлении всех рядов МПЭ поверхность выглядела бледно-розовой. Открытые железы имели вид темных отверстий небольшой величины, часто с нежным светлым ободком МПЭ вокруг, более четко выявлявшиеся при обработке раствором уксусной кислоты. Закрытые железы определялись, как полусферически выступающие над окружающей тканью образования белесовато-желтоватого цвета с усиленным равномерным сосудистым рисунком на их поверхности, с радиально расположенными сосудами, идущими от периферии к центру, сокращающиеся под действием уксусной кислоты.
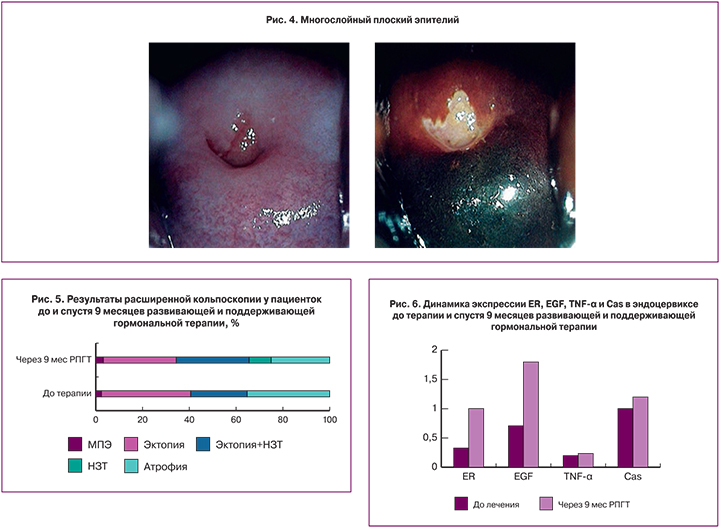
Шейка матки, покрытая МПЭ, имела гладкую, блестящую поверхность светло-розового цвета, с нежным сосудистым рисунком подлежащей стромы с удлиненными ветвями древовидных сосудов. При обработке раствором уксусной кислоты отмечалось кратковременное равномерное побледнение, под воздействием раствора Люголя слизистая равномерно окрашивалась в темно-коричневый цвет (рис. 4).
У 9 (38%) пациенток основной группы описанные выше картины дополнялись явлениями атрофии эпителиального покрова в виде его истончения, легкой травмируемости, бледной окраски, наличием субэпителиальных петехиальных кровоизлияний. При пробе Шиллера экзоцервикс и слизистая влагалища неравномерно окрашивались в бледно-желтый цвет с характерной крапчатостью, возникающей в результате десквамации и слущивания отдельных участков дистрофически измененного эпителия. Атрофия покровного эпителия выявлялась лишь у девочек с первичным дефицитом эстрогенов, явившись чрезвычайно чувствительным критерием хронического дефицита эстрогенных влияний, даже при уровнях сывороточного эстрадиола, близких к нижней границе нормативных показателей. Атипическая кольпоскопическая картина не выявлена ни в одном случае.
В группе девочек, получающих РПГТ, обследование проводили перед назначением РПГТ и в динамике через 9 месяцев в процессе ее использования. Всем пациенткам была проведена расширенная кольпоскопия, цитологическое исследование мазков-отпечатков шейки матки до начала исследования и спустя 9 месяцев после начала приема гормональных препаратов. При цитологическом исследовании критерием физиологической трансформации эктопии считали появление метаплазированного эпителия.
По данным расширенной кольпоскопии к 9-му месяцу приема РПГТ у 16 (66,7%) из 24 пациенток не было выявлено каких-либо патологических изменений или отрицательной динамики по сравнению с исходными данными. Лишь у 8 (33,3%) из 13 девочек с исходно диагностированной атрофией сохранялись указанные явления, в то время как у 5 пациенток спустя 9 месяцев РПГТ отмечался неизмененный покровный эпителий. При анализе кольпоскопической картины выявлено, что у 7 (29,2%) девочек с исходно диагностированной эктопией шейки матки, в том числе у трех – в сочетании с начавшейся трансформацией цилиндрического эпителия, за указанный срок РПГТ отмечалось смещение цилиндрического эпителия к области наружного зева с формированием НЗТ. АЗТ не обнаруживалась ни в одном случае, как до начала терапии, так и спустя 9 месяцев РПГТ. Таким образом, по данным расширенной кольпоскопии, при РПГТ усиливаются процессы эпителизации при эктопии шейки матки (рис. 5).
Оценка микробиоценоза влагалища на фоне РПГТ показала положительную динамику состояния микрофлоры, выражавшуюся в статистически значимом уменьшении частоты выявления бактериального вагиноза (с 54,2 до 20,8%) и повышения числа случаев выделения лактобактерий в монокультуре (с 16,7 до 45,8%) (p<0,05). Отмеченная положительная динамика показателей микроэкосистемы влагалища свидетельствует о восстановлении физиологической многослойности плоского эпителия с накоплением гликогена в поверхностных клетках под влиянием экзогенно вводимых в организм половых гормонов с нормализацией рН вагинального содержимого и о создании благоприятных условий для жизнедеятельности лактобацилл.
При исходном цитологическом исследовании мазков-отпечатков с наружной поверхности шейки матки и цервикального канала нормальная цитологическая картина была выявлена лишь у 5 (20,8%) пациенток основной группы (I класс по классификации Папаниколау), в то время как у 13 (54,2%) девочек обнаружены атрофические изменения эпителия (парабазальные и базальные клетки МПЭ), а у 6 (25,0%) – дистрофически измененные клетки, в том числе псевдодискариоз, двуядерные клетки, голые ядра, дискератоциты (II класс по классификации Папаниколау).
Спустя 9 месяцев РПГТ у 16 из 24 пациенток (66,7%) обследуемой группы определялась нормальная цитологическая картина, из них – у 3 (12,5%) из 6 девочек с исходно выявленными дистрофическими изменениями эпителия и у 8 из 13 пациенток (20,8%) с исходной картиной атрофических изменений в мазках. Активация процесса плоскоклеточной метаплазии отмечена у 10 (50%) пациенток с эктопией шейки матки, в том числе в сочетании с НЗТ, которая проявлялась в некотором повышении количества поверхностных и промежуточных клеток плоского эпителия и появлении элементов плоскоклеточной метаплазии. Из них у 7 пациенток цитологическая картина эпителизации подтверждалась обнаружением смещения переходной зоны у пациенток с исходно диагностированной эктопией в сторону наружного зева. Атипически измененные клетки не были обнаружены ни в одном случае.
При анализе результатов иммуноцитохимического исследования мазков-отпечатков шейки матки отмечено повышение экспрессии ER и EGF в эпителиальных клетках на фоне терапии по сравнению с исходными данными в 3 и 2,6 раза соответственно (р<0,05) при сохранении практически неизмененной активности проапоптотических факторов (TNF-α и Cas) (рис. 6).
Полученные данные свидетельствуют о выраженной физиологической активации созревания цервикального и вагинального эпителия в процессе применения гормональных препаратов для РПГТ у девочек-подростков с первичным дефицитом эстрогенов, что подтвердили данные как расширенной кольпоскопии и цитологического исследования, так и иммуногистохимического исследования цервикальных мазков-отпечатков.
Заключение
Системная развивающая и поддерживающая терапия препаратами половых стероидных гормонов у пациенток с первичным дефицитом эстрогенов способствует нормальной трансформации цервикального эпителия благодаря сбалансированной активации процессов пролиферации и апоптоза (параллельное повышение экспрессии EGF и Cas), устранению явлений атрофии и восстановлению зрелости вагинального эпителия у девочек.
Приведенные данные, по нашему мнению, отражают необходимость оптимизации профилактических мероприятий, направленных на предотвращение развития цервикальных интраэпителиальных поражений у девочек-подростков.



