Рак шейки матки (РШМ) до сегодняшнего дня остается одной из самых актуальных проблем в онкогинекологии. Он занимает третье место среди злокачественных новообразований у женщин в мире, первое по частоте среди женщин 15–39 лет и является самой частой причиной смерти от онкологических заболеваний в развивающихся странах [1].
Факт увеличения числа заболевших женщин с тенденцией к омоложению болезни является весьма тревожным, так как этот контингент пациенток представляет собой не только репродуктивно значимую часть населения, но и группу, активную в социальном отношении [2]. Так, за последние годы зарегистрировано увеличение почти вдвое числа заболевших женщин в возрасте от 20 до 40 лет (41,21%). Особенно заметный рост наблюдается в группе моложе 29 лет, где прирост этого показателя за прошедшее десятилетие составил 150% [3].
Важная роль в канцерогенезе РШМ отводится вирусу папилломы человека высокого канцерогенного риска (ВПЧ ВКР) [4]. Папилломавирусная инфекция (ПВИ) является одной из наиболее распространенных инфекций, передающихся половым путем; инфицированность ею сексуально активного населения планеты составляет 20–60% [5].
Принято считать, что ПВИ является ранним показателем предракового состояния [6], а у 15–20% вызывает ВПЧ-индуцированный рак генитальной сферы [7–9].
Развитию инвазивного РШМ предшествуют внутриэпителиальные клеточные атипические изменения, обозначаемые как цервикальные интраэпителиальные неоплазии (ЦИН) разной степени выраженности и карцинома in situ – состояния, при которых в части клеток обнаруживаются признаки клеточного и ядерного атипизма и нарушения анизотропности эпителиального пласта без разрушения базальной мембраны и проникновения атипических клеток в подлежащие ткани. Считается, что ЦИН представляют собой прединвазивный аналог инвазивного плоскоклеточного рака [10].
Известно, что больные с дисплазией многослойного плоского эпителия относятся к группе высокого риска развития инвазивной карциномы, тем не менее, процесс злокачественной трансформации происходит в течение достаточно длительного времени, что дает возможность проведения соответствующих лечебных мероприятий, препятствующих развитию рака [11].
В настоящее время не существует ни одного метода прогнозирования течения ЦИН у конкретной больной, определяющего возможность стойкой персистенции или прогрессии в более высокую степень, либо в инвазивный РШМ с указанием точного времени длительности этого процесса [12].
Очевидно, что недостаточность скринингового контроля, ограниченные возможности традиционных методов обследования значительно затрудняют своевременное выявление преинвазивных патологических цервикальных состояний. Особую трудность представляет диагностика латентной и субклинической форм ВПЧ-инфекции, которые часто сосуществуют с клинически манифестированными состояниями цервикального эпителия, предрасполагая к рецидивам после удаления видимого очага опухоли, связанным с персистенцией вируса в сопредельных тканях.
Известно, что даже конизация шейки матки не всегда дает полный лечебный эффект, так как в оставшемся многослойном плоском эпителии могут сохраняться нерезецированные очаги неоплазии в 5–28% случаев [13–17].
Вышеизложенное диктует необходимость поиска новых методов диагностики и терапии цервикальной патологии, нацеленных на снижение хронических (персистентных) ПВИ, которые служат предшественниками инвазивных раковых опухолей [18].
Решение этих задач стало возможно вследствие применения в клинической онкогинекологии новейших методов визуализации биотканей и усовершенствования лечения цервикальной патологии, основанных на достижениях химии, биологии и квантовой физики.
В собственном исследовании особенностью диагностического процесса стало включение в него оптической когерентной томографии (ОКТ) в новой, скоростной модификации. Комплекс лечебных мероприятий дополнялся использованием фотодинамической терапии (ФДТ).
Цель исследования: повысить эффективность органосохраняющего лечения ЦИН у женщин репродуктивного возраста путем включения в диагностический процесс ОКТ в скоростной модификации и использования ФДТ при наличии в крае резекции после электроконизации шейки матки признаков ВПЧ-инфекции.
Материал и методы
В исследование вошли 32 пациентки с H-SIL (ЦИН II-III) в возрасте от 19 до 38 лет. Всем больным проводили комплексное обследование: оценка биоты нижнего отдела гениталий (качественный ПЦР-анализ на абсолютные патогены, «Фемофлор», мазок на флору влагалища), ВПЧ-тестирование, типирование, определение вирусной нагрузки – ПЦР в реальном времени. Дальнейшие диагностические мероприятия, проводившиеся после восстановления биоценоза влагалища с назначением по показаниям этиотропной терапии, включали жидкостное цитологическое исследование и иммуноцитохимическое обследование на наличие белка p16ink4a и/или биопсию шейки матки, ОКТ-кольпоскопию (кольпоскопия с проведением традиционных тестов + ОКТ в скоростной модификации).
ОКТ в скоростной модификации – метод прижизненной визуализиции биотканей в результате зондирования их низкоинтенсивным светом ближнего инфракрасного диапазона, позволяющий в отличие от классической ОКТ охарактеризовать не только структурные, но и функциональные особенности ткани.
Основной диагностической задачей было определение истинных размеров патологического очага, который характеризовался совокупностью аномальных кольпоскопических и ОКТ-признаков.
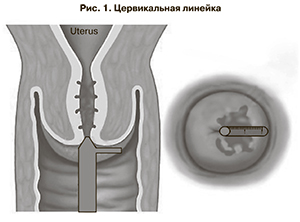
После расширенного кольпоскопического исследования с применением стандартной пробы с уксусной кислотой проводилось скоростное ОКТ-сканирование зон максимальных кольпоскопических изменений. Для этого зонд от оптического томографа прижимался к зонам интереса на 12 секунд с целью обнаружения внутри них участков, имеющих большие степени негативных оптических характеристик. Далее осуществлялось пошаговое скоростное ОКТ-сканирование этих участков по лучу, следующему от цервикального канала до сводов влагалища. Отдаленность поражений от цервикального канала фиксировалась в миллиметрах с помощью специальной цервикальной линейки, разработанной на базе кафедры акушерства и гинекологии Нижегородской государственной медицинской академии (рис. 1). Граница перехода сомнительных и злокачественных ОКТ-изображений в доброкачественные, выявленная с помощью линейки, обозначалась как планируемый экзоцервикальный край резекции. В кольпоскопическом протоколе, помимо общепринятых данных, отмечались луч ОКТ-зондирования соответственно часам мнимого циферблата, планируемый экзоцервикальный край резекции по этому лучу в миллиметрах и наличие признаков ПВИ за пределами планируемого края резекции. К признакам ПВИ по данным ОКТ относятся: увеличение глубины проникновения оптического сигнала, субэпителиальный отек и полнокровие, наличие многокамерных, сообщающихся «окон» – полостей в базальных слоях многослойного плоского неороговевающего цервикального эпителия. Данные ОКТ-проявления на фоне доброкачественного изображения расценивались как резервуар ПВИ (рис. 2 см на вклейке).
 Первым этапом лечения всех пациенток стало выполнение им электроконизации шейки матки – эксцизии электродом-парусом с последующим выскабливанием цервикального канала и гистологической оценкой эктоцервикального края резекции. Эктоцервикальный край тщательно исследовался путем микроскопического исследования серийных или ступенчатых срезов с изучением маркированного нитью луча, наиболее подозрительного по данным ОКТ-кольпоскопии на наличие ВПЧ-ассоциированных эпителиальных поражений.
Первым этапом лечения всех пациенток стало выполнение им электроконизации шейки матки – эксцизии электродом-парусом с последующим выскабливанием цервикального канала и гистологической оценкой эктоцервикального края резекции. Эктоцервикальный край тщательно исследовался путем микроскопического исследования серийных или ступенчатых срезов с изучением маркированного нитью луча, наиболее подозрительного по данным ОКТ-кольпоскопии на наличие ВПЧ-ассоциированных эпителиальных поражений.
Больным с положительным по наличию признаков ВПЧ-инфекции по данным морфологии краем резекции проводилась ФДТ.
ФДТ – двухкомпонентный метод лечения опухолевых заболеваний, основанный на эффекте взаимодействия фотосенсибилизатора и света строго определенной длины волны. В результате реализации фотодинамической реакции происходит геморрагический некроз опухолевой ткани и ее замещение соединительнотканными структурами. Фотохимическая реакция включает прямую гибель клеток за счет синглетного кислорода, повреждение сосудистого русла опухолевой ткани, иммунный ответ [19–21].
Лазерное воздействие на шейку матки осуществлялось в первую фазу менструального цикла (при исключенной беременности) через 1,5–2 ч после введения фотосенсибилизатора хлоринового ряда в дозе 1 мг/кг. Препарат вводился внутривенно в 200 мл физиологического раствора в течение 30 мин. Использовалась полипозиционная методика лазерного воздействия (ФДТ выполнялась как на всем протяжении цервикального канала, так и на всей площади влагалищной порции шейки матки).
Плотность энергии лазерного излучения составляла 100–200 Дж/см2, плотность мощности – 250–400 мВт/см2.
Результаты исследования и обсуждение
Все пациентки имели нарушение нормальной микрофлоры влагалища, 20 из них были инфицированы ВПЧ ВКР.
Первым этапом лечения всех пациенток стало выполнение им электроконизации шейки матки – эксцизия электродом-парусом с последующим выскабливанием цервикального канала.
По получении результатов гистологического исследования операционного материала пациентки были разделены на 2 группы. В первую группу вошли 17 женщин с отсутствием в краях резекции каких-либо эпителиальных изменений, характерных для ВПЧ-инфицирования, из них с диагнозом ЦИН II – 3 больные, ЦИН III – 10, с-r in situ – 4 пациентки. Лечение этих пациенток ограничивалось эксцизией шейки матки электродом-парусом и выскабливанием цервикального канала, то есть было одноэтапным.
При осмотре данных пациенток через 6 и 12 месяцев после электроконизации цитологических и ОКТ-кольпоскопических данных за рецидив выявлено не было.
Вторую группу составили 15 пациенток с положительным по наличию ВПЧ-ассоциированных эпителиальных изменений краем резекции, из них у 7 определялись гистологические признаки ВПЧ-ассоциированных изменений многослойного плоского эпителия в виде папилломатозной гиперплазии, акантоза, дискератоза, нарушения стратификации многослойного плоского эпителия, наличия койлоцитов; у 5 выявлены ЦИН I, у 2 – ЦИН II.
Важно заметить, что морфологические заключения в 80% случаев у второй группы (12 пациенток) были прогнозируемы по данным скоростной ОКТ.
В 100% случаев обнаружения в крае резекции «ЦИН III минус» сомнительные и доброкачественные ОКТ-характеристики позволяли исключить инвазивный процесс, что было определяющим в одном клиническом случае, когда лечебная тактика была выбрана, основываясь на ОКТ.
Данной пациентке на первом этапе была выполнена технически максимальная эксцизия электродом-парусом, несмотря на невозможность определения планируемого экзоцервикального края резекции из-за обширности поражения. Инвазия отсутствовала по данным скоростной ОКТ. В крае резекции была гистологически верифицирована ЦИН III, что было прогнозируемо.
Всем пациенткам второй группы с целью воздействия на клинические и субклинические формы ПВИ, а в последнем клиническом случае – с целью воздействия на нерезецированные очаги ЦИН вторым этапом выполнялась ФДТ. Выбор этого метода лечения у контингента больных фертильного возраста обусловлен максимально возможным сохранением архитектоники шейки матки, что является несомненным преимуществом перед проведением повторных эксцизионных процедур.
Реакция патологических очагов цервикального эпителия на ФДТ регистрировалась уже к концу сеанса лечения в виде отека и субэпителиальных кровоизлияний. На протяжении первой недели происходило нарастание некротических изменений в зоне светового воздействия. Максимальная глубина и выраженность некроза, а также образование плотных фибриновых пленок, частично закрывающих просвет шеечного канала, обычно наблюдались к концу 2-й недели после ФДТ. Постепенное очищение слизистой оболочки шейки матки от некротических тканей с четко визуализируемой границей между зоной эпителизации после ФДТ и плоскоэпителиальным покровом вне зоны светового воздействия завершилось к 3–4-й неделе после лечения.
Последующий мониторинг осуществляли путем проведения ОКТ-кольпоскопического, цитологического, вирусологического исследований после полного заживления шейки матки, затем каждые 4 месяца. Сроки наблюдения составили 13 месяцев.
Полная или частичная регрессия ВПЧ-ассоциированных эпителиальных изменений достигнута у всех больных, причем с течением времени установлена тенденция их изменений на менее выраженную степень. Так, у пациентки с наличием в крае резекции ЦИН III в динамике наблюдения к 12-му месяцу после двухэтапного лечения по данным гистологического обследования биоптата не было данных за ЦИН.
Следует обратить внимание на высокие показатели противовирусного эффекта ФДТ – по данным неоднократных исследований методом ПЦР полная эрадикация ВПЧ достигнута у 12 женщин из второй группы.
Механизм противовирусного действия, вероятно, объясняется селективным накоплением фотосенсибилизатора в клетках, инфицированных ВПЧ, с последующим их разрушением до базальных и парабазальных клеточных слоев вследствие прямого фототоксического и деструктивного лазерного воздействия.
Заключение
Таким образом, проведенные исследования показывают, что ОКТ в новой скоростной модификации делает возможным уточнение кольпоскопических картин, а использование цервикальной линейки оптимизирует планирование зоны резекции. Это позволяет при наличии обширных аномальных кольпоскопических картин, но отсутствии злокачественных ОКТ-данных в значительно отдаленных от наружного зева зонах экзоцервикса, для сохранения архитектоники шейки матки выполнить максимально щадящее эксцизионное вмешательство.
В наших исследованиях также установлена эффективность использования ФДТ у пациенток при наличии положительных ВПЧ-ассоциированных эпителиальных изменений в крае резекции после органосохраняющих операций, что возможно объяснить его выраженным противовирусным эффектом, который связан с точечным воздействием на мультифокальные очаги вирусного поражения при клинической, субклинической и латентной формах ПВИ.
Этот метод обладает несомненным преимуществом перед проведением повторных эксцизионных процедур и является практически единственной возможностью предупреждения рецидивов цервикальной эпителиальной патологии при технически невозможной повторной конизации шейки матки.
Очевидно, что ФДТ у женщин репродуктивного возраста после эксцизии шейки матки снижает (а, возможно, и исключает) вероятность рецидивов интраэпителиальных неоплазий, а в итоге предупреждает развитие РШМ.



