В настоящее время регистрируется повышение числа случаев заболеваний шейки матки, ассоциированных c длительной персистенцией вируса папилломы человека (ВПЧ) у женщин репродуктивного возраста [1]. По статистике Всемирной организации здравоохранения (ВОЗ), ежегодно диагностируется более 490 тысяч новых случаев ВПЧ-ассоциированного рака шейки матки (РШМ). Как правило, онкологическому процессу предшествуют цервикальные интраэпителиальные неоплазии различной степени тяжести. Зачастую при плоскоклеточном интраэпителиальном поражении легкой степени (LSIL) процесс спонтанно регрессирует в течение нескольких месяцев. Однако длительная персистенция ВПЧ высокого риска приводит в 27% случаев к тяжелым плоскоклеточным интраэпителиальным поражениям (HSIL), которые в 40–45% случаев прогрессируют в РШМ [2, 3]. Трансформация эпителия шейки матки от отсутствия внутриклеточного поражения или злокачественности (NILM) к HSIL при папилломавирусной инфекции занимает от 1 до 10 лет. На молекулярном уровне происходят изменение дифференцировки клеток, дисбаланс механизмов пролиферации и апоптоза клеток.
В разных странах применяются различные схемы диагностики HSIL и РШМ, включающие морфологическое исследование биопсийного материала (золотой стандарт), цитологическое исследование соскоба клеток эпителия, расширенную кольпоскопию, жидкостную цитологию, ВПЧ-типирование с определением вирусной нагрузки и другие методы. Наиболее распространенным методом диагностики характера патологически измененного эпителия шейки матки является проведение кольпоскопического исследования с последующим взятием биоптата [4]. Однако при гистологическом исследовании оценивается структура ткани, что не позволяет оценить риск прогрессирования патологического процесса. Выбор тактики ведения пациента, в том числе объема инвазивных вмешательств, является ключевом моментом для пациенток репродуктивного возраста с цервикальной интраэпителиальной неоплазией. Динамическое наблюдение является преимущественной тактикой для пациентов с LSIL, однако в ряде случаев необходимо проведение терапии, в частности, при наличии высокого риска прогрессирования заболевания. В связи с этим диагностика заболеваний, ассоциированных с ВПЧ на ранних этапах развития, является важной своевременной помощью пациентам, находящимся в группе риска.
Применение современных методов исследования для анализа молекулярного состава различных биологических жидкостей является перспективным для диагностики ВПЧ-ассоциированных заболеваний шейки матки. Все чаще в подобных исследованиях для поиска биомаркерных молекул применяются постгеномные методы, в частности, протеомные, позволяющие определить особенности белкового состава плазмы крови, мочи, цервиковагинальной жидкости (ЦВЖ), ликвора и других [5–7].
Идентификация потенциальных маркерных белков в ЦВЖ при различных патологических состояниях (бактериальный вагиноз, вагиниты, цервициты, преждевременный разрыв плодных оболочек) позволяет проводить раннюю неинвазивную диагностику и мониторинг гинекологических и акушерских патологий [8–10]. По изменению протеома ЦВЖ можно судить о патогенезе заболевания, уточнить причину и стадии развития.
Целью данного исследования является выявление динамических изменений протеомной композиции ЦВЖ для валидации ранее созданного неинвазивного дифференциального подхода к диагностике ВПЧ-ассоциированных заболеваний шейки матки у пациенток репродуктивного возраста с «малыми» поражениями эпителия шейки матки.
Материалы и методы
Дизайн исследования
Определение особенностей белкового состава ЦВЖ пациенток с ВПЧ-ассоциированными «малыми» поражениями эпителия шейки матки (атипические клетки плоского эпителия неопределенного происхождения (ASCUS) и LSIL) проводилось на основе комплексной оценки динамики патологического процесса. В исследование были включены образцы 7 пациенток репродуктивного возраста (средний возраст 31 год), обратившихся в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, взятые трехкратно при динамическом наблюдении в течение года. Критериями исключения являлись беременность/период лактации, гормональная заместительная терапия, воспалительные заболевания в стадии обострения, нарушение функции почек, печени, легких в стадии декомпенсации и психоневрологические заболевания. Всем пациенткам при первичном обращении, через 6 и 13 месяцев проводилась расширенная кольпоскопия с взятием материала для цитологического, молекулярно-генетического (генотипирование ВПЧ 21 тип) и протеомного исследования. Исследование было одобрено Этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава РФ, все пациентки подписали информированное согласие.
Пробоподготовка и протеомный анализ образцов ЦВЖ
Для получения образца ЦВЖ проводилось орошение влагалища и шейки матки физиологическим раствором до каких-либо манипуляций с целью минимизации риска контаминации образца кровью. Затем проводилось центрифугирование для удаления клеток эпителия и заморозка надосадочной жидкости с хранением при -80˚С. После быстрого размораживания проводили восстановление белков 100 мМ дитиотреитолом с последующим алкилированием 50 мМ йодацетамидом, осаждением белковой смеси ледяным ацетоном с 0,1% трифторуксусной кислотой и трипсинолизом в соответствии с ранее разработанным протоколом [7, 11].
Триптические пептиды были разделены методом обращенно-фазовой высокоэффективной жидкостной хроматографии (Agilent 1100, USA) с идентификацией методом тандемной масс-спектрометрии (ВЭЖХ-МС) (7-Tesla LTQ-FT Ultra mass spectrometer, Thermo Electron, Germany) с электроспрейным источником ионов в DDA моде [7, 11]. Анализ каждого образца выполнен в трех последовательных повторах.
Биоинформатический и статистический анализ
Обработка масс-спектрометрических данных проводилась в программном пакете MaxQuant (версия 1.5) [12] с идентификацией пептидов и соответствующих им белков по базе данных SwissProt со следующими параметрами: минимальная длина аминокислотной последовательности – 7 а.к.о., FDR<0,01, минимальное количество триптических пептидов на белок – 2, минимум один – уникальный [11].
Полученные в программе MaxQuant полуколичественные данные далее были обработаны в программе Perseus (1.5.5.3). После загрузки матрицы из анализа исключались белки, идентифицированные только с наличием посттрансляционной модификации (Only identified by site), и белки, идентифицированные только по обратной базе Gene Ontology (Reverse). Для выявления статистически значимо изменяющихся белков относительно контрольной группы проводился ANOVA-тест (p>0,01) и t-тест Уэлча (Welch’s t-test). Анализ сверхпредставленности биологических процессов по базе GeneOntology (GO) осуществлялся с помощью ресурса STRING [13]. Экспериментальные данные доступны на ресурсе ProteomeXchange по идентификатору PXD011472.
Результаты и обсуждение
В данной работе проводился анализ изменения протеомной композиции 24 образцов ЦВЖ, полученных от 4 пациенток с ASCUS и 3 пациенток с LSIL в ходе динамического наблюдения. Образцы собирались каждые 6 месяцев после первого обращения (всего три точки на человека). У 90% пациенток с ASCUS был обнаружен ВПЧ высокого онкогенного риска. В группе с LSIL у всех пациенток был ВПЧ высокого риска. В ходе наблюдения во всех случаях вирус ВПЧ элиминировался, а цитологический анализ не ухудшился.
В результате протеомного анализа было детектировано более 400 различных белков. В результате проведенного статистического анализа было выявлено значимое изменение уровня 44 белков ЦВЖ. Всего через 6 месяцев изменился уровень 17 различных белков, в том числе ANXA2, CSTA и SERPINB13, предложенных в качестве потенциальных маркеров неопластической трансформации в предыдущем исследовании [7]. CSTA является важным белком слизистой, обладающим выраженными иммуномодуляторными свойствами, ингибируя цистеиновые протеазы, которые блокируют действие эндогенных и бактериальных протеаз [14]. CSTA также принимает участие в десмосомально опосредованной клеточной адгезии на нижних уровнях эпидермиса [15]. Обнаружено снижение уровня SERPINB13, принадлежащего к семейству ингибиторов сериновых протеаз. Повышенный уровень SERPINB13 был ранее отмечен при воспалительных и неопластических заболеваниях кожи, включая плоскоклеточную карциному [16].

Уровень белков SOD1, CSTA, FGB, ENO1, BPI, BPIFB1, SERPINB13 значимо изменился в ходе всего динамического наблюдения (рис. 1). Анализ обогащения функциональных групп по базе GeneOntology (GO) выявил, что наиболее значимым является участие данных белков в процессах антимикробного гуморального ответа, отрицательной регуляции клеточного процесса, ответа на внешний стимул, антибактериального гуморального ответа, отрицательной регуляции апоптотического процесса, полиорганных процессах, ответа на экзогенный организм, отрицательной регуляции апоптотического процесса эпителиальных клеток и регуляции апоптотического сигнального пути (рис. 2).
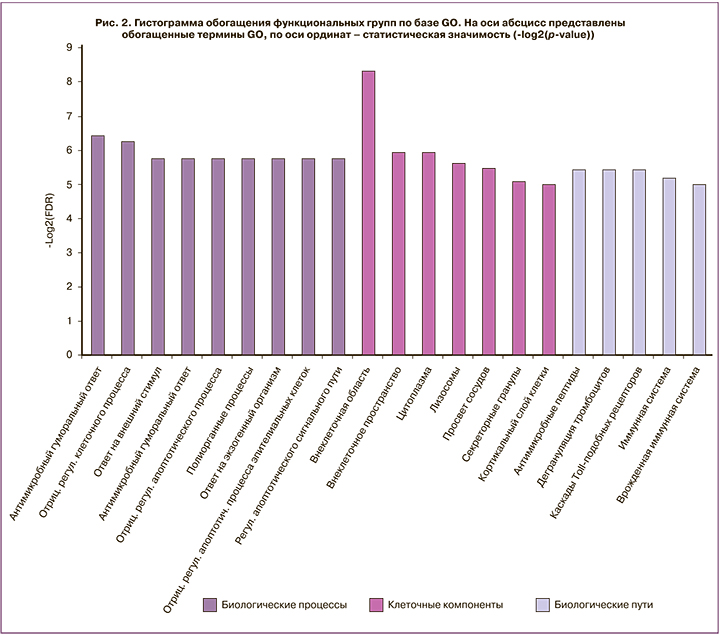
Активация иммунных процессов может быть обусловлена изменением микробной композиции эндоцервикса и влагалища в ходе патологического процесса [17], а также персистенцией вируса ВПЧ. На это указывает участие данных белков в биологических путях врожденного иммунитета, а также в антимикробных процессах. Снижение уровня белков BPI, BPIFB1 и CSTA может быть следствием выздоровления пациентов. Белки BPI являются важными цитотоксическими белками полиморфноядерных лейкоцитов; зачастую BPI имеют сродство к грамотрицательным бактериям [18] не характерной для микробиотной композиции цервикального канала, представленной Lactobacillus spр. [17]. В свою очередь, данные белки обладают большим сродством к Sneathia spp., являющимся микробиологическим маркером папилломавирусной инфекции [19]. Другим важным участником врожденного иммунитета является FGB. Этот белок участвует в иммунном ответе путем передачи сигнала через Toll-подобные рецепторы [20]. Кроме того, FGB принимает участие в апоптотическом процессе, а именно, в регуляции апоптоза эпителиальных клеток и регуляции апоптотического каскада [21].
Уровни 34 белков ЦВЖ достоверно изменились спустя 12 месяцев после первого обращения. Среди них важно выделить белок KLK6, выполняющий защитную функцию при развитии злокачественного процесса, принимающий участие в эпителиально-мезенхимальной трансформации [22], а также белок SBSN, являющийся значимым прогностическим белком, маркером эпидермальных клеток. Вероятно, изменение уровней данных белков опосредовано элиминированием патологического процесса у пациентов.
Заключение
В ходе динамического наблюдения за пациентками c «малыми» поражениями эпителия шейки матки в трех точках (1 раз в 6 месяцев) была протестирована предложенная ранее панель белков ЦВЖ, специфичных для ВПЧ-ассоциированного неопластического процесса. Показано, что данные белки отражают динамику патологического процесса, и их оценка может использоваться для оценки эффективности тактики ведения пациенток для сохранения репродуктивной функции.



