Рак яичников – серьезная проблема среди женщин всех возрастных групп, занимающая 7-е место по распространенности и 3-е место после рака тела и шейки матки среди всех злокачественных опухолей у женщин [1]. При этом рак яичников является лидирующим в структуре смертности от онкогинекологических заболеваний – половина больных не переживут 5-летний рубеж [2]. В России в 2019 г. зарегистрировано 14 318 больных раком яичников, при этом смертность составила 7616 [3]. Кроме истинных опухолей, в яичнике могут быть и опухолевидные образования, которые являются доброкачественными [4]. Частота ложноположительных диагнозов, основанных на данных визуальной диагностики при доброкачественных опухолях и опухолевидных образованиях яичников, остается высокой и достигает 30% [5], поэтому совершенствование алгоритмов визуальной диагностики с целью определения риска злокачественности представляет большой научный и практический интерес [6]. Оптимизация протоколов, создание единого стандарта терминологии и унификация категорий образований яичников с учетом риска их малигнизации позволит повысить качество исследований и улучшить раннюю диагностику опухолей яичников. В ноябре 2018 г. под руководством Американского общества радиологов совместно с международной группой экспертов по визуализации в гинекологии и лечению новообразований яичников был опубликован лексикон новой классификации образований яичников ORADS (Ovarian-Adnexal Imaging Reporting and Data System) [7]. ORADS – система описания и обработки данных ультразвуковых исследований (УЗИ) яичников. Этот стандартный лексикон описания ультразвуковых данных представлен в таблице 1 [7]. Балльная система ORADS колеблется от 1 до 5 с различными процентами риска того, что образование яичника является злокачественным (табл. 2). Опухолевые маркеры не играют никакой роли в оценке риска злокачественности в этой системе, и это пока первая гинекологическая ультразвуковая классификация, которая предложила варианты наблюдения, тактики ведения в каждой группе риска [8].
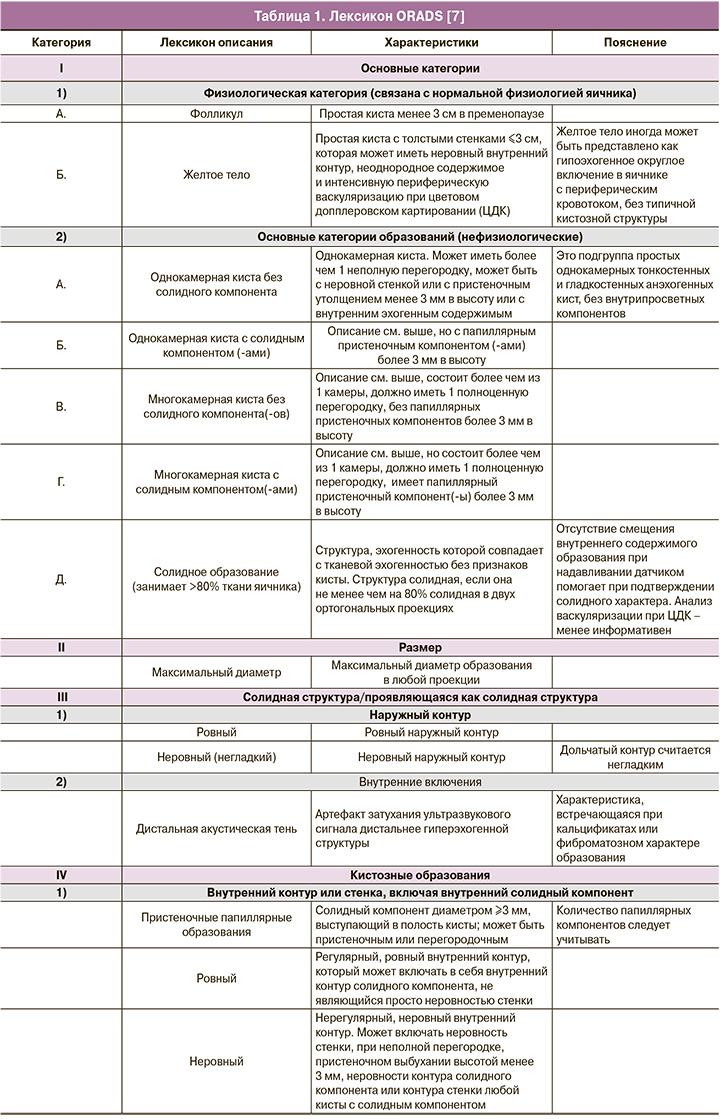
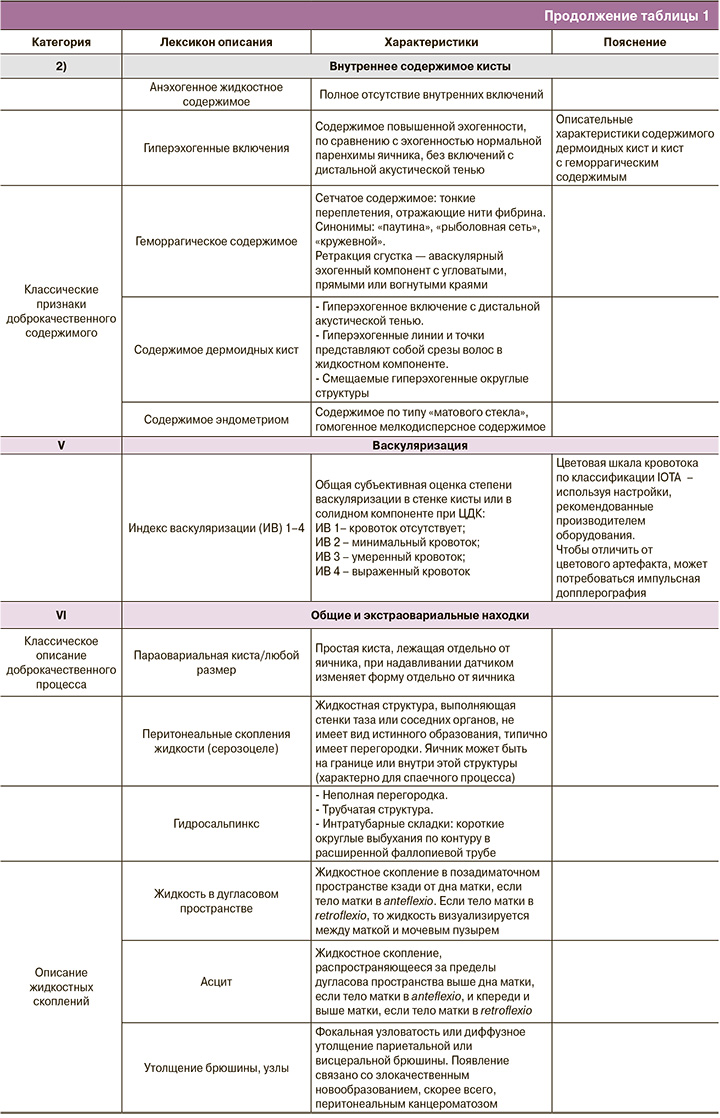
В последнем издании ORADS в 2020 г. уже рассматривается стандартизация в интерпретации образований яичников и их категоризация в отношении риска злокачественности, что должно значительно уменьшить двусмысленность в протоколах УЗИ, повысить вероятность постановки правильного диагноза и, соответственно, улучшить маршрутизацию [8]. Правильная интерпретация данных УЗИ в случае образований яичников, ведущая к постановке правильного диагноза, является ключом к точности в определении риска злокачественности новообразований и, наконец, оптимальному ведению пациентки.
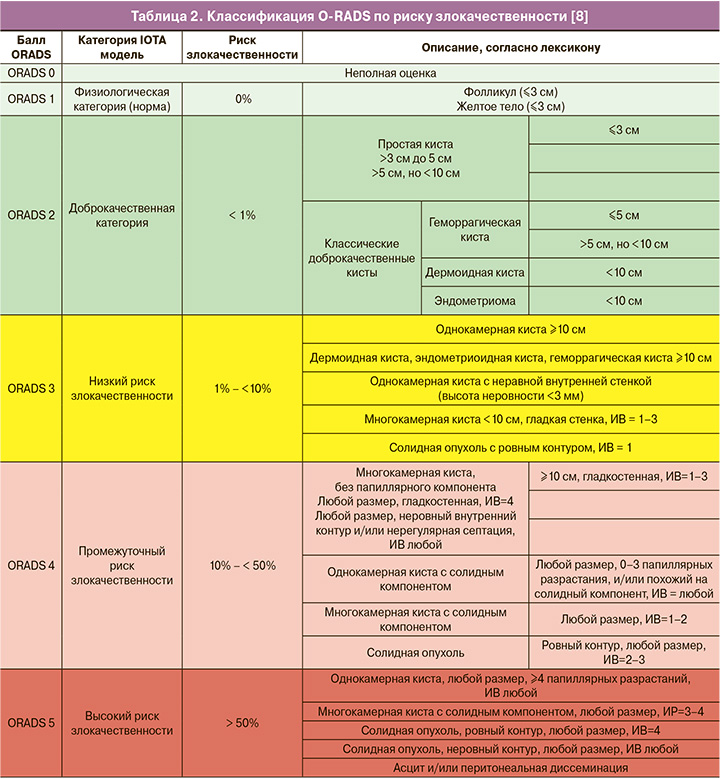
Стоит упомянуть, что классификация ORADS включила в себя ранее изданные классификации IOTA (Международная группа по анализу опухолей яичников) и GI-RADS (Gynecologic Imaging Reporting and Data System), значительно дополнила их тактикой наблюдения и ведения, особенно для доброкачественных кист. Согласно новой классификации ORADS, алгоритм стратификации рисков делится на шесть основных категорий (ORADS 0–5), причем категории рисков разрабатывались комитетом на основе данных IOTA, и расчет риска проводился с учетом и соответствием риска злокачественности по IOTA-ADNEX модели.
ORADS 0
ORADS 0 является неполной оценкой из-за технических факторов, таких как газ кишечника, большой размер поражения, невозможный для оценки при УЗИ, или невозможность проведения трансвагинального УЗИ по причине болезненности.
ORADS 1
ОRADS 1 – физиологическая категория, которая актуальна только у пациенток в пременопаузе, включает фолликул и желтое тело. В заключении рекомендуется их описывать, как фолликул и желтое тело, а не как кисту.
ORADS 2
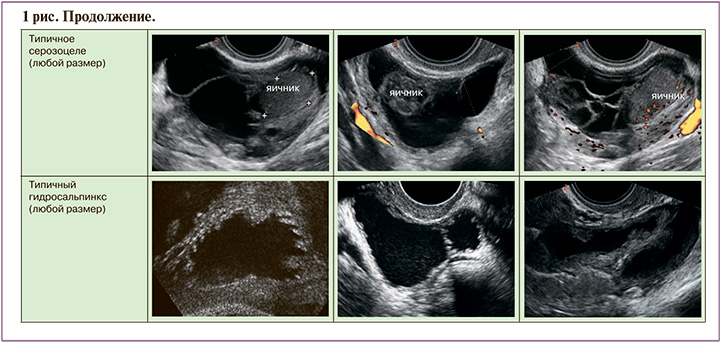
ORADS 2 – однозначно доброкачественная категория (риск злокачественности 1%); в нее вошло большинство однокамерных кист менее 10 см: простые кисты; несложные однокамерные с гладкими внутренними стенками и кисты, которые могут быть описаны с помощью классических доброкачественных поражений и их дескрипторов, если их максимальный диаметр составляет менее 10 см. К ним относятся: типичная геморрагическая киста, дермоидная киста, эндометриома, параовариальная киста, серозоцеле и гидросальпинкс (рис. 1). Хотя анализ васкуляризации не включен в оценку поражений в категории ORADS 2, он проводится в обязательном порядке, особенно при наличии геморрагических кист с ретрактированным сгустком, чтобы исключить солидный васкуляризированный компонент.

Согласно клиническим рекомендациям Минздрава Российской Федерации (МЗ РФ) [9], бессимптомные простые односторонние однокамерные кисты яичников диаметром менее 5 см имеют низкий риск озлокачествления опухоли, поэтому у женщин в пременопаузе никаких контрольных исследований не требуется, а у женщин в постменопаузе – наблюдение 1 раз в год [8, 9]. Подавляющее большинство кист в этой категории спонтанно регрессирует в течение года и не требует немедленного хирургического лечения. Эндометриомы, дермоидные кисты, геморрагические кисты более 5 см, но менее 10 см требуют наблюдения 8–12 недель (по классификации ORADS [8]) и 4–6 месяцев – по клиническим рекомендациям МЗ РФ [9]. На дообследование методом магнитно-резонансной томографии (МРТ) отправляют кисты при их увеличении или отсутствии регресса. При нормальных уровнях СА-125 сыворотки крови тактика ведения консервативная, с повторным обследованием в динамике. Если через 1 год операция не производится, а киста остается неизменной либо уменьшается в размерах при нормальном уровне СА-125, возможно продолжение наблюдения 1 раз в год.
Международная исследовательская группа из имперского колледжа Лондона и Левенского католического университета, исследовав 8519 пациенток с простыми кистами размерами, значительно большими, – менее 10 см, установила, что в 80% киста при динамическом наблюдении исчезала, потенциальный риск осложнений при простых кистах составил 0,2–0,4% (в результате разрыва или перекрута), тогда как в результате хирургического вмешательства осложнения возникали в 3–15% (перфорация кишки, пересечение мочеточника, перфорация мочевого пузыря, нагноения и др.) [10].
Консервативная или активно выжидательная тактика ведения простых кист в категории ORADS 2 была расширена до значений 10 см в связи с отсутствием пограничных и злокачественных опухолей в этой категории. Это утверждение подкрепляется данными многих исследований, таких как Modessit et al. [11] с анализом более 15 тыс. случаев однокамерных простых кист размерами до 10 см, а также данными рандомизированных исследований, проведенных в США PLCO (Prostate, Lung, Colorectal, and Ovary) с участием 78 216 женщин [12] и в Великобритании UKCTOCS (United Kingdom Collaborative Trial of Ovarian Cancer Screening) с участием 202 638 женщин в постменопаузе [13], в которых также не было выявлено пограничных и злокачественных опухолей и было установлено, что популяционный скрининг рака яичников не увеличивает выживаемость от рака яичников, а приводит к увеличению инвазивных медицинских вмешательств и связанных с ними осложнений [14].
ORADS 3
ORADS 3 – категория низкого риска (от 1% до 10%) злокачественности, включает более крупные образования доброкачественной категории и другие поражения с более высоким риском злокачественности. В нее включены простые кисты; односторонние гладкие несимметричные кисты; образования с классическими доброкачественными признаками, размеры которых превышают или равны 10 см. Уровень отсечения в 10 см был использован с учетом значительного увеличения риска развития злокачественных новообразований, с использованием данных IOTA 1–3 [10, 14–19]. Также в эту категорию входят однокамерные кисты с неровностью внутреннего контура стенки; многокамерные кисты менее 10 см без папиллярного компонента (-ов) с ИВ менее 4; а также аваскулярные солидные опухоли с ровным внешним контуром любого размера (подразумеваются фибромы) (рис. 2). Начиная с категории ORADS 3, оценка васкуляризации включается в систему стратификации риска. Дескрипторы ORADS 3 перечислены в табл. 2.
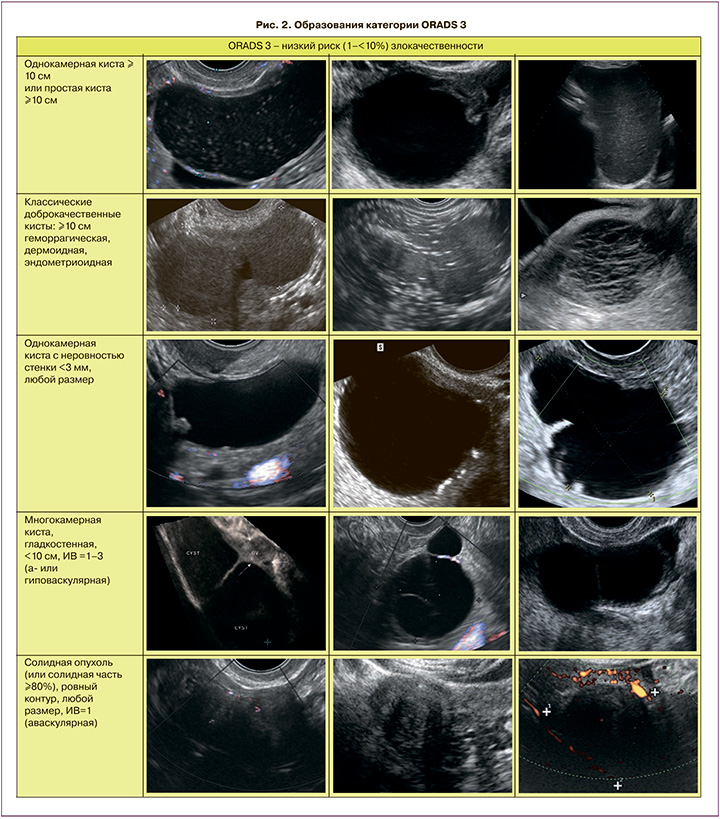
В эту категорию отнесли те образования, которые не могут быть однозначно отнесены к доброкачественным, но и не имеют однозначно злокачественных признаков. Согласно данным AIUM, опубликованным в 2017 г., субъективная оценка категории образования врачом-экспертом УЗИ превосходит по информативности ROMA в группе сложных опухолей (чувствительность УЗИ – 96,7%) [20].
Однокамерные кисты с истинными перегородками должны оцениваться с учетом количества, толщины и «регулярности» перегородок. Если имеется одинарная тонкая (3 мм) перегородка, то, скорее всего, образование будет доброкачественным [21]. В скрининговом исследовании, в котором оценивались 2870 кист с 1 или более перегородкой, без папиллярных разрастаний, большинство кист оказались серозными или муцинозными цистаденомами, 1 – пограничной опухолью, с отсутствием рака яичников. Это позволяет предположить, что многокамерные кисты с малым числом тонких перегородок без папиллярных разрастаний и солидных компонентов ассоциированы с очень низким риском злокачественности [21].
Размер опухоли является важным элементом оценки для определения риска злокачественности. Он должен быть получен путем измерения наибольшего диаметра независимо от плоскости, в которой этот диаметр измеряется. Зрелые тератомы и эндометриомы имеют низкий риск злокачественности, как правило, менее 0,8%, при небольших размерах [22]. Риск злокачественной трансформации повышается при больших эндометриомах (>9 см) и у женщин старше 45 лет [23]. Поэтому, как и в случае муцинозных кист, возможно динамическое наблюдение для оценки морфологических изменений, в частности, быстрого роста или появления солидных васкуляризированных компонентов.
Злокачественная трансформация муцинозной цистаденомы яичников возможна, но обычно в течение достаточно длительного периода. Согласно данным некоторых немногочисленных публикаций, считается, что пограничные муцинозные опухоли яичников встречаются при размерах более 10 см и с выраженной многокамерностью [24]. Таким образом, активно выжидательная тактика с ультразвуковым контролем еще возможна только при небольших кистах с меньшим количеством камер и отсутствием кровотока в них [25, 26]. Фибромы яичников с их классическими ультразвуковыми признаками – гипоэхогенное образование с акустическим затенением и отсутствием васкуляризации относятся к категории ORADS 3. Фибромы могут вызывать асцит и плевральный выпот, называемый синдромом Мейгса.
ORADS 4
ORADS 4 относится к категории промежуточного риска (от 10% до 50% риска злокачественных новообразований), которая включает признаки более высокого риска злокачественности (рис. 3). К ней относят многокамерные кисты, больше или равные 10 см; или имеющие неровный внутренний контур стенки (3 мм в высоту) или нерегулярную септацию; однокамерные и многокамерные кисты любого размера с папиллярным компонентом или ИВ до 4; а также солидные опухоли (более 80% составляет солидная часть) с ИВ 2–3. Индивидуальные дескрипторы ORADS4 перечислены в табл. 2.

Следует отметить, что папиллярный компонент – это выбухание в просвет кисты, исходящее из стенки кисты или перегородки высотой более или равной 3 мм [7]. Кисты с 1 или несколькими небольшими папиллярными компонентами менее 3 мм, скорее всего, будут доброкачественными [27]. Однако если папиллярные разрастания любого размера составляют более 50% от общей поверхности внутреннего контуры кисты или их 4 и более, злокачественность более вероятна и образование классифицируется, как ORADS 5 [27]. Краткосрочное наблюдение может быть целесообразным для пациентов с однокамерными кистами, содержащими 1 или несколько небольших солидных аваскулярных папиллярных компонентов.
Однокамерные или многокамерные кисты с множественными папиллярными компонентами (>4) или солидные опухоли яичников с наличием васкуляризации имеют высокий риск оказаться пограничной опухолью или эпителиальным раком яичников [28, 29], поэтому критериями разделения этих образований между категориями ORADS 4 и ORADS 5 будут количество папиллярных компонентов и степень их васкуляризации.
В категории ORADS 4 очень важна оценка кровотока с целью определения наличия или отсутствия кровотока в стенке кисты или в солидных компонентах, что будет определять потенциальный риск злокачественности. Известно, что усиленный кровоток коррелирует с повышенным злокачественным потенциалом, тогда как отсутствие васкуляризации имеет высокую отрицательную прогностическую ценность в отношении злокачественности. Но отсутствие или наличие сосудов в образовании не может быть использовано в качестве изолированного признака для определения риска злокачественности. Важно отметить, что спектральные доплеровские параметры сами по себе тоже не позволяют эффективно отличить злокачественные поражения от доброкачественных [30].
ORADS 5
ORADS 5 – категория высокого риска (более 50% риск малигнизации), состоит из признаков, которые однозначно характерны для злокачественных образований яичников. К ним относятся нерегулярные папиллярные разрастания и многокамерные кисты с солидным компонентом и высоким ИВ (рис. 4). Наличие асцита и/или перитонеального канцероматоза также указывает на категорию ORADS 5, за исключением случаев, когда имеется асцит в сочетании с физиологической кистой или однозначно доброкачественным поражением (ORADS 2). Индивидуальные дескрипторы категории ORADS 5 перечислены в табл. 2.

Категоризация образований по O-RADS применяется только к поражениям, связанным с яичниками или маточной трубой. Если происхождение поражения органов малого таза не определено, но предполагается, что это яичники или фаллопиевы трубы, то также может применяться система ORADS. Если поражение органов малого таза четко идентифицируется как неяичниковое или трубное по происхождению, то система ORADS будет уместна только в случае параовариальной кисты или при серозоцеле, в противном случае не применяется [8]. В случаях множественных или двухсторонних поражений каждое поражение должно быть охарактеризовано отдельно, а заключение основывается на поражении с самым высоким баллом ORADS. Эластография яичниковых образований пока еще не вошла в классификацию ORADS, в связи с тем, что этот метод наиболее информативен для категоризации солидных опухолей и крупных папиллярных компонентов в кистозных образованиях [31], тогда как для кистозных образований его роль ограничена [32].
В случаях неопределенных или прогрессирующих образований МРТ с контрастным усилением улучшает дифференциальную диагностику между доброкачественными и злокачественными образованиями, обеспечивает более высокую специфичность диагноза при доброкачественности [28, 29]. Следует отметить, что уже вышли и изданы аналогичные стандарты описания и обработки данных для МРТ при яичниковых образованиях [33], которые помогают определить показания к операции и ее объем.
В данном освещении новой классификации O-RADS подробно не затрагивались вопросы тактики ведения по каждой категории, в связи с тем, что некоторые разделы расходятся с рекомендациями, опубликованными в Письме Минздрава России от 04.12.2018 № 15-4/10/2-7838, что требует предварительного согласования и обсуждения. Простые кисты яичников не являются предвестниками злокачественного рака яичников; однако очень важно провести качественное обследование, чтобы убедиться в отсутствии каких-либо солидных компонентов или неровности контура стенки. Трансвагинальное УЗИ в руках опытного врача в настоящее время является наиболее точным методом характеристики опухолей яичников.
Заключение
Таким образом, новая классификация ORADS обеспечивает единую диагностическую платформу, на которой могут работать как клиницисты, так и специалисты визуальной диагностики. Использование единого лексикона и трактовки ультразвуковых данных, а также категоризация образований по рискам малигнизации будут способствовать стандартизации и преемственности диагностики яичниковой патологии. Практическое значение данной классификации для поликлинического звена гинекологов трудно переоценить: данная классификация упрощает создание групп риска по раку яичников. Поэтому скорейшее внедрение этой классификации в клиническую практику является актуальной задачей для врачей всех специальностей, включенных в алгоритм профилактики, диагностики и лечения в акушерстве и гинекологии.



