Комбинированные оральные контрацептивы (КОК) с момента их создания претерпевали постоянные усовершенствования, касающиеся в основном дозировки этинилэстрадиола и изменений прогестинового компонента. До настоящего времени современные КОК содержали прогестины III поколения и этинилэстрадиол, которые обладали минимальными побочными эффектами и рядом дополнительных неконтрацептивных свойств, позволяющих осуществлять индивидуальный подбор с учетом наличия у пациенток ряда генитальных и экстрагенитальных патологических состояний. Влияние КОК на состояние вагинальной микрофлоры неоднократно подвергалось обсуждению. Так как состояние микрофлоры влагалища во многом гормонозависимо, логично предположить, что применение КОК должно позитивно отражаться на локальной микробиоте. Однако наряду с исследованиями, подтверждающими положительную роль КОК, имеются данные о возможном увеличении частоты вагинального кандидоза, а также о риске развития бактериального вагиноза (БВ) [1–4]. Известно, что под действием эстрогенов в клетках влагалища происходит синтез гликогена. Прогестерон вызывает слущивание и разрушение эпителиальных клеток влагалища с последующим высвобождением из них гликогена, который распадается на мальтозу и декстрозу, служащие субстратами для лактобактерий. В процессе взаимодействия лактобактерий и гликогена образуется молочная кислота, которая поддерживает необходимый уровень рН секрета влагалища и создает естественный фильтр. Эстрогензависимая способность лактобацилл к адгезии на эпителиальных клетках, продукция перекиси водорода и антибиотикоподобных веществ препятствуют размножению и росту патогенных и условно-патогенных микроорганизмов [2, 5, 6]. Cнижение эстрогенной насыщенности эпителия влагалища приводит к возникновению благоприятных условий для развития БВ. Среди женщин репродуктивного возраста БВ диагностируется с частотой от 4 до 87%, а частота рецидивов в течение 0,5–1 года после лечения доходит до 30% [7]. Основной причиной рецидивирующего течения БВ считают недостаточность функции неспецифического иммунитета влагалища, в частности, его неспецифического, гуморального и клеточного звеньев, также непосредственно связанную с эстриолом [8, 9]. Вероятно, отсутствие у этинилэстрадиола биоидентичности не позволяло однозначно ответить на вопрос о влиянии КОК с этинилэстрадиолом на влагалищный биотоп. Появление в составе КОК эстрадиола валерата – биоидентичного синтетического эстрогена, метаболизирующегося в организме женщины до эстриола, позволило продолжить исследования в этом направлении.
Цель исследования. Оценить роль КОК с различными эстрогенными и прогестиновыми компонентами в коррекции микробиоценоза влагалища у пациенток с рецидивирующим БВ.
Материалы и методы
В основную группу исследования на основе добровольного согласия были включены 106 пациенток в возрасте от 25 до 35 лет с рецидивирующим БВ (2–4 эпизода в год). Группу контроля составили 35 здоровых пациенток в возрасте 18–35 лет.
Критерием включения в основную группу явилось наличие рецидивирующего БВ. К критериям исключения отнесены: выявленное при обследовании наличие ВИЧ-инфицирования, вирусных гепатитов, сифилиса, гонококковой, хламидийной, уреаплазменной, микоплазменной, вирусной (цитомегаловирус, вирус простого герпеса, вирус папилломы человека), трихомонадной, грибковой инфекций, наличие у пациентки внутриматочной спирали (ВМС), беременности, другой гинекологической патологии, острой экстрагенитальной патологии, обострения хронической экстрагенитальной патологии, сахарного диабета 1-го и 2-го типов, ожирения 3 степени.
Всем пациенткам основной и контрольной групп проведено исследование микробиоценоза влагалища. БВ был верифицирован на основании критериев Амселя (pH влагалища определяли тестом для самостоятельной диагностики влагалищной кислотности Premium Diagnostics с цветовой шкалой от 4,0 до 7,0) и микроскопии мазка, окрашенного по Граму, с подсчетом баллов по методике Ньюджента. Проводилось исследование биоценоза влагалища у женщин методом PCR Real time (ПЦР-РВ, полимеразная цепная реакция в реальном времени) (Фемофлор 16), включая факультативно-анаэробные микроорганизмы, облигатно-анаэробные микроорганизмы, микоплазмы и грибки. Определялся вид доминирующей лактофлоры методом генотипирования ПЦР-РВ.
В вагинальном секрете исследованы показатели локального иммунитета: лизоцим – методом конкурентного иммуноферментного анализа (тест-система Human Lysozyme ELISA Kit EL3010-1 (Assay Max, США)); sIgA, IL-6, IL-10 – методом твердофазного иммуноферментного анализа (ТИФА) (тест-системы «ИФА-Бест») с расчетом провоспалительного индекса (ПВИ) как отношения IL-6 к IL-10, у.е.
Лечение БВ осуществлялось по единой схеме, включавшей деконтаминационную и контаминационную терапии. В качестве деконтаминационной терапии были использованы клиндамицин 300 мг перорально 2 раза в сутки в течение 7 дней и препарат, сочетающий микронизированный метронидазол 750 мг и микронизированный нитрат миконазола 200 мг, интравагинально – 1 суппозиторий на ночь ежедневно в течение 7 дней. В качестве деконтаминационной терапии был использован пробиотик, содержавший лиофилизированную культуру лактобактерий L. casei rhamnosus Doderleini (1108 КОЕ в 1 капсуле), ежедневно интравагинально 1 капсула в течение 14 дней. После окончания курса деконтаминации-контаминации проведено контрольное обследование с целью подтверждения эффективности терапии. Половой партнер во всех случаях был обследован у уролога и, при необходимости, пролечен согласно выставленному диагнозу. В дальнейшем, в связи с необходимостью контрацепции, преобладающему количеству наблюдаемых (80 пациенток) были назначены комбинированные гормональные контрацептивы. В зависимости от назначаемого препарата пациентки были разделены на 3 клинические группы: 1-я группа (n=27) – четырехфазный КОК с эстрадиола валератом и диеногестом; 2-я группа (n=27) – монофазный препарат с этинилэстрадиолом 30 мкг и диеногестом; 3-я группа (n=26) — монофазный КОК с этинилэстрадиолом 30 мкг + дроспиренон 3 мг. Пациентки, отказавшиеся от гормональной контрацепции, были выделены в 4-ю клиническую группу (n=26). Наблюдение за обследуемым контингентом велось в течение 6 месяцев, оценивались количество рецидивов, динамика состояния локального иммунитета и микробиоценоза влагалища.
Статистический анализ полученных данных проводили, используя нахождение характеристик описательной статистики. Предварительный анализ распределения числовых данных в выборках проводили с помощью графического построения, проверку на нормальность закона распределения – с помощью критерия Шапиро–Уилка. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD). При описании признаков с распределением, отличающимся от нормального, средние значения описывались в виде медианы и квартильного отклонения. При выполнении основной задачи сравнения двух независимых групп по одному признаку был использован двусторонний t-критерий Стьюдента для независимых переменных и U-критерий Манна–Уитни. Для сравнения двух выборок в процентах применялось φ* – угловое преобразование Фишера. Статистический анализ полученных данных проводили при помощи стандартных методов математико-статистической обработки с использованием программы Microsoft Office Excel 2013 и Statistica 6.0. Различия между группами считали статистически значимыми при р<0,05.
Результаты
Средний возраст обследуемых пациенток составил 25,7 (5,3) года. В основной группе у всех пациенток (100%) были выявлены положительный аминный тест, наличие ключевых клеток при микроскопии мазка, pH влагалища составил 5,3 (5; 5,5) и был статистически значимо выше, чем у пациенток группы контроля – 4,0 (4; 4,4), р<0,001. При интерпретации результатов оценки влагалищного биотопа по шкале Ньюджента у пациенток основной группы количество баллов составило 9 (8; 9), что соответствовало параметрам, определяемым как БВ (7—10 баллов), и статистически высокозначимо отличалось от результатов пациенток группы контроля 2 (1; 2), р<0,001.
Исследование биоценоза влагалища у пациенток основной клинической группы показало, что, в соответствии с алгоритмами интерпретации результатов теста Фемофлор-16, большинство случаев – 99 (93,4%) трактовались как выраженный дисбиоз (87 (82%) — аэробный, 19 (18%) – смешанный). Общая бактериальная масса (ОБМ) у пациенток с БВ составила в среднем 106,8 ГЭ/об, абсолютное количество лактобацилл – 103,6 ГЭ/мл, относительное количество лактобацилл в среднем –2,6 (Log) от ОБМ. В контрольной группе ОБМ составила 107,4 ГЭ/мл при относительном количестве лактобацилл 107,2 ГЭ/мл, что соответствовало -0,1(log) от ОБМ.
В контрольной группе у 32 (91%) пациенток единственным преобладающим типом лактобактерий являлись L. сrispatus. В 3 (2,8%) случаях мы отмечали рост L. iners, L. jensenii, L. gasseri, но ни в одном из случаев он не был доминирующим. В группе пациенток с рецидивирующим БВ L. iners идентифицировали в 58 (54,7%) случаях и в 46 (43%) – их рост доминировал; L. crispatus выявляли у всех пациенток, при этом доминирующий рост отмечался только у 36 (34%) пациенток (L. jensenii и L. gasseri доминировали в 10 (9,4%) и 15 (14%) случаях соответственно). Микрофлора влагалища у пациенток с БВ характеризовалась чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов (>107 КОЕ/мл).
Среди облигатно-анаэробных организмов преобладали Gardnerella vaginalis – выявлялись у всех пациенток, у 45 (42,5%) пациенток обнаружена Atopobium vaginae, у 32 (30,2%) — Lachnobacterium spp./Clostridium spp., у 28,3% — Mobiluncus spp./Corynebacterium spp. Факультативно-облигатные микроорганизмы в количестве, превышающем 104 КОЕ/мл, были представлены Enterobacteriaceae spp. – 12 (11,3%) пациенток, Streptococcus spp. — 4,7%, Staphylococcus spp. – 4 (3,8%).
Локальный иммунитет вагинального секрета пациенток с рецидивирующим БВ характеризовался статистически значимым снижением уровня лизоцима – 17,3 (16,2; 17,8) мкг/л против 52,6 (48,7; 53,4) мкг/мл в группе контроля, р<0,001, и статистически значимым снижением sIgА, осуществляющего функцию иммунного исключения, – до 21,6 (17,5; 26,6) мг/л против 78,4 (78,4; 88,4) мг/л в контрольной группе, р<0,001. Несмотря на отсутствие воспалительной реакции у пациенток с рецидивирующим БВ наблюдался дисбаланс в синтезе цитокинов, участвующих в развитии воспалительной реакции. Так, уровень IL-6 был статистически значимо увеличен до 106,3 (103,7; 109,1) пкг/мл против 90,2 (90,2; 94,8) пкг/мл в контроле, р<0,001. При этом наблюдалось статистически значимое снижение IL-10 до 38,5 (37,8; 39,6), р<0,001, что отражалось на ПВИ вагинального секрета, который составил 2,7 (2,4; 2,9) у.е. в основной группе против 1,5 (1,3; 1,5) в контроле, р<0,001.
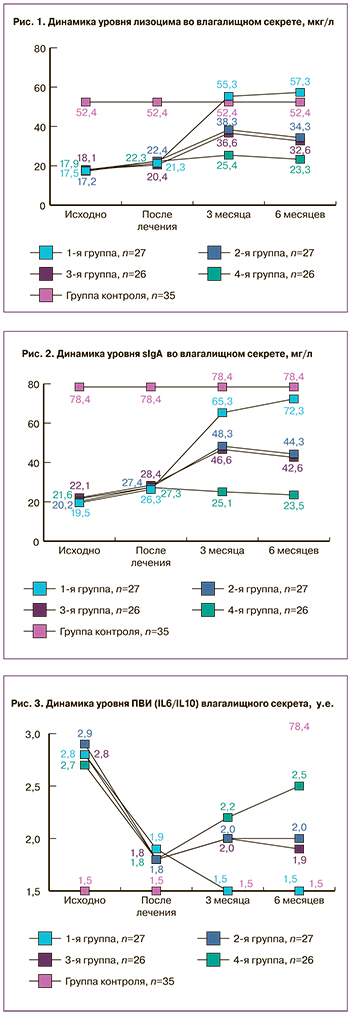 В целом, по данным нашего исследования, рецидивирующий БВ характеризовался выраженным снижением количества лактобацилл во влагалищном секрете, с преобладанием у большинства женщин L. iners, высокой концентрацией облигатных и факультативных анаэробов, а также нарушением локального иммунитета влагалища, затрагивающего неспецифическую защиту биологических сред, секреторную функцию и клеточные механизмы, что соответствует данным ранее проведенных исследований [4, 5]. По завершении лечения критерии Амселя у всех 106 (100%) пациенток отсутствовали, при этом pH влагалища составил 4,0 (4; 4,4). Результаты оценки влагалищного биотопа по шкале Ньюджента выявили снижение количества баллов до 5 (5; 6), что соответствовало определению «промежуточная микрофлора» (4–6 баллов). Снизилась степень колонизации эпителия факультативными и облигатными микроорганизмами до 104 КОЕ/мл и менее и возросла колонизация лактобактериями до 106-7 КОЕ/мл. При этом мы отметили некоторое улучшение локального иммунитета влагалищного секрета.
В целом, по данным нашего исследования, рецидивирующий БВ характеризовался выраженным снижением количества лактобацилл во влагалищном секрете, с преобладанием у большинства женщин L. iners, высокой концентрацией облигатных и факультативных анаэробов, а также нарушением локального иммунитета влагалища, затрагивающего неспецифическую защиту биологических сред, секреторную функцию и клеточные механизмы, что соответствует данным ранее проведенных исследований [4, 5]. По завершении лечения критерии Амселя у всех 106 (100%) пациенток отсутствовали, при этом pH влагалища составил 4,0 (4; 4,4). Результаты оценки влагалищного биотопа по шкале Ньюджента выявили снижение количества баллов до 5 (5; 6), что соответствовало определению «промежуточная микрофлора» (4–6 баллов). Снизилась степень колонизации эпителия факультативными и облигатными микроорганизмами до 104 КОЕ/мл и менее и возросла колонизация лактобактериями до 106-7 КОЕ/мл. При этом мы отметили некоторое улучшение локального иммунитета влагалищного секрета.
Так, уровень лизоцима увеличился до 19,4 (19,2; 20,5) мкг/л, уровень секреторного sIgA вырос до 27,6 (27,6; 29,5) мг/л, а ПВИ вагинального секрета снизился до 1,7 (1,5; 1,9) у.е.
При этом все показатели локального иммунитета статистически значимо отличались от результатов здоровых женщин (лизоцим – 52,6 (48,7; 53,4) мкг/мл, sIgA – 78,4 (78,4; 88,4) мг/л, ПВИ – 1,5 (1,3; 1,6) у.е., р<0,001 для всех показателей) (рис. 1–3).
Отмечено, что у пациенток 1-й группы при применении четырехфазного КОК с эстрадиола валератом и диеногестом динамически нарастали уровни лизоцима, секреторного иммуноглобулина sIgA и снижался ПВИ вагинального секрета, причем результаты к 6 месяцу наблюдения практически достигли и даже по некоторым параметрам превысили показатели группы контроля (1-я группа: лизоцим – 55,9 (52,2; 62,6) мкг/мл, sIgA – 78,4 (73,1; 88,4) мг/л, ПВИ – 1,5 (1,4; 1,7) у.е.; см. рис. 1—3).
При применении монофазного препарата с этинилэстрадиолом 30 мкг и диеногестом – 2-я группа и монофазного КОК с этинилэстрадиолом 30 мкг + дроспиренон 3 мг – 3-я группа параметры локального иммунитета к 6-му месяцу приема КОК также улучшились, уровень лизоцима вырос до 32,6 (30,7; 34,6) мкг/мл во 2-й группе и до 31,5 (29,1; 33,7) мкг/мл в 3-й группе. Уровень sIgA увеличился до 44,3 (38,5; 48,6) мг/л – 2-я группа и до 42,6 (37,7; 47,6) – 3-я группа, ПВИ снизился до 1,9 (1,7;1,8) у.е. во 2-й группе и до 1,8 (1,6; 1,7) – в 3-й. При этом отмечено, что все показатели, характеризующие состояние звеньев местного иммунитета влагалища, статистически значимо отличались от соответствующих у пациенток 4-й группы, не применявших КОК (лизоцим – 17,9 (17,5; 19,6) мкг/мл, sIgA – 18,5 (16,7; 19,6) мг/л, ПВИ – 2,3 (2,2; 2,4) у.е., р<0,001 для всех показателей), однако не достигли показателей результатов контрольной группы (см. рис. 1–3).
При генотипировании лактобактерий влагалища через 6 месяцев после окончания наблюдения мы выявили изменение доминирующего типа лактобактерий у 13 (48,1%) пациенток в 1-й группе, у 6 (22,2%) – во 2-й и у 5 (19,2%) – в 3-й. В 4-й группе тип доминирующей лактобациллярной флоры не изменился ни у одной женщины. В течение всего периода наблюдения мы отметили однократный рецидив у 1 (3,7%) пациентки 1-й группы, у 5 (18,5%) и 6 (19,2%) пациенток 2-й и 3-й групп соответственно и у 16 (64%) пациенток 4-й группы, что коррелировало с изложенным выше состоянием локального иммунитета влагалища и превалирующей доминацией L. iners (таблица).
Выводы
Стандартная деконтаминационная и контаминационная терапия рецидивирующего БВ приводит к временному улучшению микробиоценоза влагалища, практически не влияя на состояние местных защитных реакций.
КОК с этинилэстрадиолом улучшают показатели местного иммунитета, что способствует снижению рецидивов бактериального вагиноза.
Четырехфазный КОК с эстрадиола валератом и диеногестом имеет преимущество перед КОК с этинилэстрадиолом при необходимости контрацепции у пациентки с БВ, вероятно, в связи с особенностями фармакодинамики эстрадиола валерата. Этинилэстрадиол, являясь синтетическим препаратом, конкурентно напрямую воздействует на клетки-мишени. Тогда как эстрадиола валерат как синтетический, но биоидентичный препарат метаболизируется до эстриола, непосредственно взаимодействующего с клетками-мишенями суммарно с эндогенным эстриолом. Это обеспечивает его более эффективное влияние на пролиферативные процессы, протекающие в эпителии влагалища, опосредованно улучшая локальный иммунитет и благоприятствуя росту лактофлоры.
Диеногест в составе КОК, не обладая антиэстрогенным эффектом, поддерживает благоприятное влияние эстрадиола валерата на слизистую влагалища, что в совокупности и обеспечивает поддержку нормоценоза влагалища, тем самым способствуя значительному уменьшению рецидивов БВ.



