Эндометриоз – генетически обусловленное, гормонально- и иммунозависимое хроническое заболевание, характеризующееся доброкачественным разрастанием ткани, схожей по морфологическому строению с эндометрием, но находящейся за пределами полости матки [1–3]. Эндометриоз является наиболее тяжелым и распространенным заболеванием в основном среди женщин репродуктивного возраста, влияющим на их фертильность, а также снижающим качество жизни, работоспособность и общее состояние преимущественно за счет синдрома хронической тазовой боли (ХТБ) [1–6].
Известно, что аберрантная сигнализация прогестерона в эндометрии играет значительную роль в нарушении децидуализации и установлении эктопической имплантации эндометрия. При этом эктопические клетки эндометрия у женщин с эндометриозом не способны понижать регуляцию генов, участвующих в регуляции клеточного цикла, что приводит к неконтролируемой пролиферации.
Постулировано несколько причин резистентности эндометрия к прогестерону, включая врожденное «прекондиционирование», при котором внутриутробная среда способствует восприимчивости младенца к неонатальным маточным кровотечениям и эндометриозу [7]. Действие прогестерона имеет большое значение при уменьшении воспаления в эндометрии, а девиантная сигнализация прогестерона может приводить к провоспалительному фенотипу; соответственно, хроническое воспаление может индуцировать феномен резистентности к прогестерону [8]. Генетические причины резистентности к прогестерону включают полиморфизм генов белковых биомолекул, ответственных за синтез прогестерона, измененную экспрессию микроРНК и эпигенетические модификации рецепторов прогестерона в тканях и органах-мишенях [9, 10]. Усугубляет резистентность к прогестерону и циклический ретроградный трубный заброс эндометрия, определяющий формирование хронического воспаления брюшины [11].
Важно подчеркнуть необходимость разделять два понятия: резистентность к прогестерону и сенсибилизация к прогестерону с позиций диалектического понятия «причина и следствие». Сенсибилизация – причина, а резистентность – следствие.
Лечение эндометриоза и эндометриоз-ассоциированной боли включает в себя этапы хирургического лечения и последующую гормональную терапию [2, 3, 12–14]. Препаратами выбора послеоперационного лечения эндометриоза являются гестагены [2, 3, 12–15]. В качестве гестагенов чаще используются препараты с действующими веществами дидрогестерон (10–30 мг/сут) и диеногест (2 мг/сут) [2, 3, 16].
Выбор конкретной схемы лечения зависит от потребностей пациентки, выраженности симптомов и реакции на лечение. Ведущими экспертами Российского общества акушеров-гинекологов в 2023 г. разработаны и опубликованы «Алгоритмы ведения пациенток с эндометриозом», которые помогают индивидуализировать терапию в зависимости от возраста, наличия/отсутствия репродуктивных планов, проведенного/непроведенного хирургического лечения и других факторов [17]. Персонализация терапии эндометриоза позволяет добиться лучших результатов лечения [17].
Однако, рассматривая терапию с точки зрения сенсибилизации больных к прогестерону, стоит отметить различие в молекулярном строении дидрогестерона и диеногеста. У половины пациенток с эндометриозом следствием нарушения действия прогестерона является неэффективность гормональной терапии [1, 2, 4]. Среди причин, обуславливающих резистентность больных эндометриозом к терапии прогестагенами, рассматривается блокировка рецепторного аппарата прогестерона циркулирующими иммунными комплексами. Молекула прогестерона – гетероцикличный органический комплекс на основе циклопентанпергидрофенантрена. Малый размер не подразумевает образования к ней типоспецифических антител. Тем не менее транспортный белок, общий для прогестерона человека и его экзогенных аналогов, привносимых извне с пищей и лекарственными препаратами, формирует структуры, относящиеся к категории гаптенов. Именно к ним образуются антитела, способные перекрестно блокировать транспортный комплекс «прогестерон-транспортный белок» как непосредственно в плазме крови, формируя нефункциональный токсичный циркулирующий иммунный комплекс, так и в рецепторном аппарате тканей, блокируя регуляторную гормональную трансмиссию на звенья клеточного метаболизма. В первом случае лабораторно констатируется прогестерондефицитное состояние, во втором – иммуногистохимически – тканевой дефицит рецепторного аппарата. В обоих случаях подход к терапии универсальный: экзогенное назначение препаратов прогестеронового ряда (гестагенов) [18].
По данным исследования Cicinelli Е. et al. (2017), у женщин с эндометриозом распространенность хронического эндометрита была статистически значимо выше по сравнению с женщинами без эндометриоза (33/78 (42,3%) против 12/78 (15,4%) по данным гистероскопии и 30/78 (38,5%) против 11/78 (14,1%) по данным гистологии). Это обусловлено наличием ряда общих этиопатогенетических факторов; поэтому для лечения следует использовать препараты, которые будут влиять на оба состояния [19].
Структурная идентичность препаратов прогестерона синтезированной организмом биологически активной гормональной молекуле, вероятно, является положительным свойством фармакологического средства, но в случае сенсибилизации к прогестерону это положение представляется дискутабельным. Более того, становятся понятными факты парадоксального эффекта от назначения подобных препаратов, проявляющиеся в разной степени выраженности местными и системными аутоиммунными реакциями.
В этом плане представляется выгодным использование молекул, обладающих прогестероновой активностью, но имеющих стехиометрическую модификацию. В качестве потенцирующего эффекта прогестероновой активности рассматривается определяемое структурной особенностью большее сродство к рецепторному аппарату; в частности, подобными свойствами обладает молекула дидрогестерона [18, 20–22]. Вероятно, именно благодаря стехиометрическим особенностям комплекс молекулы дидрогестерона с транспортным белком не обладает столь выраженной, подобно синтезированным структурным аналогам прогестерона, степенью иммуногенности.
Цель исследования: оценить эффективность комплексного лечения больных с эндометриозом и ХТБ с учетом предварительной диагностики их сенсибилизации к прогестерону.
Материалы и методы
Исследование проведено в отделении гинекологии клиники акушерства и гинекологии ФГБОУ ВО «ПСПбГМУ им. академика И.П. Павлова» Минздрава России (руководитель клиники – д.м.н., проф. В.Ф. Беженарь) в период с сентября 2019 г. по апрель 2022 г.
Объектом исследования являлись пациентки (n=100) с эндометриозом, имеющие синдром ХТБ, репродуктивного возраста с подтвержденным при лапароскопии эндометриозом и ХТБ (не менее 3 баллов по визуально-аналоговой шкале (ВАШ)). Пациентки были разделены на 2 группы – с сенсибилизацией к прогестерону и без – и затем на 4 подгруппы (рис. 1):
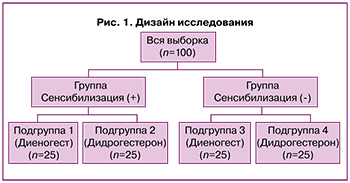
- подгруппа 1 (n=25): с сенсибилизацией к прогестерону, ХТБ, обусловленной эндометриозом; женщины получили хирургическое лечение, а затем, в течение 6 месяцев, гормональную терапию препаратом с действующим веществом диеногест в дозе 2 мг/сут в непрерывном режиме;
- подгруппа 2 (n=25): с сенсибилизацией к прогестерону, ХТБ, обусловленной эндометриозом; пациентки получили хирургическое лечение, а затем, в течение 6 месяцев, гормональную терапию препаратом с действующим веществом дидрогестерон в дозе 20 мг/сут курсами в пролонгированном циклическом режиме с 5-го по 25-й дни менструального цикла;
- подгруппа 3 (n=25): без сенсибилизации к прогестерону, с ХТБ, обусловленной эндометриозом; женщины получили хирургическое лечение, а затем, в течение 6 месяцев, гормональную терапию препаратом с действующим веществом диеногест в дозе 2 мг/сут в непрерывном режиме;
- подгруппа 4 (n=25): без сенсибилизации к прогестерону, ХТБ, обусловленной эндометриозом; пациентки получили хирургическое лечение, а затем, в течение 6 месяцев, гормональную терапию препаратом с действующим веществом дидрогестерон в дозе 20 мг/сут в пролонгированном циклическом режиме курсами с 5-го по 25-й дни менструального цикла.
Критерии участия в исследовании: добровольное согласие на участие; наличие диагноза «эндометриоз», подтвержденного при помощи клинических, лабораторных и инструментальных методов; ХТБ; возраст 23–38 лет; применение хирургического лечения всем пациенткам; назначение диеногеста после операции пациенткам 1-й и 3-й подгрупп и дидрогестерона – 2-й и 4-й подгрупп; клинически незначимые сопутствующие болезни.
Критерии исключения: персональный отказ; психические, инфекционные, злокачественные патологии; беременность; нарушение протокола исследования; возраст моложе 18 и старшее 45 лет; тяжелые сопутствующие заболевания.
Всем пациенткам было проведено лапароскопическое хирургическое лечение. Пациенткам проводилось лапароскопическое иссечение инфильтративных очагов эндометриоза и овариоцистэктомия с последующей гистологической верификацией эндометриоза. Все пациенты имели гистологически верифицированный эндометриоз.
Клиническое обследование. Сбор жалоб, анамнеза, оценка интенсивности ХТБ, диспареунии и дисменореи с помощью ВАШ, катамнестическое анкетирование пациентов спустя 6 месяцев после хирургического лечения и гормональной терапии.
Инструментальное исследование. Для определения наличия сенсибилизации к прогестерону использовалась оригинальная авторская методика [23]: стабилизированная забуференными детергентами, полученная вне зависимости от фазы менструального цикла плазма крови пациенток обрабатывалась с помощью оригинальной ультразвуковой лабораторной кавитационной установки (диспергатора) («ИНЛАБ-УЛЬТРАЗВУК», Россия) (рис. 2) с целью дезинтеграции циркулирующих иммунных комплексов (ЦИК), сопровождающейся высвобождением комплексов «прогестерон-транспортный белок». Далее комплекс «прогестерон-транспортный белок» определяли рутинным методом с иммунофлуоресцентной детекцией. Уровень прогестерона в плазме крови определялся до и после ультразвукового воздействия, и на основании повышения уровня прогестерона оценивали наличие сенсибилизации к прогестерону и степень ее выраженности.
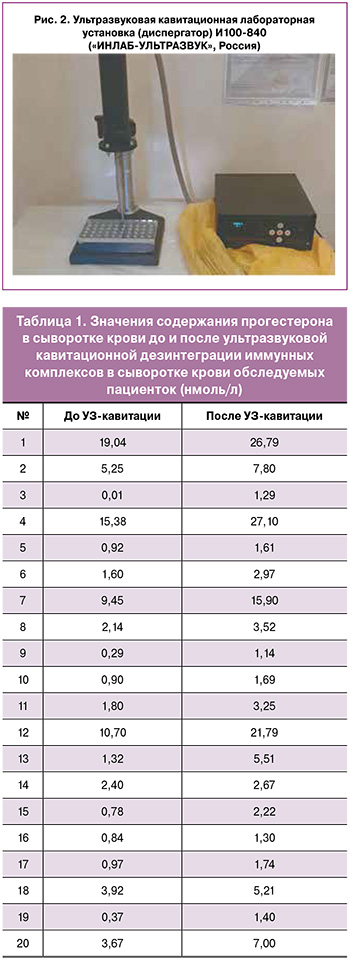
Отдельные примеры изменения содержания прогестерона в сыворотке крови до и после ультразвуковой кавитационной дезинтеграции иммунных комплексов представлены в таблице 1.
При проведении исследования использовались результаты, полученные при выполнении инициативного научного проекта «Разработка методики ультразвуковой дезинтеграции иммунных комплексов в биологических жидкостях с целью выделения свободных специфических антигенов и антител, пригодных для ранней и экспертной диагностики» (шифр №59/06-31). Выполнено при поддержке ФГАОУ ВО «Севастопольский государственный университет».
Срок наблюдения: первый этап исследования – день госпитализации; второй этап – день выписки из больницы; третий этап – спустя 6 месяцев после операции.
Статистический анализ
Статистический анализ полученных данных проводился на персональном компьютере с использованием программной среды R версии 4.1.12. Переменная «возраст», имеющая нормальное распределение, представлена в виде среднего арифметического и стандартного отклонения M (SD). Нормальность проверялась с помощью критерия Шапиро–Уилка. Данные о ВАШ представлены в виде медианы и интерквартильного интервала Me (Q1–Q3) для всех подгрупп независимо от распределения для удобства сравнения величин, поскольку в некоторых выборках распределение не было согласовано с гауссовским. Бинарные данные представлены в виде количества и доли в процентах одного из бинарных значений – n (m%).
Для выявления эффекта в динамике ВАШ использовался критерий Вилкоксона. Для сравнения изменений по ВАШ использовался критерий Манна–Уитни с учетом поправки на множественные сравнения по методу Бенджамини–Иекутиели.
Во всех случаях проверки гипотез за пороговое p-значение принималось 0,05.
Результаты и обсуждение
После подписания информированного согласия, сбора жалоб, анамнеза было проведено анкетирование пациенток. Далее всем пациенткам были проведены лапароскопическое иссечение инфильтративных очагов эндометриоза и овариоцистэктомия с последующей гистологической верификацией эндометриоза. У 100% исследуемых пациентов эндометриоз был гистологически верифицирован.
Сенсибилизация к прогестерону была выявлена у 50% пациенток – подгруппы 1, 2; в то время как в подгруппах 3 и 4 сенсибилизация к прогестерону отсутствовала. Пациентки существенно не различались по клиническим характеристикам типов эндометриоз-ассоциированных болей, оцененных по ВАШ (табл. 2), за исключением отличия по ХТБ между подгруппами 1 и 2 (p<0,001) и между подгруппами 2 и 3 (p=0,003).
По результатам анкетирования пациенток по ВАШ после проведенного комплексного лечения были получены различия между всеми исследуемыми подгруппами, согласно критерию Краскела–Уоллиса, и далее был проведен post-hoc анализ через попарные сравнения при помощи критерия Манна–Уитни с учетом поправки Бенджамини–Иекутиели на множественные сравнения. При дальнейшем изложении p-значения для попарных сравнений скорректированы в соответствии с этой поправкой.
В результате сравнительного анализа по показателю ХТБ после лечения между подгруппами были получены значимые различия между всеми исследуемыми подгруппами, p<0,001 для критерия Краскела–Уоллиса. При попарном сравнении с учетом поправки были получены различия между подгруппой 1 и подгруппой 2 (p<0,001), между подгруппой 1 и подгруппой 3 (p<0,001), между подгруппой 1 и подгруппой 4 (p<0,001) (рис. 3). Значимых различий между подгруппами 2 и 3 (p=0,10), 2 и 4 (p=1,00), а также 3 и 4 (p=0,06) выявлено не было.
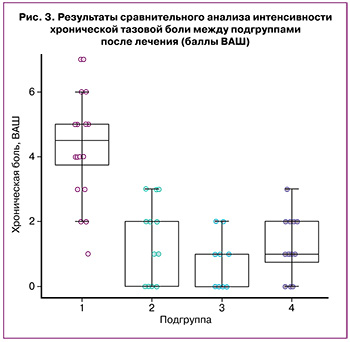
Уменьшение боли в подгруппе 1 на 3,0 (2,0–4,0) балла оказалось ниже, чем в подгруппе 2 – на 4,0 (2,8–5,0) балла (p=0,036), а также в подгруппе 3 – на 6,0 (6,0–8,0) баллов (p<0,001) и в подгруппе 4 – на 4,5 (4,0–6,0) балла (p<0,001). Уменьшение боли в подгруппе 2 оказалось значимо ниже, чем в подгруппе 3 (p<0,001). Уменьшение боли в подгруппе 4 было ниже, чем в подгруппе 3 (p=0,007). Значимых различий между уменьшением боли в подгруппах 2 и 4 (p=0,20) выявлено не было.
В результате сравнительного анализа по показателю боли при менструации после лечения были получены различия между всеми исследуемыми подгруппами, p<0,001 для критерия Краскела–Уоллиса. При попарном сравнении были получены значимые различия между подгруппой 1 – 3,5 (2,0–5,3) балла и подгруппой 2 – 2,0 (1,0–3,0) балла (p=0,034), между подгруппой 1 – 3,5 (2,0–5,3) балла и подгруппой 3 – 2,0 (1,0–2,0) балла (p<0,001), а также между подгруппой 3 – 2,0 (1,0–2,0) балла и подгруппой 4 – 3,0 (1,8–3,0) балла (p=0,023) (рис. 4). Значимых различий между подгруппами 2 и 3 (p=0,46), а также 2 и 4 (p=1,00) выявлено не было.
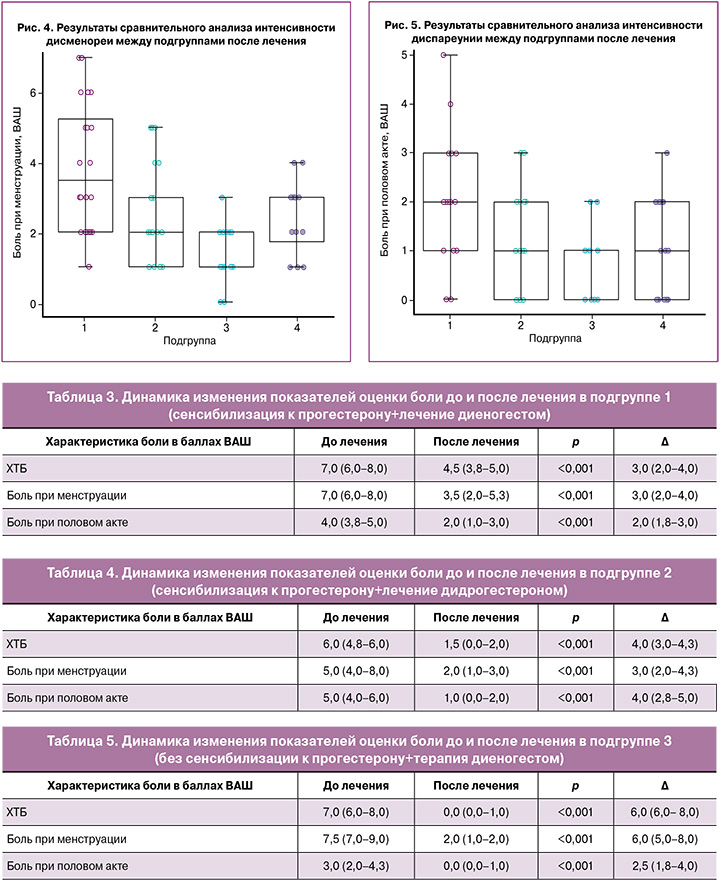
Уменьшение боли в подгруппе 1 на 3,0 (2,0–4,0) балла оказалось ниже, чем в подгруппе 3 – на 6,0 (5,0–8,0) балла (p=0,036), а также в подгруппе 4 на 4,5 (4,0–6,0) балла (p=0,008). Уменьшение боли в подгруппе 2 – на 2,0 (2,0–4,3) балла было ниже, чем в подгруппе 3 – на 6,0 (5,0–8,0) балла (p=0,002). Значимых различий между уменьшением боли в группах 1 и 2 (p=1,00), 2 и 4 (p=0,06), а также 3 и 4 (p=0,33) выявлено не было.
В результате сравнительного анализа по показателю бoли при пoловом актe после лечения также были получены различия между всеми исследуемыми подгруппами, p=0,002 для критерия Краскела–Уоллиса. Однако при попарном сравнении были получены различия только мeжду подгруппoй 1 – 2,0 (1,0–3,0) балла и подгруппoй 3 – 0,0 (0,0–1,0) балла (p=0,003) (рис. 5). Значимых различий между подгруппами 1 и 2 (p=0,39), 1 и 4 (p=0,43), 2 и 3 (p=0,38), 2 и 4 (p=1,00), а также 3 и 4 (p=0,41) выявлено не было.
Уменьшение боли в подгруппе 1 на 2,0 (1,8–3,0) балла оказалось ниже, чем в подгруппе 2 – на 4,0 (2,8–5,0) балла (p=0,038), а также в подгруппе 4 – на 4,0 (2,0–6,3) балла (p=0,030). Уменьшение боли в подгруппе 3 на 2,5 (1,8–4,0) балла не отличалось статистически значимо от других подгрупп, в частности, от 1 (p=1,00), от 2 (p=0,46) и от 4 (p=0,41). Не было выявлено также отличий между уменьшением боли в подгруппах 2 и 4 (p=1,00).
В результате сравнительного анализа после лечения во всeх подгруппах были получены значимые различия по вcем показателям. Результаты исследования динамики изменений показателей оценки боли в подгруппах до и после лечения представлены в таблицах 3–6.
После лечения все показатели снизились. Результаты указывают на связь между наличием сенсибилизации к прогестерону и эффективностью комплексной терапии эндометриоз-ассоциированной боли.
Таким образом, наличие сенсибилизации к прогестерону является новым и важным критерием подбора гормональной терапии после хирургического лечения для пациенток с эндометриозом и ХТБ. Выбор гестагена обуславливается степенью сродства молекулы препарата к рецепторам прогестерона, что определяет его прогестагенную активность; степенью сродства с другими рецепторами, что определяет дополнительные, обычно нежелательные эффекты [24].
Результаты исследования демонстрируют, что наиболее эффективным вариантом лечения эндометриоза у пациенток с сенсибилизацией к прогестерону является дидрогестерон по причине отсутствия перекрестной авидности антител к комплексу «прогестерон-транспортный белок» в отношении комплекса «дидрогестерон-транспортный белок». Молекула дидрогестерона, в отличие от природного прогестерона и его структурных аналогов, имеет не только присущее ей радикальное строение, но и характерную стехиометрически измененную структуру [18, 25]. Принципиально важным моментом, определяющим высокую специфичность и селективность дидрогестерона, является позиционирование альфа-метильной группы С19. В результате метаболизма образуется фармакологически активный метаболит, обладающий исключительно прогестагенной активностью [21].
Проведенные исследования показали, что уникальные, последовательно определяющие друг друга особенности структуры молекулы дидрогестерона и воздействия на рецепторный аппарат клетки определяют клинически значимый эффект [12, 16, 18, 26–28]. Высокая селективность дидрогестерона к прогестероновым рецепторам (тропен исключительно к рецепторам прогестерона) обеспечивает хороший профиль безопасности препарата [21]. Отсутствие связи у дидрогестерона с андрогеновыми, глюкокортикоидными, минералкортикоидными рецепторами обуславливает отсутствие у этого препарата целой группы нежелательных реакций [20], ограничивающих применение других гестагенов (например, диеногеста) у женщин [29, 30]. У диеногеста сила аффинитета к прогестероновым рецепторам в 15 раз меньше, а связь с другими рецепторами увеличивает вероятность возникновения нежелательных побочных явлений [20, 24] (табл. 7).
Дидрогестерон среди всех гестагенов обладает самой высокой селективностью в отношении прогестероновых рецепторов, что повышает эффективность терапии, особенно у пациенток, имеющих на момент проведения лечения сниженную чувствительность прогестероновых рецепторов [24]. Среди гестагенов для лечения эндометриоза именно дидрогестерон не обладает антигонадотропным потенциалом и не вызывает развития гипоэстрогенного состояния у женщин; поэтому может быть назначен пациенткам длительно с целью терапии эндометриоза.
Полученные результаты аналогичны совместной позиции ведущих экспертов, опубликованной в виде алгоритмов ведения пациенток с эндометриозом [17]. Авторы призывают изначально после хирургического лечения (по необходимости) ориентироваться на первую линию терапии заболевания – гестагены, и в частности дидрогестерон (рис. 6, 7) [17].
Заключение
Наличие сенсибилизации к прогестерону является одним из наиболее важных критериев при подборе гормональной терапии после хирургического лечения для пациентов с эндометриозом и ХТБ. По результатам исследования, терапия гестагенами является эффективным вариантом гормонального послеоперационного лечения у больных с эндометриозом и ХТБ, а при индивидуальной оценке сенсибилизации пациентов к прогестерону предпочтение в терапии следует отдавать препарату с действующим веществом дидрогестерон.
Результаты проведенного исследования позволили разработать и внедрить для практического использования персонализированный подход к комплексному лечению пациентов с эндометриозом и ХТБ, включающий в себя этап определения сенсибилизации к прогестерону на основании динамического учета повышения содержания прогестерона в сыворотке крови после ультразвуковой кавитации, что позволяет подобрать эффективную терапию и улучшить качество жизни пациенток в послеоперационном периоде. Алгоритмы ведения пациенток с эндометриозом, а также понимание механизмов резистентности к прогестерону и врачебной тактики в этих условиях являются универсальным инструментом, который поможет улучшить клинические подходы к ведению пациенток с эндометриозом в ежедневной практике каждого врача.



