Несмотря на многочисленные работы, посвященные поиску молекулярных звеньев патогенеза пролиферативных заболеваний матки, механизмы, лежащие в основе развития миомы и аденомиоза, недостаточно изучены [1–3]. В настоящее время принято считать, что в основе патогенеза миомы матки лежат нарушения в синтезе и рецепции прогестерона [1, 4].
В свою очередь, аденомиоз считается эстроген-зависимой патологией, характеризующейся инвазией железистого и стромального компонента базального слоя эндометрия в миометрий [5, 6]. Кроме того, эндометрий больных аденомиозом отличается сниженной чувствительностью к прогестерону, что способствует выживанию и распространению эндометриоидных гетеротопий. Исследования А.Л. Унаняна показали наличие патогенетической общности очагов аденомиоза и аутологичного гиперплазированного эндометрия. Согласно данной концепции, источником аденомиоза служат клетки гиперплазированного эндометрия [7].
Половые стероиды регулируют рост миомы и инвазию эндометрия в миометрий посредством воздействия на стероидные рецепторы и включения ауто- и паракринных факторов (факторов роста, цитокинов), определяя интенсивность клеточной пролиферации, апоптоза и ангиогенеза [8].
Известно, что матка состоит из двух различных морфофункциональных слоев: внутреннего – архиметры и наружного – неометры [9, 10]. Их отличают происхождение, функция, активность в течение менструального цикла, клеточный и биохимический состав. Архиметра (эндометриально-субэндометриальная часть) филогенетически и онтогенетически является более древней и имеет парамезонефральное Мюллеровское происхождение [11]. Она состоит из эндометриального эпителия, цитогенной стромы и подлежащего субваскулярного слоя миометрия. Ее функции заключаются в процессах пролиферации, дифференцировки эндометриальных структур, обеспечении маточной перистальтики к шейке матки во время менструации и ко дну во время овуляции. Неометра – наружная часть миометрия имеет не Мюллеровское происхождение, ее основная функция сводится к изгнанию плода во время родов [10, 12].
На наш взгляд, проведение сравнительного анализа экспрессии генов стероидных рецепторов эстроген- и прогестерон-зависимых заболеваний в изолированных и сочетанных вариантах в рамках одного клинического исследования могло бы детализировать особенности реагирования эндометрия и миометрия на одни и те же патологические стимулы. Если эндометрий и миометрий рассматривать с позиций тканеспецифических различий, то реакции на стероидную стимуляцию, безусловно, должны отличаться [9]. В современной литературе отсутствуют сообщения, касающиеся сравнительных характеристик экспрессии генов стероидных рецепторов при миоме матки, аденомиозе, а также их сочетании, что и послужило поводом к проведению настоящего исследования.
Цель исследования: изучить особенности реагирования эндометрия и миометрия на стероидную стимуляцию путем определения уровня экспрессии генов стероидных рецепторов в узлах миомы, аденомиоза и окружающем миометрии при миоме матки, аденомиозе в сочетанных и изолированных вариантах.
Материал и методы исследования
Нами обследовано: 26 женщин с миомой матки, из них 11 были с клеточной миомой и 15 – с простой миомой; 12 больных аденомиозом; 10 – с сочетанием миомы и аденомиоза.
Для определения экспрессии генов стероидных рецепторов были использованы образцы тканей матки, удаленных в ходе хирургического вмешательства: миоматозных и аденомиозных узлов, а также миометрия, непосредственно окружающего узлы. Взятие образцов миометрия проводилось с согласия больных по стандартному протоколу этического комитета Российской Федерации. Сразу после удаления препарата свежий образец ткани помещали в сосуд Дьюара с жидким азотом до процедуры выделения РНК. Выделение суммарной РНК из образцов и ДНКазную обработку проводили с использованием наборов Qiagen (Rneasy Lipid Tissue Mini Kit и RNase-Free DNase Set соответственно, США) согласно рекомендациям производителя. Количество РНК в пробе определяли спектрофотометрическим методом. Качественный анализ выделенной РНК выполняли путем электрофоретического разделения в 1,5% агарозном геле. Уровень экспрессии исследуемых генов определяли с помощью полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР) с использованием Maxima SYBR Green qPCR Master Mix («Fermentas») на амплификаторе IQ5 («Bio-Rad Laboratories», США). В качестве гена сравнения использовали «ген домашнего хозяйства» GAPDH. В ПЦР использовали специфические праймеры к последовательностям генов: эстрогеновых рецепторов (ЕRα и ЕRβ); генов прогестероновых рецепторов (PGR). Каждую ПЦР, содержащую 1 мкл кДНК, проводили в объёме 25 мкл при следующих условиях: 95°С – 3 мин, 95°С – 15 сек (40 циклов), 58°С – 20 сек, 72°С – 20 сек. Для контроля специфичности ПЦР использовали кривые плавления. В каждом эксперименте на 1 планшет помещали образцы исследуемых кДНК с олигонуклеотидными праймерами на целевые гены и ген сравнения (по 3 повтора). Параметры ПЦР рассчитывали по дозо-зависимым кривым: эффективность реакции – не менее 90%, коэффициент корреляции – не менее 0,98, наклон кривой (slope) – 3,4±0,4.
Гистологически лейомиомы были представлены как одиночными, так и первично-множественными узлами бело-розового цвета, тяжистого вида, от 1,5 до 14 см в диаметре. Простая лейомиома чаще определялась в виде единичных узлов из плотной, беловатой, волокнисто-узловатой ткани с четкими границами. При микроскопическом исследовании, простая лейомиома состояла из коротких переплетающихся пучков гладкомышечных клеток с умеренно выраженными прослойками зрелой соединительной ткани, содержащей большое количество коллагеновых волокон. От окружающего миометрия узел четко отделялся псевдокапсулой. В состав псевдокапсулы входили артерии, артериолы, капилляры, венулы, вены и прослойки разрыхленной соединительной ткани. Лейомиоциты имели вытянутую веретенообразную форму и более крупные размеры, по сравнению с прилежащим к узлу миометрием (гипертрофия). Ядра лейомиоцитов были удлиненными, с тупыми концами, фигуры митоза и клеточная атипия отсутствовали. Строма выражена и представлена компонентами, состоящими из коллагеновых волокон, окрашиваемых по Ван Гизону в красный цвет, фибробластов, а также небольшого количества сосудов синусоидного типа. В ткани лейомиомы отмечались вторичные изменения в виде отека, очагов некроза, гиалиновой дистрофии.
Клеточные лейомиомы макроскопически были представлены, как правило, множественными узлами из плотной, беловатой, волокнисто-узловатой ткани со слабым желтоватым оттенком, с четкими границами. При микроскопическом исследовании узлы состояли из плотно расположенных пучков гипертрофированных лейомиоцитов с повышенным содержанием клеток гладкомышечной ткани на единицу объема. Лейомиоциты, по сравнению с клетками миометрия, были большего размера, округлой формы с крупными, гиперхромными, вытянутыми ядрами. От окружающего миометрия, клеточные лейомиомы отграничены хорошо выраженной псевдокапсулой. Клеточная лейомиома построена из круглых гипертрофированных лейомиоцитов, плотно и тесно прилегающих друг к другу, признаки атипизма клеток и фигуры митозов отсутствовали. Часто в клеточных участках определялись сосуды с периваскулярными мышечными муфтами. Строма клеточных лейомиом определялась скудной, была представлена тонкими фиброзными прослойками, сосудами капиллярного и синусоидного типа. Коллагеновые волокна при окраске на соединительную ткань (Ван Гизон) распределялись неравномерно, тонкими пучками. Вторичные изменения встречались в виде небольших очагов некроза, гиалиноза и дистрофии.
Аденомиоз был представлен эктопическими очагами эндометрия в миометрии, включающими в себя железы и клеточные элементы эндометриальной стромы, лимфоидные элементы и гемосидерофаги. Соотношение железистых структур и эндометриальных элементов стромы различалось на отдельных участках. Миометрий, окружающий очаги аденомиоза был в различной степени гипертрофирован. Патогномоничным морфологическим критерием гетеротопического эндометрия при аденомиозе являлась «неравномерность и нечеткость» базального слоя эндометрия, который местами проникал в различные отделы миометрия. В очагах диффузного аденомиоза соотношение стромы и желез было вариабельно: в 25% преобладала строма, в 30% – железистый компонент; в 45% – равное количество стромы и желез. Узловая форма аденомиоза в зависимости от количества взятого материала встретилась приблизительно в 25% случаев, диффузная – в 50%, диффузно – узловая – в 25%.
Статистическую обработку результатов проводили с использованием программы MedCals; статистически значимым считали р<0,05. Значимость различий между 2 параметрами рассчитывали по критерию Манна–Уитни.
Результаты исследования и обсуждение
Данные экспрессии генов стероидных рецепторов в группах сравнения представлены в таблице.
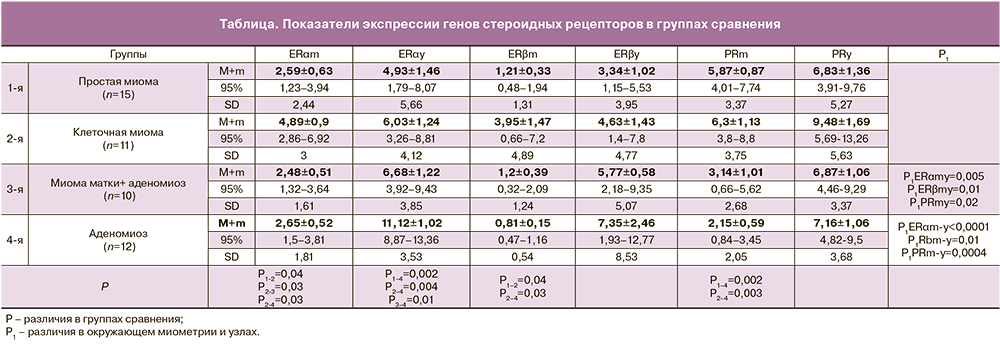
В результате проведенного исследования установлено, что уровень экспрессии генов эстрогеновых рецепторов был выше (от 2 до 9 раз) в узловых образованиях (миоматозные и аденомиозные узлы) по сравнению с их уровнем в окружающем миометрии. Наибольшие уровни экспрессии генов ЕRα и ЕRβ выявлены у больных с узловым аденомиозом, почти в 2 раза выше, в сравнении с таковыми в других группах исследованных, а наименьший уровень – у больных простой миомой. Уровень экспрессии генов PGR в узлах также был выше, чем в окружающем миометрии, при этом наибольшие значения установлены у больных с клеточной миомой. В окружающем миометрии максимальный уровень экспрессии генов как эстрогеновых, так и прогестероновых рецепторов определялся у больных с клеточной миомой. Уровни экспрессии генов ЕRαm и ЕRβm при клеточной миоме были в 1,8–4,8 раза выше, чем у больных в других группах сравнения. Уровень экспрессии генов PGRm, при этом был сопоставим с таковыми у больных простой миомой и пациенток с сочетанной патологией, и значимо выше (почти в 3 раза) в сравнении показателями женщин с аденомиозом. В окружающем миометрии наименьший уровень экспрессии как ЕRαm, ЕRβm, так и PGRm определялся у больных с аденомиозом.
Результаты проведенного нами исследования, подтверждают общепризнанную точку зрения, позиционирующую миому матки как гормоночувствительный пролиферат, где ведущая роль в патогенезе принадлежит прогестерону [4, 13]. При этом, значимо высокая экспрессия гена ЕRαm, установленная у больных клеточной миомой, на наш взгляд, заслуживает обсуждения и, скорее всего, имеет важное патогенетическое значение, определяя темп роста миомы и склонность к рецидивированию. Известно, что эстрадиол опосредованно индуцирует экспрессию PGR, увеличивает их биологическую доступность, повышает чувствительность тканей к прогестерону [14, 15]. Повышенная экспрессия гена ЕRαm у больных клеточной миомой, обусловленная местной гиперэстрогенемией [16], реализуется и чрезмерной стимуляцией PGR с выраженной гиперплазией и гипертрофией миометрия, а также экспрессией факторов роста. С учетом этого факта, при выборе противорецидивной терапии у больных клеточной миомой матки целесообразно предотвращать локальную гиперэстрогению путем назначения антиэстрогеных препаратов, ингибируя тем самым экспрессию PGR и нивелируя прогестероновое воздействие на миоциты.
Инвазия эктопического эндометрия в миометрий при аденомиозе обусловлена присущей строме гистологической агрессивностью, что связано с преобладанием ядерной субстанции над волокнистой [5]. Не подлежит сомнению тот факт, что значимо высокая экспрессия генов ER у больных аденомиозом, обусловленная местной гиперэстрогенемией, инициирует повышенный пролиферативный потенциал клеток эутопического эндометрия, способствуя тем самым центрифугальному росту базального эндометрия в миометрий [9]. В свою очередь, низкий уровень экспрессии генов PGR, установленный нами и, соответственно, отсутствие протективного воздействия прогестерона в узлах аденомиоза, поддерживает инвазию базального эндометрия в мышечный слой матки, что позволяет относиться к аденомиозу, как к гиперпластическому процессу эндометрия.
Сочетание же миомы и аденомиоза является чрезвычайно сложной проблемой. В литературе указывается на высокую частоту (85%) сочетанной патологии и отсутствие должного эффекта противорецидивного лечения у таких больных [17]. Так, если при изолированной миоме, в ситуации повышенной экспрессии PGR, патогенетически обоснованы и эффективны блокаторы прогестероновых рецепторов [18], а при аденомиозе, в условиях повышенной экспрессии ER – антиэстрогены и прогестагены [19], то при наличии сочетанной патологии эффект противорецидивного лечения различными группами препаратов далек от ожидаемого.
Результаты нашего исследования свидетельствуют о том, что при сочетании миомы матки и аденомиоза (эстроген-зависимой патологии и прогестерон-чувствительного заболевания) гены PGR и ER в патологических участках матки экспрессируются в равной степени и не значимо. Этот факт, в некоторой степени, может объяснить отсутствие эффекта противорецидивного лечения и скорее всего, свидетельствовать о роли эпигенетических механизмов в патогенезе сочетанных форм заболевания.
Заключение
Таким образом, установленное нами значимое преобладание экспрессии генов ER в очагах аденомиоза над показателями экспрессии генов PGR, демонстрирует существующую, генетически детерминированную реакцию цитогенной стромы и эндометриального эпителия на стероидную стимуляцию, которая реализуется гиперплазией эндометрия и его эктопией. Значимо низкая экспрессия генов стероидных рецепторов окружающего миометрия, в сравнении с таковой в очагах аденомиоза (ERm-y<0,0001; ЕRβm-y=0,01; PGRm-y=0,0004), служит подтверждением существующих различий реагирования стромы и миометрия на стероидную стимуляцию. Установленная нами значимо высокая экспрессия генов PGR, как в окружающем миометрии, так и в миоматозных узлах, реализуется гиперплазией и гипертрофией миоцитов. Функционально миометрий предназначен для изгнания плода во время родов, поэтому на стероидную стимуляцию миометрий реагирует гиперплазией и гипертрофией миоцитов, аналогично изменениям в миометрии во время беременности. Подтверждением этому служит исследование Г.А. Савицкого, показавшего, что рост узла миомы матки сопровождается обязательным увеличением массы миометрия, как и во время беременности; при этом миометрий матки при беременности не имеет принципиальных морфологических отличий от миометрия миоматозной матки [20].
Эндометрий и миометрий являются классической мишенью для половых стероидов, а схожие во многом преморбидный фон и клинические проявления доброкачественных пролиферативных заболеваний матки, позволяют думать и о единых патогенетических механизмах [17, 21]. Имеющиеся на сегодняшний день неудовлетворительные результаты противорецидивного лечения и высокая частота радикальных оперативных вмешательств при наличии доброкачественных заболеваний матки, требует детализации и поиска различий в механизмах патогенеза патологии эндометрия и миометрия. Это позволит персонифицировать лечебные подходы и исключить необоснованные оперативные вмешательства.
Выводы
- Высокая экспрессия генов эстрогеновых рецепторов в узлах аденомиоза наряду с недостаточной экспрессией генов прогестероновых рецепторов, обусловливают гиперплазию эндометрия и поддерживают его эктопию в толщу миометрия, что позволяет относиться к аденомиозу, как к гиперпластическому процессу эндометрия.
- Максимально высокий уровень экспрессии генов эстрогеновых рецепторов с одновременно значимо высоким уровнем экспрессии генов прогестероновых рецепторов в окружающем миометрии у больных клеточной миомой сочетались с повышенной экспрессией генов прогестероновых рецепторов в узлах миомы, что обусловливает выраженную гиперплазию и гипертрофию миоцитов, определяя темпы роста и склонность к рецидивированию.
- При сочетанной патологии уровни экспрессии генов эстрогеновых и прогестероновых рецепторов были не высоки; гены экспрессировались в равной степени, что позволяет думать о наличии эпигенетических механизмов в патогенезе сочетанной патологии и может в некоторой степени объяснить недостаточный эффект противорецидивного лечения.



