Международный проект «Микробиом человека» позволил по-новому взглянуть на роль микроорганизмов в физиологии и патологии человека [1], появилось понятие микробиома. Технологии секвенирования дали возможность расширить наши знания о микробиоте влагалища, получаемые до сегодняшнего дня в основном с помощью методов культивирования и амплификации ДНК.
Особое значение приобрело изучение микробиома влагалища при осложнениях беременности, ассоциированных с инфекционно-воспалительным фактором, к которым относится преждевременный разрыв плодных оболочек (ПРПО) при недоношенной беременности.
Это крайне актуально в связи с тем, что бактериологические методы и методы, основанные на полимеразной цепной реакции, уже исчерпали свои возможности, и принципиально новым подходом может стать изучение микробиома влагалища с помощью секвенирования генов 16s рРНК. Поскольку влагалище является одним из самых доступных органов для изучения биотопов человеческого организма, на сегодняшний день имеется достаточное количество данных о микробиоме влагалища у женщин различной расовой принадлежности в норме и при различных патологических состояниях [2–5]. Однако изучение этого вопроса в аспекте преждевременных родов, а именно при ПРПО, на сегодняшний день все еще остается весьма актуальной задачей.
Учитывая потенциально значимую роль инфекционно-воспалительного фактора в развитии ПРПО, а также проблему антибиотикорезистентности, расширение знаний о микробиоме с помощью методик секвенирования 16s рРНК приобретает решающее значение для создания стратегий, направленных на предотвращение неблагоприятных исходов при недоношенной беременности с ПРПО.
Цель исследования: изучение микробиома влагалища у беременных с ПРПО при недоношенной беременности в сроки до 28 недель беременности с помощью методики метагеномного секвенирования.
Материалы и методы
Исследование проводилось в Государственном бюджетном учреждении Ростовской области «Перинатальный центр» с 01.06.2019 по 31.03.2020. В I группу вошли женщины с ПРПО в сроке до 28 недель беременности. Во II группу включены женщины с физиологическим течением беременности.
Критерии включения: возраст от 18 до 40 лет, европеоидная раса. Критерии исключения: беременность, наступившая в результате вспомогательных репродуктивных технологий, многоплодная беременность, многоводие, операции на шейке матки, врожденные пороки развития матки, пороки развития плода, наличие вируса иммунодефицита человека, гепатита В, гепатита С, сифилиса, тяжелая экстрагенитальная патология, гестационный сахарный диабет, терапия антибактериальными препаратами в течение беременности до включения в исследование, инвазивные методы лечения и диагностики (амниоцентез, амниоредукция), травмы во время беременности, вредные привычки (курение, алкоголизм).
Каждая участница исследования заполнила информированное добровольное согласие на исследование. Локальный этический комитет Ростовского государственного медицинского университета одобрил проведение настоящего исследования.
Диагноз ПРПО выставлялся в соответствии с существующими диагностическими критериями: визуальное подтверждение подтекания жидкости из цервикального канала при осмотре в зеркалах с использованием пробы кашлевого толчка, данные ультразвукового измерения индекса амниотической жидкости, положительный амниотест, положительный тест AmniSure.
Материал для исследования микробиома в I группе брали из заднего свода влагалища в первые 12 ч после излития околоплодных вод до начала антибактериальной терапии в сроки с 22-й по 28-ю неделю, во II группе отделяемое было получено в аналогичные сроки (22-я неделя – 27 недель 6 дней).
Образцы помещали в стерильные пробирки с транспортной средой «транспортная среда с муколитиком» (Центральный научно-исследовательский институт эпидемиологии, Россия) и хранили при температуре +4°C до выделения ДНК.
Общая ДНК была выделена из образцов с помощью набора «РИБО-преп» (Центральный научно-исследовательский институт эпидемиологии, Россия) в соответствии с рекомендациями производителя.
Библиотеки ДНК 16S были подготовлены в соответствии с протоколом Illumina «подготовка библиотеки метагеномного секвенирования 16S» (часть № 15044223 Rev.B). Биоинформатический анализ данных секвенирования проводился с использованием языков программирования: R v.3.6 [6] и Python 3.6.9. На первом этапе последовательности праймеров были обрезаны с начала парных конечных считываний, причем пары считываний, не содержащие последовательности праймеров, отбрасывались. Затем были обрезаны конечные 25 пар оснований от конца каждого считывания как низкокачественные базы и обработаны полученные данные с помощью рабочего процесса DADA2 для точной идентификации вариантов последовательности [7]. После вывода точных вариантов последовательностей прямые и обратные считывания были объединены с помощью конкатенации, и полученные последовательности были использованы для сравнения по Байесовской таксономической классификации с использованием базы данных SILVA v132 в качестве эталона [8]. Видовое присвоение было выполнено с использованием алгоритма точного соответствия в DADA2 с использованием последовательностей SILVA v132, предварительно обработанных соответствующим образом с помощью пользовательских скриптов.
Статистический анализ
Для оценки различий между группами по количественным переменным с нормальным распределением (возраст пациенток, индекс массы тела, срок беременности на момент забора биологического материала) применялся t-критерий Стьюдента для независимых выборок, при отклонении от нормального распределения количественных переменных (сравнение относительной представленности бактерий (долей от общего состава)) использовали U-тест Манна–Уитни. Для проверки формы распределения применяли тест Колмогорова–Смирнова. Оценка различий между группами по качественным признакам (сравнение качественных анамнестических характеристик и частот встречаемости бактерий) проводилась с помощью точного теста Фишера. Для выявления возможной связи между показателями проводили корреляционный анализ с определением коэффициента корреляции Спирмена.
Различия признавались статистически значимыми на уровне р<0,05. Расчеты выполнялись в R (версия 3.6, R Foundation for Statistical Computing, Vienna, Austria).
Результаты
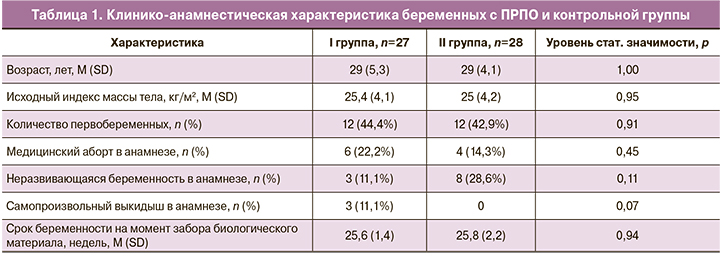
В I группу были включены 27 женщин, во II группу – 28 женщин, соответствовавших критериям исследования. Средний срок гестации в I группе на момент излития околоплодных вод составил 25,6±1,4 недели. Средний срок гестации на момент включения беременных в контрольную группу составил 25,8±2,2 недели. Средний возраст в I группе составил 29±5,3 года, во II группе – 29±4,1 года. При оценке акушерско-гинекологического анамнеза (медицинские аборты, неразвивающиеся беременности и самопроизвольные выкидыши в анамнезе) статистически значимых различий между пациентками двух групп также не было обнаружено (табл. 1).
Все пациентки I группы были обследованы в соответствии с приказом № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “Акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)”». Тактика беременных с ПРПО при поступлении определялась в соответствии с протоколом «Преждевременные роды» от 17 декабря 2013 г. №15-4/10/2-9480.
Специальным методом было исследование микробиома влагалища с помощью методики секвенирования, включающее массовое параллельное секвенирование (секвенирование нового поколения) гена 16S рРНК и биоинформационный анализ полученных данных с классификацией ДНК по таксономическим единицам. Микробиом влагалища анализировали по микроорганизмам, идентифицированным до рода и вида. Анализ проводился на основании сравнения относительной представленности (табл. 2) и частоты встречаемости (табл. 3) микроорганизмов в обеих группах.


Нами использован термин «relative abundance», что можно перевести как «относительная представленность». Анализируя относительную представленность родов микроорганизмов в микробиоме влагалища, мы должны констатировать, что максимальную нишу в микроорганизме влагалища представляют микроорганизмы рода Lactobacillus (рисунок).
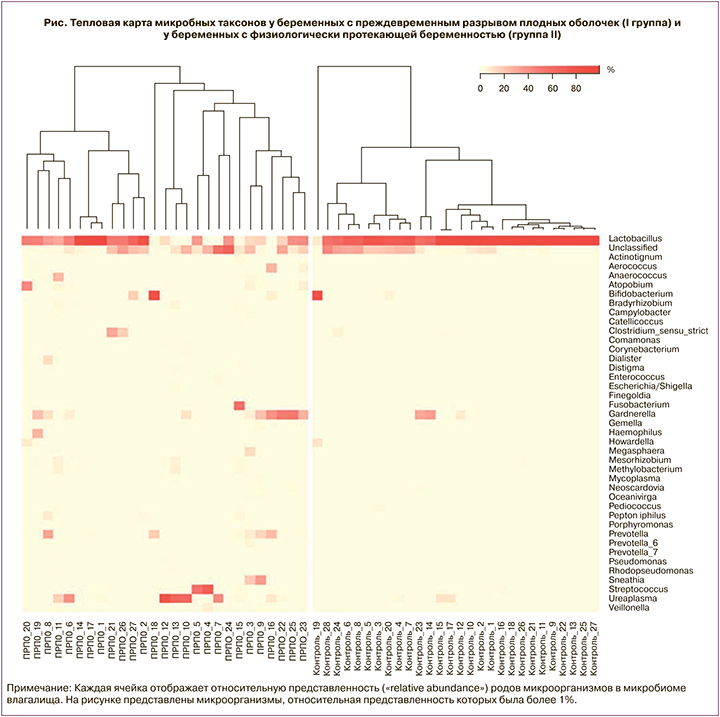
Статистически значимые различия по относительной представленности выявлены по 13 родам микроорганизмов в микробиоме влагалища (табл. 2).
Относительная представленность микроорганизмов рода Lactobacillus в микробиоме влагалища у беременных с ПРПО до 28 недель (группа I) – 33,9 (12,8;45,4), у беременных с физиологически протекающей беременностью (группа II) – 70,7 (50,8;79,7), p=0,03. Также у беременных с физиологически протекающей беременностью (группа II) была выше относительная представленность микроорганизмов рода Pediococcus – 0,015 (0;0,11) по сравнению с беременными с ПРПО до 28 недель (группа I) – 0 (0;0), p=0,004.
Микроорганизмами, чья относительная представленность была выше у беременных с ПРПО до 28 недель (группа I), были: анаэробные бактерии родов Prevotella, Prevotella 6, Peptostreptococcus, Peptoniphilus, Anaerococcus, а также Fusobacterium, Parvimonas, Lawsonella, Sutterella, Mobiluncus, Thermus (табл. 2). Обращает внимание очень малая относительная представленность всех родов микроорганизмов в микробиоме влагалища, за исключением микроорганизмов рода Lactobacillus.
Анализ соотношения частот встречаемости (табл. 3) в микробиоме влагалища также показал статистически значимо более низкую встречаемость бактерий рода Pediococcus у беременных с ПРПО по сравнению с женщинами во II группе (физиологическое течение беременности), р=0,002.
Выше у беременных с ПРПО оказалась частота встречаемости только бактерий рода Prevotella, Anaerococcus, Peptoniphilus, Parvimonas, Lawsonella, Sutterella, Mobiluncus и Thermus (табл. 3). В частности, микроорганизмы рода Prevotella были обнаружены во всех образцах женщин с ПРПО (100%), в контрольной группе бактерии рода Prevotella были выявлены у 64,1% (18), р=0,001. Были идентифицированы также четыре дополнительные группы последовательностей на уровне рода, которым были присвоены уникальные обозначения: Prevotella 2, Prevotella 6, Prevotella 7 и Prevotella 9. Среди них статистически значимые различия были отмечены по Prevotella 6, которая обнаружена у 6 женщин с ПРПО, но не обнаружена в группе II, р=0,01. Также в I группе достаточно часто встречались бактерии рода Peptoniphilus (р=0,01) и Anaerococcus (р=0,04). Остальные микроорганизмы (бактерии рода Parvimonas, Lawsonella, Sutterella), по которым между группами имелись статистически значимые различия, наблюдались реже и обнаружены только в группе I (табл. 3).
Безводный период варьировал от 49 до 162 ч и в среднем составил 97 ч (4 суток). Корреляционной зависимости между длительностью безводного периода и бактериями выделенных родов уставлено не было. Показаниями для родоразрешения в основной группе были: развитие регулярной родовой деятельности – 66,7% (n=18), ангидрамнион – 22,2% (n=6), хориоамнионит – 11,1% (n=3). Через естественные родовые пути родоразрешены 18 (66,6%) женщин, путем кесарева сечения – 9 (33,3%).
Обсуждение
Несмотря на то что микробиом влагалища является одной из самых изученных тем, благодаря доступности данного биотопа человеческого организма для забора материала характеристика микробиома влагалища именно у беременных с ПРПО и в течение латентного периода до наступления родовой деятельности представляет собой практически не изученную область знаний.
Результат нашего исследования показал низкую относительную представленность бактерий рода Lactobacillus в микробиоме женщин с ПРПО по сравнению с пациентками с физиологическим течением беременности. Снижение количества лактобактерий, создающих кислую среду (pH<4,5), наряду со многими другими факторами, играет ключевую роль в дестабилизации влагалищного сообщества. С одной стороны, выявленные нами изменения могут быть связаны с воздействием постоянно подтекающих околоплодных вод, которые благодаря своей щелочной среде вымывают физически и подавляют химически рост бактерий рода Lactobacillus [2, 4]. После снижения количества лактобактерий условно-патогенные микроорганизмы занимают доступную нишу, что ведет к дисбактериозу на фоне ПРПО. С другой стороны, подобное состояние может являться следствием бактериального вагиноза, предшествовавшего разрыву оболочек. В том или ином случае, процессы, происходящие после начала подтекания околоплодных вод, имеют потенциально негативные последствия.
Немаловажно упомянуть, что простое доминирование лактобактерий в составе вагинального микробиома не дает гарантии благоприятного перинатального исхода. По данным нашего исследования выявлено, что у беременных с ПРПО преобладали L. iners. А во II группе чаще наблюдались L. crispatus, L. acidophilus, L. jensenii, L. gasseri, что аналогично данным, полученным З.С. Ходжаевой и соавт. [9]. Имеются данные о связи L. iners как с нормальным состоянием микробиома, так и с дисбиозом, а также с нахождением микробиома в переходном состоянии: либо от нормального к дисбиозу, либо наоборот [2, 10]. Подобные ассоциации подтверждаются также нахождением L. iners в доминирующем состоянии у женщин со спонтанными преждевременными родами [3]. В противоположность L. iners, доминирование L. crispatus чаще наблюдается при родах в срок [4].
Наряду с разницей в содержании лактобактерий, у беременных с ПРПО не были обнаружены бактерии рода Pediococcus в отличие от беременных II группы. Это род грамположительных молочнокислых бактерий, относящихся к семейству Lactobacillaceae. Благодаря выделению педиоцина и бактериоцина они обладают антимикробными и пробиотическими свойствами [11, 12], таким образом способствуя успешному завершению беременности.
Особый интерес представляет преобладание в микробиоме женщин с ПРПО анаэробных бактерий, которые были описаны как условно-патогенные микроорганизмы, способные вызвать дисбиоз влагалища [13]. В частности, самыми распространенными микроорганизмами в I группе были бактерии рода Prevotella. Более мелкое деление данного рода на группы (Prevotella 2, Prevotella 6, Prevotella 7 и Prevotella 9), аналогично ранее выполненным исследованиям [14], позволило выявить различия в содержании бактерий рода Prevotella 6. Имеющиеся данные литературы также указывают на весьма вероятную роль Prevotella в этиологии ПРПО: известна ассоциация Prevotella с бактериальным вагинозом и преждевременными родами [5]. Учитывая предполагаемую роль данного рода в синергетических отношениях с микроорганизмами, ассоциированными с бактериальным вагинозом, а также продуцирование ими липополисахаридов во влагалищной среде, распространенность и разнообразие бактерий рода Prevotella в микробиоме беременных с ПРПО, несомненно, требует отдельного углубленного изучения.
Как и Prevotella, бактерии рода Peptostreptococcus рассматриваются как клинически значимые анаэробные кокки. Единственным представителем бактерий этого рода в нашем исследовании был вид Peptostreptococcus anaerobius. Согласно имеющимся данным, именно Peptostreptococcus anaerobius, обнаруженный как во влагалищных, так и в плацентарных образцах беременных женщин, ассоциировался с более неблагоприятными исходами и низкими росто-весовыми показателями новорожденных [15]. Стоит отметить, что некоторые виды бактерий рода Peptostreptococcus сейчас выделены в отдельную группу и относятся к роду Peptoniphilus и к роду Anaerococcus. Но аналогичные бактериям рода Peptostreptococcus ассоциации с неблагоприятным течением беременности сохраняются [14], что согласуется с результатами нашего исследования.
Также интерес для изучения представляют бактерии из нетипичных для репродуктивной системы областей (бактерии рода Fusobacterium, Parvimonas, Lawsonella). Основным местом обитания бактерий рода Fusobacterium является желудочно-кишечный тракт, включая ротовую полость и пародонт. Благодаря изучению микробиома человека, F. nucleatum был обнаружен в тканях плаценты и плода, в том числе в амниотической жидкости [16], пуповинной крови [17] и в желудочных аспиратах новорожденных [18] у женщин, чья беременность осложнилась как преждевременными родами без разрыва оболочек, так и ПРПО. Штаммы F. nucleatum, идентифицированные в околоплодных водах и плаценте, соответствуют штаммам из ротовой полости, а не нижних половых путей, что подтверждает причастность оральных факультативных видов, таких как F. nucleatum, к неблагоприятным исходам беременности благодаря гематогенному пути распространения микроорганизмов [19].
Другими представителями нетипичной области, обнаруженными в репродуктивных путях, стали бактерии рода Parvimonas и Lawsonella. Единственным представителем бактерий рода Parvimonas в нашем исследовании был вид Parvimonas micra, а бактерий рода Lawsonella – вид Lawsonella clevelandensis. Как один из обитателей зубного налета вид Parvimonas micra у пациентов с хроническим периодонтитом был обнаружен при бактериальном вагинозе [20] и хориоамнионите [21]. Вид Lawsonella clevelandensis, который, по данным литературы, также идентифицирован как часть микробиоты полости рта, редко ассоциируется с человеческими инфекциями [22]. Однако в литературе зафиксировано 8 случаев осложненного инфицирования этим микроорганизмом [23].
Среди представителей анаэробных микроорганизмов в нашем исследовании было отмечено также присутствие бактерий рода Sutterella в I группе. Данных о связи бактерий рода Sutterella с неблагоприятным течением и исходами беременности в литературе найдено не было [24]. Однако наблюдается повышение их концентрации во влагалище и цервикальном канале при инфекциях, передающихся половым путем [25]. Роль этого микроорганизма в генезе неблагоприятных исходов еще предстоит изучить подробнее.
Стоит также прокомментировать обнаружение бактерий рода Mobiluncus и Thermus в I группе. Каждый из микроорганизмов был представлен только одним видом: Mobiluncus curtisii и Thermus scotoductus соответственно. Точная роль данных бактерий в патогенезе дисбиозов и других осложнений беременности не установлена. Наблюдается доминирование Mobiluncus во влагалище у беременных женщин с бессимптомным течением бактериального вагиноза [26], у беременных с преждевременными родами [27]. Бактерии рода Thermus наблюдались как одни из доминирующих микроорганизмов в децидуальном микробиоме при физиологической беременности [28], однако связь с возможными осложнениями изучена не была.
Заключение
Дефицит лактобактерий и доминирование анаэробных микроорганизмов после излития околоплодных вод, выявленные в процессе секвенирования, а также большее биологическое разнообразие видов в микробиоме влагалища по сравнению со здоровыми женщинами, подчеркивает выраженный дисбиоз с высокой индивидуальной изменчивостью у пациенток с неблагоприятными перинатальными исходами. Несомненно, для дальнейшего изучения с помощью секвенирования представляют значимый интерес особенности вагинального микробиома у пациенток перед наступлением ПРПО, поскольку сдвиги микробного пейзажа влагалища могут быть расценены как одна из непосредственных причин наступления преждевременных родов.



