Патология эндометрия как причина повторных нарушений имплантации при привычном невынашивании беременности (ПНБ) и после переносов эмбрионов в протоколах ЭКО остается предметом пристального изучения. ПНБ – важная медико-социальная проблема, влияющая на качество жизни женщин репродуктивного возраста, являясь мультифакториальным полиэтиологичным состоянием, обусловленным целым рядом генетических, иммунологических, эндокринных причин, нарушениями свертывающей системы крови и т.д. Однако существенный вклад в генез ПНБ вносит и патология эндометрия, в том числе те патогенные микроорганизмы, которые его населяют, приводя к развитию патологического процесса.
Изучение профиля микробного сообщества эндометрия издавна считалось непростой задачей: традиционные культуральные методики позволяют выявить только 1–2% имеющихся микроорганизмов [1–3]. Появление методики секвенирования нового поколения позволило преодолеть сразу две слабые стороны культурального метода: наличие некультивируемых микроорганизмов и их большое генетическое биоразнообразие [4]. Все имеющиеся на сегодняшний день данные о составе микробного ландшафта эндометрия предполагают его связь с репродуктивными исходами при вспомогательной репродукции и с различными гинекологическими патологиями, такими как хронический эндометрит (ХЭ), эндометриоз, дисфункциональное маточное кровотечение, полипы эндометрия и рак или гиперплазия эндометрия [5–7]. Тем не менее причинно-следственную связь трудно доказать, поскольку репродуктивный тракт представляет собой полимикробную нишу, и неясно, является ли дисбиоз в матке причиной или следствием патологии.
На сегодняшний день концепция «стерильной матки» подвергается непрерывным дебатам [8]. Если бактерии или их частицы присутствуют в полости матки, их роль даже до наступления факта беременности в поддержании маточного гомеостаза не может быть переоценена и, безусловно, заслуживает внимания.
Эндометрий представляет собой уникальную ткань, подвергающуюся ежемесячным циклическим изменениям, проявляющимся в виде менструации, пролиферации, секреции и децидуализации под воздействием стероидных гормонов яичников. Эндометрий содержит в себе огромное количество иммунокомпетентных клеток, натуральных киллеров (NK-клеток), макрофагов, T-клеток и нейтрофилов, чьи процентные соотношения и плотность распределения варьируют в течение цикла. Цикло-зависимые изменения в субпопуляциях лейкоцитов и их медиаторов, по всей вероятности, играют крайне важную роль в процессах имплантации. И, наоборот, продуцирующие антитела В-лимфоциты и плазмоциты редко можно обнаружить в ткани эндометрия. Известно, что бактерии оказывают влияние на иммунную систему [9]. Если бактерии оказывают влияние на локальный иммунный статус в эндометрии еще до наступления беременности, то, соответственно, они способны влиять на рецептивность эндометрия, равно как и на раннюю плацентацию. Успешная имплантация оплодотворенной яйцеклетки требует одновременно трансформации эндометрия и сложного взаимодействия между бластоцистой и трансформированным эндометрием. Эти процессы во многом зависят от рецептивной функции эндометрия. Если эндометрий не претерпевает необходимых трансформаций для достижения высокорецептивного состояния на протяжении менструального цикла, то происходят нарушение имплантации и даже бесплодие, как последствие. Поскольку бактерии играют роль в морфологических изменениях, например, в клетках слизистой оболочки, можно предположить, что они оказывают прямое влияние на процессы децидуализации. В то же время резидентная микрофлора, являющаяся нормальной для данного биотопа, способна обеспечивать защиту от патогенных микроорганизмов, тем самым способствуя нормальному функционированию эндометрия.
На сегодняшний день опубликовано не так много исследований, посвященных изучению микробиома эндометрия и фертильности, особенно во взаимосвязи с маркерами ХЭ [10, 11]. Помимо стандартных гистологических критериев ХЭ (лимфоцитарная инфильтрация функционального и базального слоев эндометрия, присутствие плазматических клеток, фиброз стромы, склеротические изменения в спиральных артериях, очаговая гиперплазия базального слоя, деформация желез), существует золотой стандарт иммуногистохимической диагностики ХЭ: основным маркером плазмоцитов, зрелых тканевых В-лимфоцитов, служит наличие CD138, или синдекана-1, который представляет собой белок межклеточного матрикса. Перспективным также является изучение хемокина CXCL13, который является селективным В-лимфоцитарным хемоаттрактантом и участвует в иммиграции В-лимфоцитов в эндометрий.
Остается недостаточно ясным, какие именно бактерии могут быть причастными к развитию воспалительного процесса в эндометрии за исключением абсолютных патогенов и как корректировать эти дисбиотические состояния. Во многом мы можем использовать знания о кишечной микробиоте и представления о ее коррекции как о подходе к лечению различных заболеваний желудочно-кишечного тракта и нормализации локального иммунного ответа и экстраполировать эти знания на лечение дисбиоза эндометрия.
Цель настоящего исследования: выявить роды микроорганизмов, населяющие здоровый эндометрий и эндометрий при ПНБ, а также выявить роды микроорганизмов в составе маточного микробиома, которые могут быть ответственными за развитие ХЭ.
Материалы и методы
В исследование были включены 29 женщин, разделенных на 2 группы. Малая численность групп обоснована внешними ограничениями, необходимостью тщательного отбора пациенток с ПНБ, исключающего все другие причины невынашивания, кроме эндометрита. Все пациенты были обследованы на базе кафедры акушерства и гинекологии №1 ФГБОУ ВО РостГМУ Минздрава России (Ростов-на-Дону, Россия). В 1-ю группу вошли 14 женщин с ПНБ (2 и более потери) в сроке до 12 недель, возраст – от 20 до 42 лет. Критериями исключения были: любая патология матки, в том числе врожденные аномалии развития, миомы, полипы, внутриматочные синехии, внутриматочные манипуляции в течение последних 6 месяцев, присутствие внутриматочной спирали в течение последних 6 месяцев, любое системное воспалительное заболевание или тяжелая экстрагенитальная патология, применение системной антибактериальной терапии в последние 3 месяца. При этом всем пациенткам было проведено молекулярное кариотипирование абортивного материала с целью исключения генетических факторов невынашивания; все абортированные эмбрионы имели нормальный хромосомный набор (медико-генетический центр «Геномед», молекулярное кариотипирование абортивного материала «Оптима»). Также из исследования исключены женщины с врожденными и приобретенными тромбофилиями, с эндокринными заболеваниями, нарушением менструального цикла, наличием инфекций, передающихся половым путем, подтвержденных полимеразной цепной реакцией (ПЦР). Во 2-ю группу включены 15 здоровых женщин от 20 до 42 лет без каких-либо жалоб, без отягощенного акушерско-гинекологического анамнеза, имевших хотя бы одни роды через естественные родовые пути в анамнезе. Критериями исключения, помимо критериев для 1-й группы, также были хирургические аборты, самопроизвольные аборты, неразвивающиеся беременности, выскабливания стенок полости матки в послеродовом периоде, кесарево сечение в анамнезе.
Информированное добровольное согласие на исследование подписала каждая участница. Локальный этический комитет ФГБОУ ВО РостГМУ Минздрава России одобрил проведение настоящего исследования.
Забор образцов
Забор образцов для исследования осуществлялся в лютеиновую фазу менструального цикла с 22-го по 24-й день. Поскольку основным недостатком забора материала для исследования микробиома, влияющим на качество полученных образцов, является возможная контаминация микрофлорой влагалища и цервикального канала, для забора использовался катетер для переноса эмбриона в полость матки, состоящий из внешней твердой и внутренней мягкой части [12, 13]. После визуализации шейки матки в зеркалах стерильным марлевым тампоном, смоченным раствором хлоргексидина, удалялась слизь с поверхности шейки матки и обрабатывалась шейка [12, 13]. Катетер для переноса эмбрионов в полость матки аккуратно вводился в цервикальный канал, не касаясь стенок влагалища, при этом внутренняя мягкая часть катетера была помещена в наружную полностью, что позволяло избежать контаминации бактериями цервикального канала. После попадания в полость матки внутренний катетер аккуратно выдвигался из внешнего до области дна матки, производился забор материала для исследования микробиома из дна матки, после чего внутренний катетер снова помещался в пространство наружного, и вся система удалялась из цервикального канала и влагалища. Образец эндометриальной флоры помещался в пробирку Эппендорфа со специальной транспортной средой – «транспортная среда с муколитиком» (ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва, Россия), среда сохранялась при температуре +4°C до выделения генетического материала.
После забора микробиома только женщинам 1-й группы с ПНБ в анамнезе производилась стандартная пайпель-биопсия эндометрия с помощью аспирационного зонда «Юнона» Classic. Аспирационный зонд аккуратно вводился через цервикальный канал в полость матки до ее дна, внутренний поршень извлекался наружу для создания отрицательного давления. Вращательными движениями зонд медленно извлекался из полости матки для получения кусочков ткани эндометрия через небольшие отверстия, расположенные на кончике самого катетера. Полученная при биопсии ткань эндометрия помещалась в 10% нейтральный забуференный раствор формалина для фиксации при комнатной температуре и впоследствии заливалась парафином для гистопатологического исследования. Проводились гистологическое и иммуногистохимическое исследования на наличие маркеров CD138 и CXCL13.
Суммарную ДНК выделяли с использованием набора «Рибо-преп» (ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора, Россия) по протоколу производителя.
Библиотеки фрагментов гена 16S рРНК готовили по протоколу компании «Иллюмина» 16S Metagenomic Sequencing Library Preparation (Part № 15044223 Rev. B). 5 нг суммарной ДНК амплифицировали в течение 25 циклов с использованием рекомендованных в протоколе праймеров к участкам V3 и V4 гена 16S рРНК бактерий и готовой смеси для ПЦР KAPA HiFi HotStart ReadyMix (2X) (Roche Diagnostics, Швейцария). Полученные фрагменты ДНК очищали с использованием парамагнитных частиц AMPure XP beads (Beckman Coulter, США). Для проведения индексирующей ПЦР 5 нг ДНК после первого раунда амплификации подвергали 8 циклам амплификации с использованием биркодированных праймеров из набора Nextera XT Index Kit (Illumina, США) и готовой смеси для ПЦР KAPA HiFi HotStart ReadyMix (2X) (Roche Diagnostics, Швейцария). Полученные библиотеки очищали с помощью парамагнитных частиц, пулировали в эквимолярном соотношении и секвенировали на приборе MiSeq System (Illumina, США) в режиме парноконцевого секвенирования 2*151.
Анализ данных, полученных в ходе секвенирования библиотек, проводили с помощью собственного пайплайна, реализованного на языках программирования R v.3.6 (R Core Team, 2014) и Python. На первом этапе пайплайна удаляли последовательности праймеров с начала прочтений. Прочтения, которые не содержали праймеров, также удаляли. Далее удаляли по 25 последних нуклеотидов прочтений как имеющие низкое качество и обрабатывали полученные данные, используя протокол DADA2 для детекции точных вариантов последовательностей [14]. После определения точных вариантов последовательностей объединялись прямые и обратные прочтения конкатенацией и использовались полученные последовательности для байесовской таксономической классификации [15], используя референсную базу данных SILVA v132 [16]. Видовое определение проводили с использованием алгоритма полного соответствия в DADA2 с использованием последовательностей базы данных SILVA v132, предварительно процессированных с помощью собственных скриптов для соответствия анализу.
Статистический анализ
Проверка данных на подчиненность нормальному закону распределения осуществлялась с помощью критерия Шапиро–Уилка. Все показатели, за исключением возраста, показали статистически значимое (р<0,05) отклонение от нормального закона распределения.
Описательные статистики для количественных данных представлены в виде медианы и интерквартильного интервала Me (Q1;Q3). Содержание бактерий оценивалось в долях от общего микробиома. Качественные данные описаны с помощью абсолютных и относительных величин: n (%).
Для сравнения групп пациенток по всем показателям, а также для определения наличия связи между количественными концентрациями бактерий и бинарными показателями наличия/отсутствия иммуногистохимических маркеров использовался непараметрический тест Манна–Уитни. Различия признавались статистически значимыми на уровне р<0,05. Расчеты выполнялись в R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria).
Результаты
Клинико-демографические характеристики пациенток обеих групп представлены в таблице 1. Пациентки обеих групп были сопоставимы по индексу массы тела, возрасту менархе, продолжительности менструального цикла и продолжительности самой менструации, возрасту. Эти показатели были нормально распределены в обеих группах.
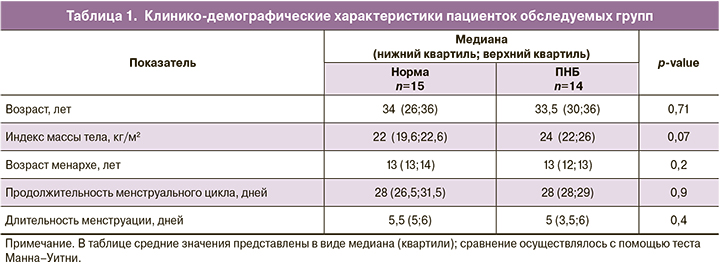
Исследование микробиома эндометрия путем секвенирования позволило выявить микроорганизмы, относящиеся в общей сложности по таксономической классификации к 19 типам, 32 классам, 107 семействам, 241 роду и 288 различным видам. Относительная представленность бактерий различных родов у всех пациенток представлена на рисунке 1. Такое большое биологическое разнообразие родов и видов обусловлено, с одной стороны, высокой точностью методики секвенирования, с другой – возможной контаминацией в процессе сбора биоматериала и секвенирования, о чем будет сказано далее. Сравнение между группами проводилось на таксономическом уровне родов.
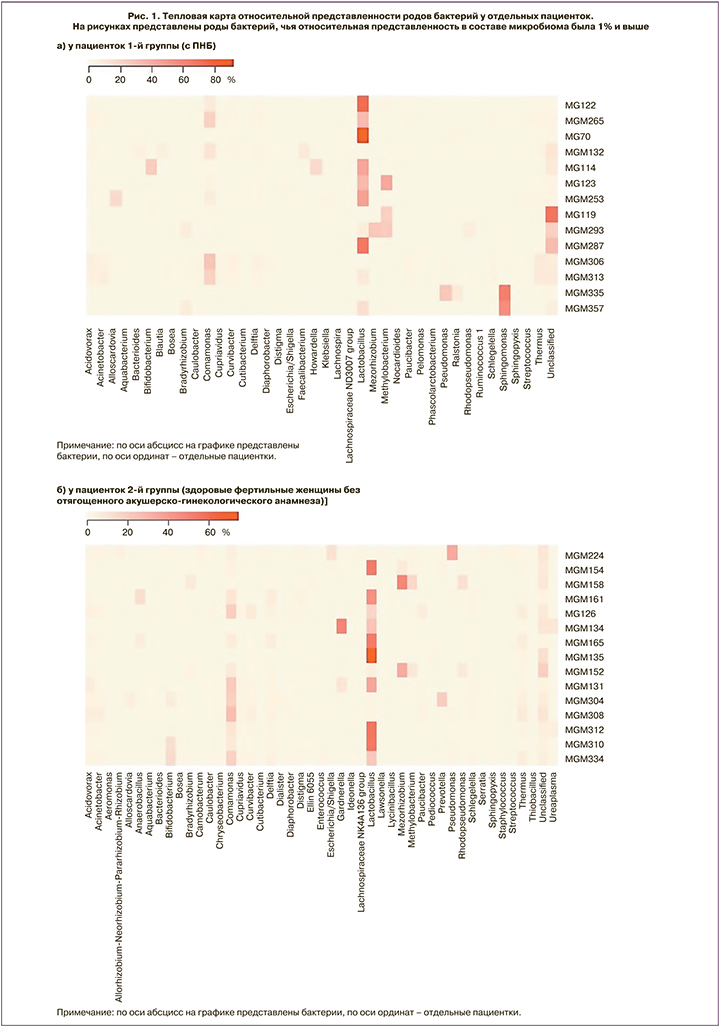
При анализе средней относительной представленности родов бактерий в микробиоме эндометрия всех женщин 1-й и 2-й групп самым часто встречающимся родом в обеих группах был род Lactobacillus. При этом на диаграмме размаха (рис. 2) для средней относительной представленности бактерий рода Lactobacillus в составе маточного микробиома видно, что значимых различий между двумя группами по этому показателю не было, медианы этого показателя в обеих группах практически идентичны.
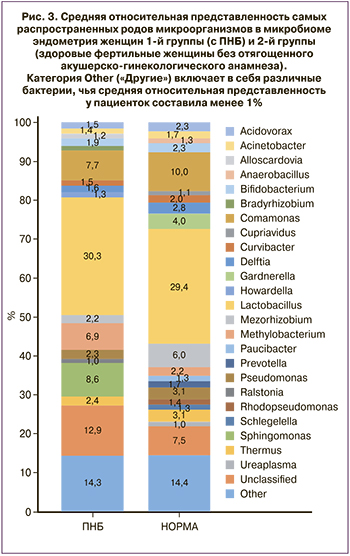
У женщин с ПНБ самыми представленными были роды Lactobacillus – 30,3%, Comamonas – 7,7%, Sphingomonas – 8,6%, в группе здоровых фертильных пациенток самыми представленными были роды Lactobacillus – 29,4%, Comamonas – 16,8% и Mesorhizobium – 6,0% (рис. 3). При этом статистическое сравнение долей лактобактерий между двумя группами не выявило статистически значимых различий (медианы и интерквартильный интервал составили 24 (1,48;46,5)% и 23,3 (3,7;53,4)% соответственно, p=0,99). Кроме того, нельзя говорить об абсолютном доминировании лактобактерий в составе маточного микробиома в процентном соотношении более 90%, как показано в других исследованиях [17].
При сравнении относительной представленности родов микроорганизмов в группах были обнаружены статистически значимые отличия только в относительной представленности бактерий родов Brevibacillus и Corynebacterium 1: в группе здоровых фертильных женщин относительная представленность Brevibacillus была выше и составила 0,11 (0;0,3)%, в группе женщин с ПНБ – 0 (0;0)% (p=0,008); в группе здоровых фертильных женщин относительная представленность Corynebacterium 1 была меньше и составила 0 (0;0)%, в группе женщин с ПНБ – 0,07 (0;0,13)% (p=0,02). Однако нельзя не отметить, что эти роды микроорганизмов, по которым были обнаружены статистически значимые отличия, составляли менее 1% маточного микробиома относительно других микроорганизмов, поэтому сложно говорить о клинической значимости выявленных различий между группами. Более того, присутствие этих бактерий может косвенно говорить о контаминации на любом из этапов забора материала и секвенирования.
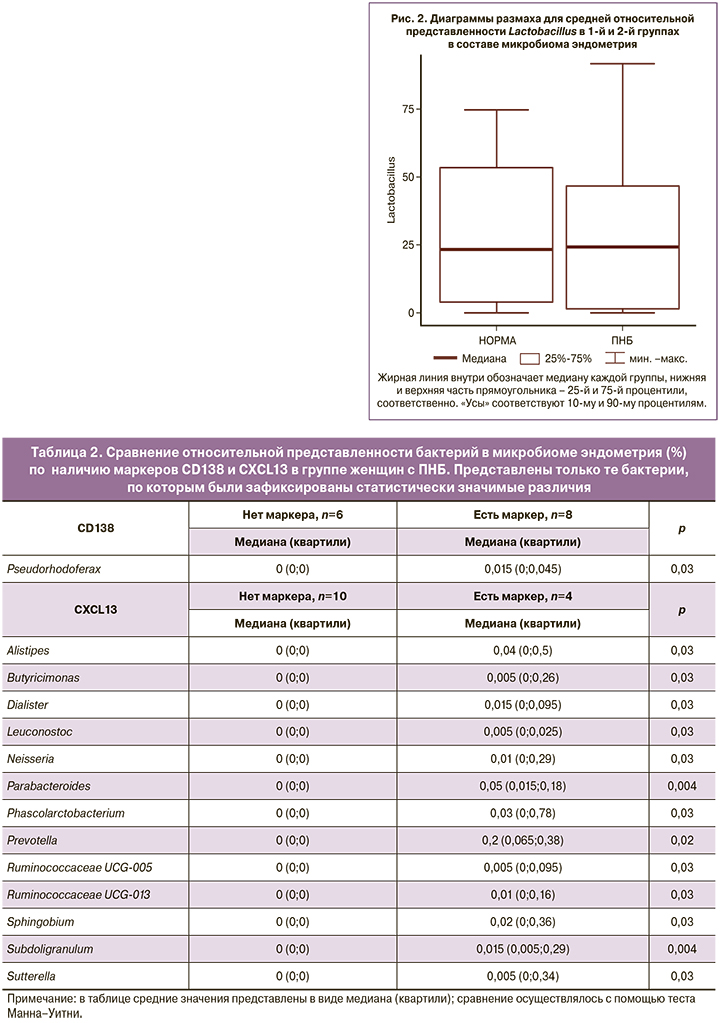
Помимо этого, пациенткам с ПНБ проводилось гистологическое и иммуногистохимическое исследования биоптатов эндометрия (маркеры CD138 и CXCL13) (табл. 2).
Оценивалась плотность плазматических клеток – диагноз ХЭ выставлялся при плотности плазматических клеток более 5 на 10 мм². Диагноз ХЭ, согласно этим критериям, был поставлен 8 (57%) из 14 пациенток. Выявлена положительная ассоциация присутствия маркера ХЭ CD138 с высокой относительной представленностью в составе маточного микробиома только бактерий рода Pseudorhodoferax (0 (0;0)% у женщин с отрицательным маркером CD138 и 0,015 (0;0,045)% с положительным, p=0,03). По другим родам микроорганизмов статистически значимой связи обнаружено не было. Однако относительная представленность этого рода бактерий была очень мала – менее 1%, в связи с чем клиническая значимость этой корреляции остается сомнительной. При этом для бактерии рода Pseudorhodoferax человеческий организм не является привычной средой обитания; естественным ареалом является почва, поэтому можно предполагать, что их присутствие может являться следствием контаминации на любом из этапов исследования.
Маркер CXCL13 не является золотым стандартом диагностики ХЭ в отличие от маркера CD138. Однако, являясь селективным хемоаттрактантом В-лимфоцитов, он может использоваться, как вспомогательный параметр для диагностики ХЭ. Маркер CXCL13 был выявлен у 4 (29%) из всех 14 женщин с ПНБ. Кроме того, эти же 4 пациентки имели положительный маркер CD138 (то есть у 4/14 пациенток с ПНБ были выявлены оба маркера ХЭ).
Был проведен анализ ассоциации наличия маркера CXCL13 с присутствием различных родов бактерий у пациенток путем сравнения относительной представленности данных бактерий в группах по наличию маркера. Было показано, что с наличием маркера CXCL13 ассоциирована повышенная представленность бактерий родов Alistipes (p=0,03), Butyricimonas (p=0,03), Dialister (p=0,03), Leuconostoc (p=0,03), Neisseria (p=0,03), Parabacteroides (p=0,004), Phascolarctobacterium (p=0,03), Prevotella (р=0,02), Ruminococcaceae UCG-005 (p=0,03), Ruminococcaceae UCG-013 (p=0,03), Sutterella (p=0,03), Sphingobium (p=0,03), Subdoligranulum (p=0,004) (табл. 2).
Обсуждение
Секвенирование нового поколения является более точным методом диагностики, чем ПЦР, поскольку происходит амплификация генетического материала бактериальных клеток, выявляя огромное разнообразие вагинальной и эндометриальной микробиоты у пациенток с ХЭ. Молекулярная микробиология и метагеномика – это прекрасные диагностические инструменты, позволяющие выявить культивируемые и некультивируемые патогены эндометрия при ХЭ. Новые диагностические методики могут пролить свет на взаимосвязь между хроническим воспалительным процессом и новыми, малоизученными патогенами, не выявляемыми с помощью других методов диагностики.
Прежде чем изучать патологию, важно иметь представление о нормальном микробиоме эндометрия. Данные различных авторов разнятся, и глобально эта разница зависит от способа забора материала из полости матки. Большая часть исследователей используют трансцервикальный способ забора материала, при котором в составе маточного микробиома доминируют лактобактерии, характерные для вагинального микробиома. Например, показано, что доминирование лактобактерий в составе маточного микробиома более 90% является залогом успешной имплантации оплодотворенной яйцеклетки, успешного вынашивания беременности и живорождения [17] у пациенток с применением вспомогательных репродуктивных технологий. Однако, по данным других исследователей, изучавших микробиом эндометрия при органоуносящих операциях, относительная представленность лактобактерий не превышала 45% [18–21]. Кроме того, биологическое разнообразие при трансцервикальном и трансабдоминальном доступах забора разнятся; количество выделенных бактерий при трансцервикальном способе забора, очевидно, больше. Таким образом, можно предположить, что при физиологической норме в маточном микробиоме доминируют лактобактерии, что подтверждается и нашими данными.
До сих пор остается неясным, является нарушенный маточный микробиом причиной или следствием гинекологических нозологий. Многочисленные исследования показали, что при изучении микробиоты эндометрия одинаково важно идентифицировать патогенные микроорганизмы, приводящие к развитию патологического процесса, и выделить резидентную микрофлору, способствующую состоянию гомеостаза и здоровья. Измененный микробиом эндометрия может служить предиктором болезни и приводить к нарушениям имплантации и неблагоприятным репродуктивным исходам [22–24].
Так или иначе, у секвенирования есть очевидные негативные стороны – остается не до конца ясным, что делать с полученными результатами исследования, ведь секвенирование не отвечает на вопрос о чувствительности выявленной микробиоты к той или иной антибактериальной терапии, а также о том, живые это микроорганизмы или же просто генетический материал давно погибшей бактерии, не имеющий клинического значения. Одновременный анализ и микробиоты эндометрия путем секвенирования, и маркеров ХЭ позволяет приблизить этот современный метод диагностики к клиницистам, использовать его как новый перспективный инструмент в подготовке эндометрия к успешной беременности.
У исследования есть ряд ограничений. Во-первых, это небольшой объем выборки. 29 женщин обеих групп, безусловно, нельзя экстраполировать на большой объем пациентов, но такой малый объем объясняется тщательным подходом к группе женщин с ПНБ, попыткой исключить другие причины невынашивания, кроме инфекционного фактора. Кроме того, для объективизации данных результатов секвенирования немаловажно иметь на каждый образец среды несколько контрольных образцов: воздуха операционной, транспортной среды и т.д., с целью исключения фактора контаминации микроорганизмами не из эндометрия. Третье ограничение исследования все же заключается в способе забора материала – это трансцервикальный доступ, который полностью не исключает возможной контаминации микрофлорой цервикального канала и влагалища, несмотря на использование специальных двухходовых катетеров и обработки антисептиками. Трансабдоминальный способ, подразумевающий забор материала после экстирпации или надвлагалищной ампутации матки, считается более совершенным в плане исключения возможной контаминации, однако эти операции никогда не происходят без абсолютных показаний – миома, рак эндометрия и т.д. Кроме того, сами по себе патологические состояния (полипоз, злокачественные процессы) матки могут изменять микробный состав эндометрия.
Доминирование лактобактерий в составе маточной микробиоты очевидно является показателем здорового эндометрия, поскольку их протективное действие против патогенов доказало свою эффективность на примере влагалищной микробиоты. По данным нашего исследования, в обеих группах обнаружено доминирование лактобактерий, однако их относительная представленность составила менее 90%, что показано и другими авторами [17]. Тем не менее наши данные подтверждают большинство исследований о том, что лактобактерии являются преобладающим родом в эндометрии.
В группе женщин с ПНБ статистически значимо ниже была концентрация бактерий рода Brevibacillus и больше концентрация бактерий рода Corynebacterium 1. Однако при интерпретации этих данных обращает на себя внимание факт крайне низкой относительной представленности родов микроорганизмов, по которым обнаружены статистически значимые отличия, – менее 1% общей биомассы. В связи с такой низкой относительной представленностью этих микроорганизмов едва ли можно придавать клиническую значимость полученным различиям.
Нельзя не отметить, что, по данным ряда исследований [25–28], при исследовании микробиома тех биотопов, которые ранее традиционно считались стерильными, число циклов амплификации бактериальной ДНК было практически идентично числу циклов амплификации при исследовании микробиома стерильной воды, воздуха операционной или других стерильных сред, что говорит о возможной контаминации образцов. Так, при обсуждении известной публикации Aagaard K. о наличии плацентарного микробиома [29–31], нельзя не сказать, что выделенные бактерии родов Thioalkalivibrio, Pseudoalteromonas, Gloebacter, Arthrobacter являются нормальными обитателями почвы, воды озер, болот и морской воды, что может косвенно свидетельствовать о загрязнении на любом этапе анализа. То же можно сказать и о полученных нами данных. Многие роды бактерий, обнаруженные в микробиоме эндометрия наших пациенток, являются характерными для других экологических ниш – почвы, болот, озер, промышленных объектов, что косвенно подтверждает возможность контаминации образцов.
При оценке ассоциации маркера ХЭ CD138 с присутствием тех или иных родов микроорганизмов была обнаружена взаимосвязь верифицированного ХЭ с присутствием бактерий рода Pseudorhodoferax. Эти бактерии не характерны для человеческого организма, это обитатели почв и водоемов. Кроме того, их зарегистрированная относительная представленность также мала. Сложно достоверно утверждать, является ли это признаком загрязнения среды на одном из этапов забора материала или секвенирования или же этот род бактерий все-таки ассоциирован с хроническим воспалительным процессом в эндометрии. Что касается перспективного маркера CXCL13 – хемоаттрактанта плазмоцитов – его наличие ассоциировалось с большим количеством родов бактерий, среди которых Alistipes, Butyricimonas, Dialister, Leuconostoc, Neisseria, Parabacteroides, Phascolarctobacterium, Prevotella, Ruminococcaceae, Sutterella, Sphingobium, Subdoligranulum; многие из них известны клиницистам как потенциальные возбудители ХЭ. Однако сам по себе маркер CXCL13 был верифицирован всего у 4 женщин из 14 с ПНБ; у этих же 4 женщин был выявлен и CD138, являющийся золотым стандартом диагностики ХЭ. Такой малый объем выборки также ограничивает возможности клинической интерпретации полученных данных.
Заключение
В настоящее время уже не вызывают сомнений нестерильность эндометрия и перспективность изучения его микробиома для улучшения репродуктивных исходов. Более 280 различных родов микроорганизмов было выявлено в составе микробиома эндометрия, что, с одной стороны, безусловно, подтверждает факт нестерильности этого биотопа; с другой стороны, такое большое количество выделенных родов может косвенно говорить о потенциальной микробной контаминации на любом из этапов исследования – от забора материала до транспортировки и непосредственно самого секвенирования. Для исключения фактора контаминации крайне важно иметь хотя бы по одному контрольному образцу на каждый из образцов материала конкретной пациентки, что на сегодняшний день все еще увеличивает стоимость исследования из-за высокой стоимости секвенирования.
Основываясь на полученных данных, отмечено, что и у фертильных пациенток, и у пациенток с ПНБ доминирующим родом бактерий в эндометрии являлись лактобактерии, что подтверждает имеющиеся на сегодняшний день публикации. Относительная представленность их среди групп значимо не отличалась. Если относительная представленность лактобактерий была практически идентична, то логично предположить, что присутствие других бактерий в составе маточного микробиома может определять репродуктивные неудачи. Однако достоверные отличия был обнаружены только по родам бактерий Brevibacillus и Corynebacterium 1, чья относительная представленность в эндометрии составила менее 1%, что крайне важно при клинической интерпретации этих данных. Сложно предположить, что бактерии, которых настолько мало в эндометрии, способны влиять на процессы имплантации оплодотворенной яйцеклетки и дальнейшего развития эмбриона.
Не вызывает сомнений, что одновременное изучение маточного микробиома и иммуногистохимических маркеров ХЭ является клинически целесообразным и оправданным, однако и на этом этапе полученные данные являются достаточно спорными. Выявленные роды микроорганизмов, чье присутствие ассоциировалось с маркерами хронического воспалительного процесса в матке, также были верифицированы в достаточно низком количестве; при этом данные роды микроорганизмов чаще характерны для других экологических ниш природы, нежели для организма человека, что косвенно также может свидетельствовать о контаминации образцов и чрезвычайной необходимости иметь контрольные образцы на всех этапах исследования.
Целый ряд ограничений настоящего исследования ставит под сомнение полученные результаты и заставляет задуматься о необходимости его продолжения на большей выборке и в больших масштабах. Однако настоящее исследование может считаться пилотным и быть потенциально полезным для последующих работ в этой тематике.



