Склерозирующий лихен (СЛ) занимает центральное место в структуре заболеваний вульвы, распространенность достигает 62,8% (в отделениях, специализирующихся по заболеваниям вульвы). СЛ – доброкачественное заболевание с периодами обострений и ремиссий, имеет преимущественно генитальное распространение и характеризуется воспалительной очаговой дистрофией кожи и слизистых оболочек, вплоть до их атрофии [1].
Согласно современным представлениям, СЛ следует рассматривать как хроническое аутоиммунное заболевание, ассоциированное с образованием аутоантител к белку внеклеточного матрикса 1 (ECM1), который расположен на стыке эпидермо-дермального слоя [2, 3]. Однако выделяют и другие факторы, способствующие проявлению заболевания: гормональные [4, 5], вирусно-инфекционные [6–9], механические, микроциркуляторные [10–12] и генетические [13, 14]. Как любое аутоиммунное заболевание, СЛ чаще встречается среди женского населения по сравнению с мужским (10:6) [15] и требует длительного комплексного лечения. Цели лечения – уменьшить зуд, жжение и болевой синдром, улучшить трофику и увлажненность тканей, стимулировать неоколлагенез. На втором этапе следует уделить внимание профилактике рецидивов заболевания и гармонизации психологического статуса пациентки. Необходимо отметить, что в отношении пациенток со СЛ вульвы довольно значимым становится «фемининный фактор», включающий страх потери женственности в связи с изменением архитектоники наружных половых органов, снижением женской сексуальной функции, вплоть до отсутствия половой жизни.
Ограничивающим фактором достижения успеха в лечении СЛ вульвы является отсутствие единого мнения об этиопатогенезе заболевания и, соответственно, таргетных методах лечения. Важными критериями при выборе метода лечения являются возраст пациентки, длительность заболевания, локализация поражений, наличие осложнений, таких как сужение/сращение вульварного кольца, затрудненное мочеиспускание. В настоящее время для лечения СЛ вульвы предложены различные терапевтические стратегии (табл. 1).
Глюкокортикостероиды
Глюкокортикостероиды являются препаратами первой линии в лечении СЛ. Предпочтительнее выбирать лекарственное средство в форме мази, чем крема, вследствие лучшего проникновения в глубокие слои кожи и более продолжительного действия. Доза наносимого на всю площадь вульвы локального кортикостероида соответствует 1/3 указательного пальца, что суммарно составляет не более 10 мг в месяц. По данным рандомизированных клинических исследований (РКИ), 0,05% мазь клобетазола пропионата и 0,1% мазь мометазона фуроата показали одинаковую высокую эффективность в купировании симптомов СЛ вульвы при трехмесячной схеме лечения: 1 раз в день в 1-й месяц, через день в течение 2-го месяца и 2 раза в неделю в течение 3-го месяца. В тяжелых случаях 0,05% мазь клобетазола пропионата может применяться 2 раза в день в течение 1 месяца с последующим снижением частоты нанесения препарата [10, 17–19].
В ретроспективном исследовании по оценке эффективности глюкокортикостероидных инъекций (ГКСИ), по сравнению с монотерапией 0,05% мазью клобетазола пропионата, ГКСИ оказались эффективнее в 2,4 раза [20]. Средняя продолжительность курса включает 1 инъекцию в месяц в течение 4 месяцев [21]. Однако в 35,2% случаев между курсами ГКСИ возникает необходимость нанесения локальных кортикостероидов.
 В России из зарегистрированных лекарственных средств для лечения СЛ вульвы наиболее часто применяются сильные и сверхсильные глюкокортикостероиды: клобетазола пропионат, мометазона фуроат, бетаметазон.
В России из зарегистрированных лекарственных средств для лечения СЛ вульвы наиболее часто применяются сильные и сверхсильные глюкокортикостероиды: клобетазола пропионат, мометазона фуроат, бетаметазон.
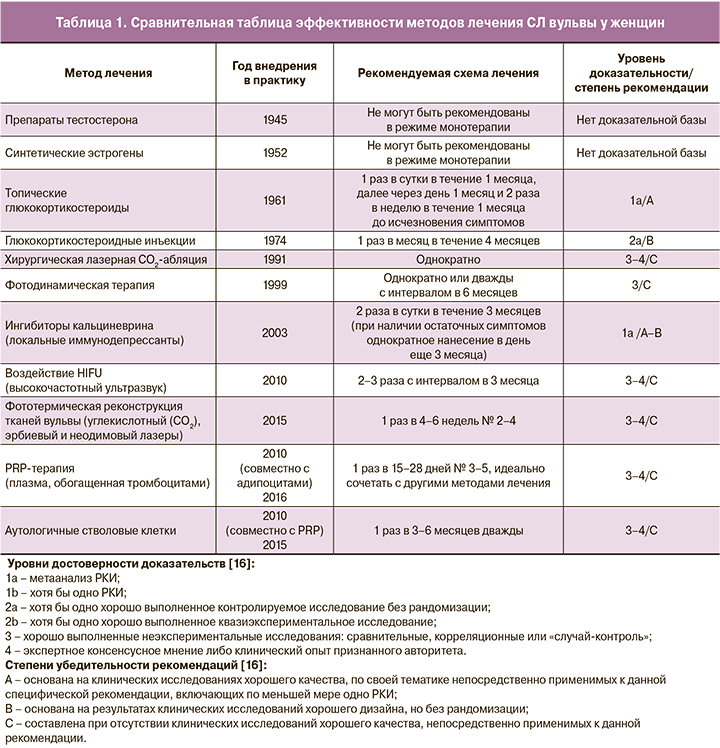
Следует отметить, что частое и продолжительное применение локальных кортикостероидов может приводить к истончению кожи, реакциям рикошета, рубцеванию тканей, реактивации грибковой и папилломавирусной инфекций [22]. Кроме того, локальные кортикостероиды нельзя наносить на слизистые оболочки из-за повышенного риска их атрофии (рис. 1).
Ингибиторы кальциневрина
К препаратам терапии СЛ наружных половых органов второй линии с уровнем доказательности 1а/А–В относятся ингибиторы кальциневрина – топические иммунодепрессанты с противовоспалительным действием (такролимус, пимекролимус). Они применяются 2 раза в сутки в течение 3 месяцев, при необходимости курс может быть продлен до 6 месяцев с уменьшением дозы в виде однократного нанесения [23]. В двойном слепом проспективном РКИ сравнивали эффективность лечения СЛ наружных половых органов 0,05% мазью клобетазола пропионата и 0,1% мазью такролимуса, по итогам которого лучшие результаты показали локальные кортикостероиды. Терапия такролимусом имеет особенности: первичный лечебный эффект появляется отсроченно в течение 12 недель ежедневного применения. Кроме того, в начале терапии ингибиторы кальциневрина провоцируют развитие слабого зуда, переходящего в жжение, однако, в отличие от локальных кортикостероидов, они не способствуют атрофии слизистых и кожи [24].
Локальные эстрогены
Локальные эстрогены являются препаратами выбора в лечении вульвовагинальной атрофии у женщин, проявляющейся сухостью и зудом, рецидивирующими выделениями, диспареунией и контактными кровянистыми выделениями. Hodgins M.B. et al. изучили рецепторный аппарат влагалища и вульвы и обнаружили, что при переходе от влагалища к вульве повышается уровень рецепторов андрогенов и снижается количество эстрогеновых и прогестероновых рецепторов. Данное распределение объясняет ограниченную роль локальной менопаузальной гормонотерапии в лечении дистрофических заболеваний вульвы [25].
По данным ряда авторов, 2% тестостероновая мазь имеет также слабую эффективность в лечении СЛ вульвы, симптомы которого могут даже усиливаться в случае применения препаратов тестостерона после терапии локальными кортикостероидами. В единичных случаях возможны побочные эффекты в виде увеличения клитора, гирсутизма, угревой болезни, вплоть до нарушения менструального цикла [26].
Современные малоинвазивные методы лечения
Бурное развитие медицинских технологий в XX–XXI вв. способствовало поиску новых малоинвазивных способов лечения: инновационные лазерные технологии, высокочастотное воздействие сфокусированным ультразвуком (HIFU), аутоплазмотерапия (PRP), использование аутологичных адипоцитов и мезенхимальных стволовых клеток, мезотерапия и биоревитализация, карбокситерапия. Рассмотрим их подробнее в контексте лечения СЛ наружных половых органов. Необходимо помнить, что только сертифицированный специалист, получивший соответствующую подготовку по работе с PRP-терапией, лазерными, клеточными и иными технологиями, может применять их в своей практике.
Из вышеуказанных методов наиболее высокую эффективность в лечении очагов СЛ показали возможности современного лазерного фототермолиза. Применяют следующие виды лазеров – CO2 (λ=10 600 нм), эрбиевый (λ=2940 нм) и неодимовый (λ=1064 нм) [27–29].
Основным хромофором (молекулой-мишенью) первых двух является вода, даже при крайне низком ее содержании, как у пациенток с дистрофическими заболеваниями вульвы. Основным хромофором неодимового лазерного излучения являются гемоглобин и дезоксигемоглобин. Лазеры могут работать в двух режимах излучения: аблационном и неаблационном. Под лазерной абляцией подразумевают вапоризацию ткани, т.е. активацию термических, механических или фотохимических процессов в ней. В неаблационных режимах на слизистые и кожу оказывается только термическое воздействие без их механического разрушения [30]. Процедура включает 3 сеанса лазерного воздействия, проводимые с интервалом 4–6 недель. Параметры лазерного воздействия выбираются индивидуально, начиная с минимальных, и зависят от места воздействия, клинической цели и используемой лазерной установки (табл. 2а, б) [31, 32].

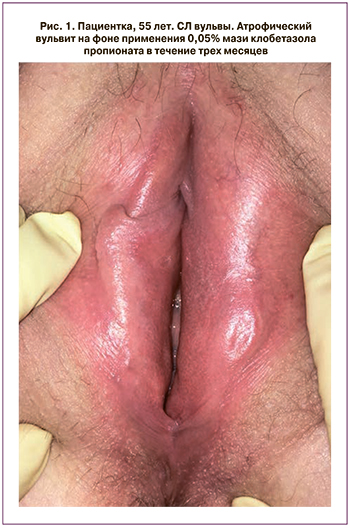
При лечении пациенток с гиперкератическими очагами СЛ наружных половых органов более обоснованно использовать CO2-лазеры в фракционно-абляционных режимах [33]. За счет излучаемой волны длиной в 10 600 нм, CO2-лазеры достигают средних и глубоких слоев дермы, в которых и наблюдаются основные изменения, такие как перестройка и дезорганизация коллагена. По сравнению с неабляционным воздействием CO2-лазеры имеют более выраженный и устойчивый клинический эффект, достигаемый за 1–4 лазерных цикла с интервалом 4–6 недель. При этом фракционный режим уменьшает процент повреждения ткани, защищает ее от избыточного перегревания и необратимой травматизации [34] (табл. 3, рис. 2а, б).
Лазерное воздействие рекомендуется проводить под аппликационной анестезией кремом, содержащим 25 мг лидокаина и 25 мг прилокаина, в дозе 2 г на 10 см2; анестетик наносится на кожу под окклюзионную повязку на 40–60 минут. Важно полностью удалить препарат перед лазерным воздействием, чтобы исключить поглощение лазерного излучения кремом. Воздействию подвергаются все измененные участки слизистых и кожи: от области клитора до перианальной зоны включительно. Рекомендовано начинать терапию с самых минимальных параметров. Если установленные параметры вызывают дискомфорт у пациентки, они снижаются. Лазерное воздействие у женщин в пери- и постменопаузе можно сочетать как с системной, так и с локальной менопаузальной гормональной терапией.
К нежелательным временным побочным эффектам лазерного воздействия можно отнести: эритему, слабую или умеренную болезненность, повышение чувствительности в области обработки. Преимущества фототермической реконструкции тканей перед другими методами лечения СЛ очевидны: минимальное количество противопоказаний и побочных эффектов, удобство в применении, не требуется ежедневный контроль в процессе лечения, происходит комплексное улучшение структуры тканей, заключающееся в увеличении васкуляризации и синтезе коллагена, что приводит к уменьшению зуда, жжения, сухости и диспареунии. Лазерное воздействие может быть рекомендовано пациенткам, резистентным к медикаментозной терапии или имеющим противопоказания к применению локальных кортикостероидов. Однако в силу отсутствия крупномасштабных РКИ, сравнивающих лечение лазером с препаратами первой линии, уровень доказательности лазерного воздействия в лечении очагов СЛ наружных половых органов составляет 3–4/С.
Фотодинамическая терапия
Фотодинамическая терапия (ФДТ) – способ лечения, основанный на деструкции биологических тканей, при котором фотосенсибилизирующее средство (препарат, повышающий чувствительность к свету) наносится на пораженный очаг или вводится внутривенно, с последующим воздействием на вульву лучами определенной длины волны. Наиболее часто применяется фотосенсибилизатор Фотодитазин и 20% мазь 5-аминолевулиновой кислоты. При этом большую эффективность и меньшую болезненность в ходе манипуляции у пациенток с СЛ вульвы показало внутривенное применение фотосенсибилизатора. Так, по данным отечественных исследований, отсутствие рецидивов в течение 12 месяцев отмечалось у 91,3% пациенток после внутривенного введения и у 79,2% – при использовании геля-пенетратора [35, 36].
Высокочастотный ультразвук
Воздействие высокочастотным сфокусированным ультразвуком (HIFU) основано на термическом эффекте «концентрированной» акустической волны сверхвысокой частоты и мощности и эффекте кавитации, благодаря которым возможна сверхточная деструкция патологических образований с минимальным вовлечением здоровых тканей (рис. 3). В 6,5% случаев возможны тяжелые осложнения: пузыри, волдыри, ожоги и нарушения целостности слизистых, что требует строгого соблюдения клинических протоколов. В целом HIFU-воздействие и ФДТ удобны в применении, не требуют постоянного контроля в процессе лечения со стороны пациента и используются в амбулаторных условиях. Однако, по сравнению с другими методами, они имеют более серьезные осложнения и применяются в случае лечения запущенных и агрессивных форм СЛ наружных половых органов, вульварной интраэпителиальной неоплазии II–III степеней [37, 38].

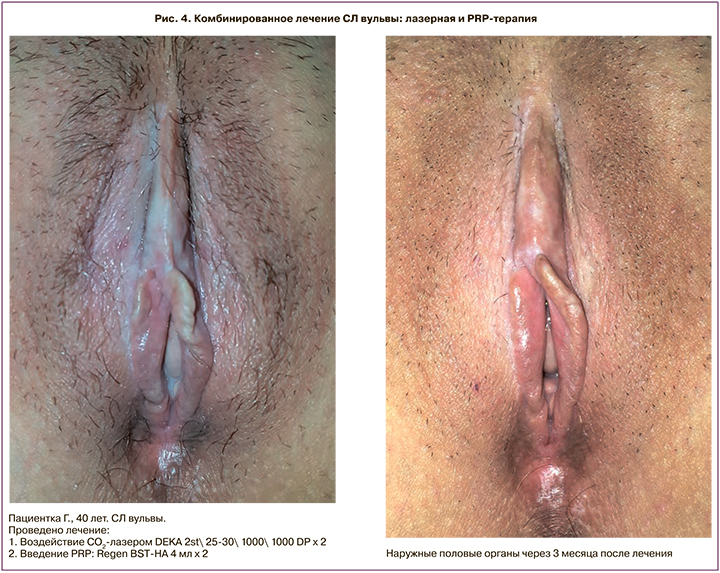
Современным малоинвазивным способом лечения СЛ наружных половых органов является PRP -терапия (platelet rich plasma). PRP – препарат, получаемый из крови пациентки, содержащий аутологичную плазму с повышенной концентрацией тромбоцитов [39]. Механизм действия PRP заключается в высвобождении гранул из тромбоцитов, которые при их разрушении содержат многочисленные факторы роста (VEGF, EGF, PDGF, TGF-β, FGF и пр.), медиаторы воспаления (цито- и хемокины), которые способствуют пролиферации, дифференцировке и миграции клеток, ответственных за ремоделирование тканей. PRP также обладает противомикробной активностью в отношении Escherichia coli, Staphylococcus aureus, в том числе пенициллинрезистентного, Сandida albicans, Cryptococcus neoformans. Эффективность PRP-терапии зависит от вида пробирки, подготовки пациента, способа приготовления и введения препарата PRP. Высокую эффективность PRP-терапия показывает в лечении склеротических очагов, в особенности на слизистых оболочках. Tedesco et al. (2018) отметили клиническое улучшение в 62% после введения PRP в очаги СЛ вульвы, резистентные к терапии локальными кортикостероидами. Наиболее эффективно комбинировать PRP с другими методами: физиотерапевтическое лечение, лазерное воздействие, HIFU и другие [40–42] (рис. 4а, б).
Применение аутологичных стволовых клеток
Впервые в 2010 г. Casabona F. et al. описали применение аутологичных стволовых клеток (АСК) с целью лечения СЛ наружных половых органов [43]. С тех пор опубликовано семь исследовательских работ, свидетельствующих об их эффективности как в режиме монотерапии, так и в сочетании с PRP. Boero et al. в когортном исследовании (n=36) пациенток с подтвержденным биопсией СЛ вульвы, резистентным к локальным кортикостероидам, в 95% отметили клинические улучшения после интрадермального введения АСК, полученных из жировой ткани [44, 45] (рис. 5).

Аутолипофилинг
Аутолипофилинг представляет значительный клинический интерес; однако проведение любых манипуляций с жировой тканью требует наличия в составе врачебной команды пластического хирурга и соблюдения строгих асептических условий, что ограничивает применение данного метода среди гинекологов. Тем не менее, безусловно, клеточные технологии открывают весьма обнадеживающую перспективу в лечении многих болезней, в том числе медленно прогрессирующего СЛ наружных половых органов.
Карбокситерапия
Карбокситерапия – это метод подкожного введения CO2 в лечебных целях. Согласно эффекту Вериго–Бора, повышенные концентрации CO2 вызывают острый воспалительный ответ, сопровождающийся расширением периферических кровеносных сосудов и улучшением локальной микроциркуляции, стимулируют обмен веществ в дерме. Карбокситерапия также способствует миграции фибробластов в область введения газа, что приводит к синтезу главных компонентов межклеточного матрикса – коллагена и эластина [46]. Карбокситерапию в медицинской практике используют более 70 лет, однако для гинекологической области это довольно инновационный метод, эффективность которого еще предстоит доказать в лечении дистрофических заболеваний вульвы.
Заключение
СЛ вульвы представляет собой хроническое рецидивирующее заболевание, основными проявлениями которого являются зуд и изменение архитектоники наружных половых органов, что требует долгосрочной терапии, которую следует начинать сразу после установления диагноза, даже при слабо выраженных симптомах заболевания. Не существует эффективных схем, позволяющих достичь полной ремиссии заболевания. Определенно, терапия СЛ вульвы должна быть комплексной. До настоящего времени препаратами первой линии являются локальные кортикостероиды, которые назначают совместно с ангиопротекторами и корректорами микроциркуляции, витаминами (ретинол, витамин Е), смягчающими и увлажняющими средствами (эмолентами). Однако глюкокортикостероиды, как и другие локально наносимые средства, не влияют на синтез фибробластами нового коллагена и ремоделирование тканей.
Инновационные методы лечения СЛ вульвы, такие как лазерный фототермолиз, PRP-терапия, клеточные и иные технологии, обладают широким спектром терапевтического действия, в особенности в направлении нео- и ангиогенеза, имеют минимальное количество противопоказаний, побочных эффектов и, в отличие от ФДТ, могут применяться у женщин с минимальным количеством повреждений на вульве, а также эффективно позволяют решить проблемы недержания мочи, часто отмечающиеся у пациенток с СЛ вульвы.
Современные малоинвазивные методы лечения представляют значительный научный интерес, однако необходимо проведение сравнительных контролируемых клинических исследований с препаратами основной группы и определение стартовых безопасных параметров, показывающих максимальную клиническую эффективность.



