Реализация актуализированной ВОЗ задачи повышения эффективности профилактики и лечения гестационных гипертензивных нарушений наиболее результативна в условиях предиктивно-превентивной и персонализированной медицины [1]. Существующие методы профилактики преэклампсии (ПЭ), рекомендованные международными федерациями и профессиональными сообществами, имеют позднее начало, когда в разгаре важнейшие процессы гестационной перестройки, запускающие патогенетические события ПЭ [2]. Согласно действующим клиническим рекомендациям и результатам мультицентровых, в том числе рандомизированных двойных слепых плацебо-контролируемых исследований, уровень убедительности рекомендации по применению низких доз ацетилсалициловой кислоты (НДАСК) во время беременности недостаточен, а результаты по их эффективности часто носят противоречивый характер [3, 4]. Также существуют различные факторы, которые могут влиять на эффективность АСК у каждой конкретной женщины, например возраст, масса тела, сопутствующая соматическая патология, использование других лекарственных препаратов, формирование аспиринорезистентности [5]. Аналогичные противоречивые данные получены по результатам кохрейновского обзора 2017 г. по применению препаратов кальция, в котором отмечалось снижение риска ПЭ (13 испытаний, 15 730 женщин); при этом в самом крупном испытании снижение частоты ПЭ было умеренным (8%), а доверительный интервал (ДИ) относительного риска (ОР) включал вероятность отсутствия эффекта [6]. Низкая результативность существующих методов превенции актуализирует поиск новой стратегии в профилактике ПЭ. Важно отметить, что, несмотря на четко прослеживающуюся закономерность о более благоприятном течении гестации у здоровых женщин, целенаправленная специфическая патогенетически обоснованная профилактика у женщин высокого риска ПЭ на догравидарном этапе не разработана; при этом во время беременности осуществляется лишь узконаправленная коррекция уже запущенных патофизиологических механизмов (воспаления, оксидативного стресса, повышенной агрегации тромбоцитов и др.) [3, 4].
Тревожен тот факт, что продолжающийся рост частоты ПЭ тесно связан с повышенным риском манифестации в будущем метаболического синдрома (МС), сахарного диабета (СД) 2 типа, эссенциальной артериальной гипертензии и ее осложнений, что предопределяет важность ключевой роли патологической инсулинорезистентности (ИР) в дестабилизации эндотелия и реализации указанных патологий [7]. Доказанная ассоциация ПЭ и высокого сердечно-сосудистого риска объясняет общность причин летальных исходов у женщин, перенесших во время беременности ПЭ, с причинами летальных исходов у женщин, страдающих МС. В нескольких метаанализах на миллионах женщин с когда-то перенесенной ПЭ и женщин с МС показаны эти общие причины смерти – инсульты, инфаркты, тромбоэмболии, сосудистая деменция, терминальная почечная недостаточность и др. [8, 9]. Данные факты подтверждают взаимосвязь ПЭ с реализацией в разные периоды жизни заболеваний и осложнений, составляющих инсулинорезистентный континуум [10].
Согласно существующим взглядам, ПЭ является исходом метаболического кризиса в рамках отдельного гестационного клинико-патогенетического варианта МС, ключевую роль в развитии которого играют патологические ИР и гиперинсулинемия, выступающие основными механизмами энергопластического обеспечения роста плода, нарастающие по мере истощения гестационных механизмов адаптации в условиях сопутствующего влияния наследственных, эпигенетических, экологических факторов, образа жизни, питания и формирующие ассоциированный с ними воспалительный, оксидативный, протромботический статус [11, 12].
Следовательно, в отношении полноценной профилактики ПЭ задача заключается в снижении сердечно-сосудистого риска путем повышения метаболической устойчивости, противодействия образованию патологических сигнальных путей инсулина и внутриклеточной энергетической дисфункции через формирование положительной «метаболической памяти» с этапа планирования беременности. В этом отношении перспективен инсулиносенситайзер метформин (ИМФ), обладающий доказанными плейотропными эффектами – вазопротективным, антиоксидантным, противовоспалительным, гиполипидемическим [13, 14].
Цель исследования: клинико-патогенетическое обоснование эффективности двухэтапного метода профилактики ПЭ у женщин высокого риска, заключающегося в догестационном применении ИМФ и последующем приеме НДАСК во время беременности.
Материалы и методы
В исследовании приняли участие 297 женщин высокого риска по развитию ПЭ, которые были разделены в зависимости от метода профилактики: в 1-ю группу вошли 77 пациенток, получавших двухэтапную профилактику – ИМФ на прегравидарном этапе и НДАСК на гестационном этапе; во 2-ю группу – 75 пациенток с изолированным применением НДАСК на гестационном этапе; в 3-ю группу – 72 пациентки, получавшие ИМФ только преконцепционно; в 4-ю группу – 73 пациентки, отказавшиеся от профилактической терапии. В 5-ю группу (контроль) вошли 30 здоровых женщин с физиологически протекавшей беременностью. Критериями включения выступали: отягощенный ПЭ личный и/или семейный анамнез, возраст первородящих женщин >35 лет; индекс массы тела 18,5–24,9 кг/м2;
окружность талии <80 см; АД <130 и 85 мм рт.ст.; наличие предиабета. Диагностика предиабета у женщин с независимыми факторами высокого риска ПЭ, наличие которого позволило обосновать назначение ИМФ в качестве профилактического агента на догестационном этапе, включала оценку уровня гликированного гемоглобина (6,0–6,4%), наличие нарушенной толерантности к глюкозе и/или нарушенной гликемии натощак, применение валидированного опросника FINDRISK [Finnish Diabetes Risk Score] (≥12 баллов – предиабет) [15]. Критерии невключения: тяжелая экстрагенитальная патология, в том числе СД 1 и 2 типа; бесплодие в анамнезе; врожденные пороки развития половых органов у матери; заболевания инфекционного генеза; синдром поликистозных яичников; психические заболевания; наличие противопоказаний к приему ИМФ. Критерии исключения: нарушение выполнения индивидуального протокола, в том числе в связи с нежелательными явлениями при приеме ИМФ; беременность в результате вспомогательных репродуктивных технологий; многоплодная беременность.
Двухэтапная профилактика ПЭ включала: на прегравидарном этапе – прием ИМФ по 500 мг 2 раза в день, внутрь, в течение 4–6 месяцев, модификация образа жизни (клинические рекомендации «СД 2 типа у взрослых», 2022 [16]); на гестационном этапе – прием НДАСК в дозировке 150 мг, внутрь, на ночь, с 12-й по 36-ю неделю (согласно действующим рекомендациям [17]). Изолированное применение НДАСК во время беременности и ИМФ преконцепционно у женщин 2-й и 3-й групп соответственно осуществлялось аналогично 1-й группе.
У всех пациенток в сроках гестации 11–14, 18–21, 30–34 недель оценивались параметры гормонально-метаболического (глюкоза венозной плазмы, инсулин, индекс инсулинорезистентности (HOMA-IR), лептин, кортизол, плацентарный лактоген (ПЛ), общий холестерин (ОХ), триглицериды (ТГ), липопротеиды высокой плотности (ЛПВП), ТГ/ЛПВП, мочевая кислота), провоспалительного (фактор некроза опухоли (ФНО)-α) и эндотелиально-гемостазиологического (циркулирующие эндотелиальные клетки (ЦЭК), агрегатограмма, фибронектин (ФН)) паттернов, а также маркеры плацентарного ангиогенеза (ФРП) и децидуализации (ПАМГ-1). В ходе обследования использованы ультразвуковая система Voluson E6 GE Healthcare (GE, США), анализаторы Architect c4000, Architect i1000 SR (Abbott, США), Sysmex XN-1000 (Sysmex Corporation, Япония), АЛАТ-2 (ООО НПФ «Биола», Россия). Дополнительно оценивались: суточная динамика АД (система BP-Lab («Петр Телегин», Россия)), накопление и распределение жира (толщина подкожного (тПКЖ) и преперитонеального (тППЖ) жира, индекс жира брюшной стенки (ИЖБС) – тППЖ/тПКЖ, значение >1,0 свидетельствует о висцеральном типе жироотложения), субъективная оценка характеристик сна (опросник Я.И. Левина (1995)), ноктурия и периоды гестационного сонного апноэ (SOMNOcheck (Weinmann, Германия)).
Статистический анализ
Для проведения статистического анализа использовалась программа IBM SPSS Statistics 25 HC IMAGO 5.0 (IBM, США). Для оценки нормальности распределения показателей применялся критерий Шапиро–Уилка. Распределение параметров не было нормальным, поэтому в качестве описательной статистики количественных признаков использовались медиана (Ме) и межквартильный размах от Q1 до Q3 (25–75% квартили). Для сравнения независимых выборок применялся дисперсионный анализ Краскела–Уоллиса с последующими межгрупповыми сравнениями по U-критерию Манна–Уитни с поправкой Бонферрони (критический уровень значимости при сравнении 4 групп – р<0,008, 5 групп – р<0,005). Для сравнения категориальных признаков использовался χ² Пирсона, при размерности таблицы сопряженности 2×2 использовался χ² Пирсона с поправкой Йейтса. Для сравнения зависимых выборок (динамики показателя во время беременности) применялся W-критерий Уилкоксона. Для объективизации результативности превенции проведен расчет показателей: ОР – относительный риск; СОР, САР – снижение относительного и абсолютного риска; ЧБНЛ – число беременных, которым необходимо проводить превенцию, чтобы предотвратить неблагоприятный исход у одной пациентки. Рассчитывался 95% доверительный интервал (95% ДИ) [18, 19].
Результаты и обсуждение
У женщин групп сравнения (n=297) факторы высокого риска ПЭ были представлены следующим образом: отягощенный ПЭ личный анамнез имел место у 56,9% (169/297), отягощенный ПЭ семейный анамнез – у 34% (101/297); первородящие позднего репродуктивного возраста составили 9,1% (27/297); межгрупповые различия по факторам высокого риска отсутствовали (p>0,05). Целенаправленный отбор женщин в группу высокого риска ПЭ по критерию «предиабет» [16] показал его наличие более чем у 90% женщин с указанными факторами высокого риска ПЭ.
Основным целевым показателем исследования явилась частота реализации ПЭ. Общая частота ПЭ в группах с различными подходами к профилактике составила 13,0% (10/77) – в 1-й группе, 30,7% (23/75) – во 2-й группе, 18,1% (13/72) – в 3-й группе, что статистически значимо ниже, чем у женщин в 4-й группе, категорически отказавшихся от профилактики, – 49,3% (36/73), р1-4, р3-4<0,001, р2-4=0,03 (табл. 1). Однако необходимо отметить, что частота развития ПЭ у пациенток 1-й группы значимо ниже, чем у женщин 2-й группы (р=0,015), что выступает важным аргументом, отражающим преимущество предлагаемой двухэтапной профилактики у женщин высокого риска, включающей прегравидарную подготовку ИМФ и применение НДАСК во время беременности, по сравнению со стандартной профилактикой НДАСК. В то же время нами выявлена отчетливая тенденция к снижению частоты ПЭ у женщин 3-й группы с направленным преконцепционным применением ИМФ по сравнению со стандартным применением НДАСК. Интересные данные получены при анализе частоты реализации ПЭ в зависимости от срока и степени тяжести. Важен факт статистически значимого снижения тяжелой ПЭ только в 1-й (p=0,01) и 3-й (p=0,03) группах с догравидарным применением ИМФ, при наличии лишь тенденции к уменьшению показателя во 2-й группе со стандартным использованием НДАСК – в 2 раза по сравнению с 4-й группой (p>0,05). Частота умеренной ПЭ у беременных 4-й группы составила 31,5%, что значимо выше, чем у пациенток, получавших этапную (p=0,01) или только прегравидарную (p=0,03) профилактику (в 3 и 2,3 раза). Статистически значимое снижение как ранней тяжелой ПЭ (p=0,03), так и ранней ПЭ в целом (в 7,4 и 4,6 раза, p=0,01) в 1-й и 3-й группах соответственно при отсутствии значимых различий между 2-й и 4-й группами объясняется проведением преконцепционного этапа превенции ИМФ, а также наличием двухэтапного подхода к профилактическим мероприятиям.

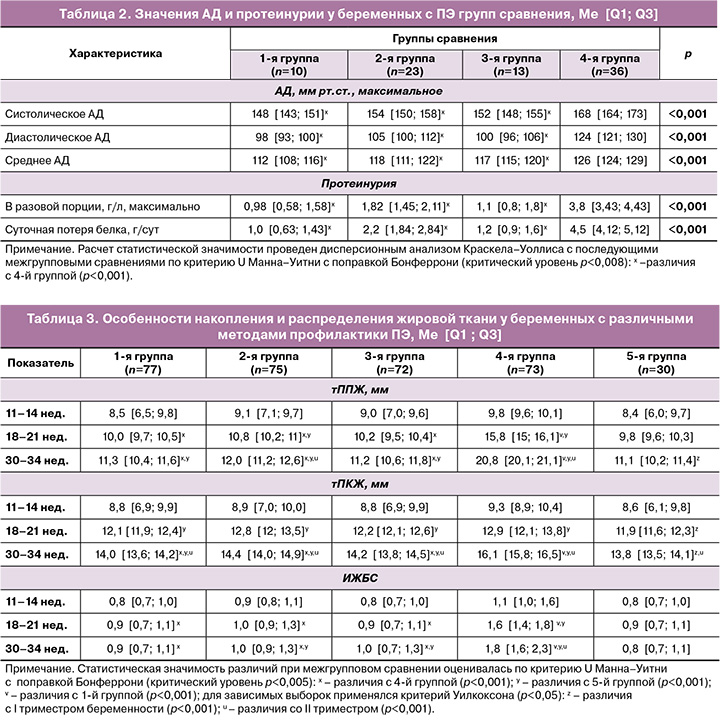
Нами проведен анализ ведущих диагностических критериев ПЭ – уровня АД и протеинурии (табл. 2). Выявлено, что пациентки 4-й группы имели более высокие значения систолического АД, диастолического АД и среднего АД, а также протеинурии в разовой порции и суточной потери белка (p<0,001). Следует отметить, что у женщин, принимавших ИМФ (1-я и 3-я группа), отмечается тенденция к более низким значениям АД и протеинурии, чем у женщин 2-й группы без преконцепционного этапа превенции.
В настоящее время детально изучаются особенности АД при ПЭ, в частности суточная вариабельность АД [20]. Анализ данного параметра показал, что патологические типы АД – night-picker (повышение АД ночью) и non-dipper (снижение АД ночью <10%) – имели наибольшую частоту у беременных 4-й группы, в то же время благодаря проведенной превентивной терапии у женщин 1, 2 и 3-й групп данные типы регистрировались значимо реже (р<0,05) (табл. 1). Причем применение двухэтапной профилактики ПЭ у женщин высокого риска обусловило достоверно более высокую частоту нормального типа вариабельности АД по сравнению со стандартной профилактикой НДАСК (р=0,04).
В современной литературе появляются данные о важной роли синдрома обструктивного апноэ сна в развитии ПЭ [21]. В связи с этим нами проанализированы качество дыхания и субъективные характеристики сна (анкета Я.И. Левина) (табл. 1). Гестационное сонное апноэ (аналог обструктивного апноэ во время сна, ассоциированный с беременностью) зафиксировано более чем у половины беременных 4-й группы – 54,8% (40/73), что статистически значимо выше, чем в 1, 2 и 3-й группах сравнения – в 4,2, 2,9 и 3,6 раза соответственно (p<0,001). У женщин с ПЭ также наблюдалась инсомния, характеризующаяся низким качеством ночного сна, появлением негативных сновидений и повышенной сонливостью в течение дня. При этом важно, что среди женщин 4-й группы без профилактического лечения 41,1% имели результат ≤18 баллов по анкете Я.И. Левина, подтверждающий наличие инсомнии. В то же время ни одна из пациенток с превенцией ИМФ не имела серьезных нарушений сна.
Нами проанализирована частота ноктурии – мультифакторного симптома, ассоциированного с рядом патологических состояний, сопровождаемых ИР, независимого фактора риска плохого качества ночного сна, ухудшающего течение беременности, маркера гормонально-метаболического неблагополучия, нарушений энергетического обеспечения и метаболизма органов мочевой системы вследствие эндотелиальной и митохондриальной дисфункции урогенитального тракта и всех регулирующих его систем [22]. Пробуждение от сна связано с повышением частоты сердечных сокращений и уровня АД – основными детерминантами потребления кислорода сердечной мышцей, выраженности сосудистого стресса, эндокринной регуляции и активации системы свертывания [23]. У беременных 1-й группы с этапными профилактическими мероприятиями имели место значимые различия с 4-й группой без превентивного лечения (p>0,001) по проявлениям ноктурии различной выраженности (от 2 до 4 и более пробуждений ночью для мочеиспускания); при этом с контролем различия отсутствовали (p>0,05) (табл. 1). Аналогичная ситуация прослеживается при сравнении 2-й, 3-й групп с 4-й группой, однако с контролем статистически значимые различия отсутствовали только по ноктурии с выраженными проявлениями (3, 4 и более ночных пробуждений). Данные результаты свидетельствуют о преимуществе двухэтапной превенции с догравидарным применением ИМФ в нивелировании такого раннего симптома эндотелиальной и митохондриальной дисфункции, как ноктурия.
Учитывая роль патологических ИР и гиперинсулинемии в формировании ПЭ [12], важным представляется участие висцеральной жировой ткани в механизмах развития данного осложнения беременности. Динамика накопления и распределения жировой ткани у беременных высокого риска ПЭ представлена в таблице 3.
Начиная со II триместра наблюдаются статистически значимо более высокие значения тППЖ, тПКЖ и ИЖБС у пациенток, отказавшихся от профилактических мероприятий, по сравнению с пациентками 1, 2 и 3-й групп (p1-4, р2-4, р3-4<0,001). Кроме того, принимая во внимание выраженное благоприятное влияние ИМФ на углеводный и липидный обмен, продленный протективный эффект догестационной профилактики ИМФ обуславливает более низкие показатели накопления жировой ткани у пациенток 1-й и 3-й групп, в отличие от женщин 2-й группы со стандартной профилактикой НДАСК, достигающие статистически значимых различий к III триместру (р<0,001). Поиск обоснования клинической результативности этапного подхода к профилактике при высоком риске ПЭ нами осуществлен в направлении изучения влияния различных вариантов превенции на механизмы формирования ПЭ по результатам лабораторного мониторинга беременных (табл. 4, рисунок).
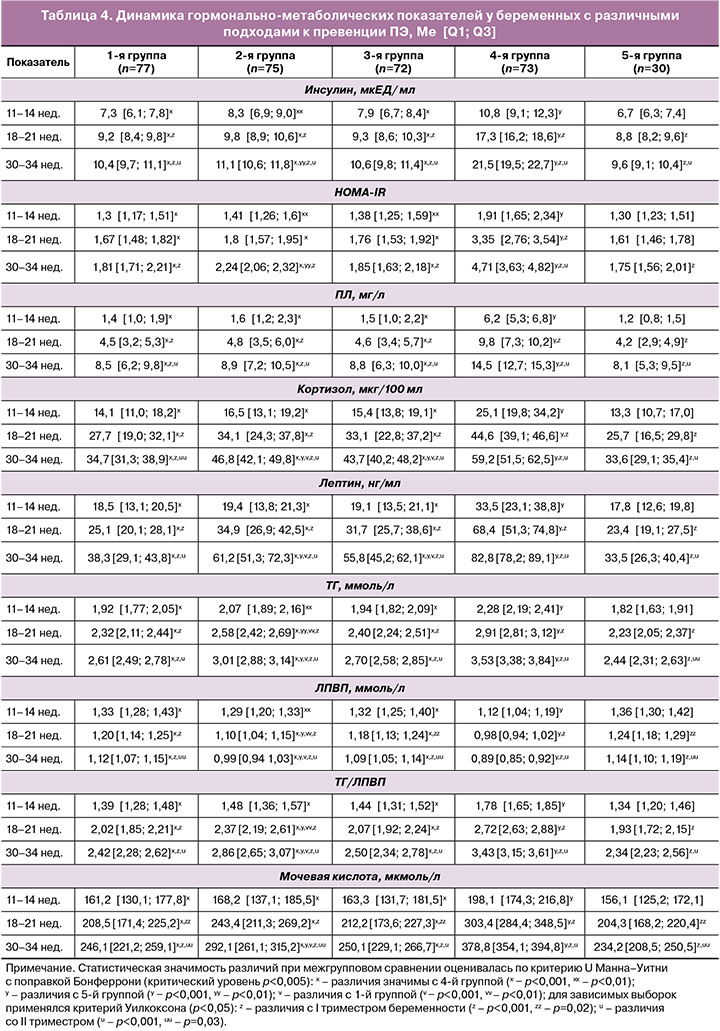
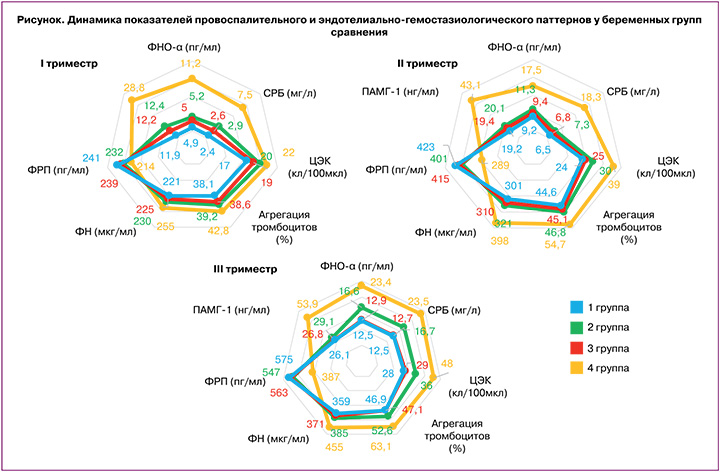
Динамическая оценка патогенетически значимых маркеров показала, что направленная догравидарная подготовка ИМФ в рамках предлагаемого метода профилактики ПЭ позволила сохранить уровень базальной гликемии на всех этапах гестации <5,1 ммоль/л в 1-й группе (4,1 [3,3; 4,5]) и 3-й группе (4,3 [3,8; 4,6]), p1-5, p3-5>0,05. Однако во 2-й группе (4,8 [4,3; 5,0]) и 4-й группе (5,0 [4,7; 5,5]) отмечается тенденция к повышению данного показателя в течение гестации по сравнению с контролем (4,3 [3,4; 4,5]), достигая в 4-й группе значимых различий к III триместру (p4-5<0,001). Схожая динамика выявлена при анализе уровней инсулина и HOMA-IR: отсутствие значимых различий между контролем и 1-й, 3-й группой; наибольшие значения показателей выявлены у пациенток 4-й группы без профилактических мероприятий (р<0,001 со всеми группами на всех сроках обследования); появление значимых различий в III триместре у женщин 2-й группы по сравнению с контролем (р2-5<0,01) (табл. 3). Выявленные закономерности свидетельствуют о значительном вкладе догестационной инсулиносенсибилизации, заключающемся в создании положительного периконцепционного «эффекта наследия», необходимого для адаптации к гестационной метаболической перестройке за счет более интенсивной компенсации ИР и гиперинсулинемии.
Широко известно, что роль наиболее сильного индуктора ИР во время беременности отводится ПЛ, обладающему липолитическими свойствами, направленными на переключение материнского метаболизма в сторону увеличения потребления липидов и усиления ИР [11]. Важно отметить, что благодаря профилактической терапии ПЭ у пациенток 1, 2 и 3-й групп показатели ПЛ на всех этапах исследования не имели значимых различий с результатами обследования женщин с физиологической гестацией (p1-5, p2-5, p3-5>0,05), в то время как у женщин без профилактических мероприятий выявлены наибольшие значения показателя, статистически значимо превышающие значения во всех группах (р<0,001). Также в формировании патологической ИР и, как следствие, артериальной гипертензии при ПЭ принимает участие лептин [12]. Согласно полученным данным, уровни лептина в 1, 2 и 3-й группах были достоверно ниже, чем в 4-й группе (p1-4, p2-4, p3-4<0,001 – на всех сроках обследования), однако только в 1-й группе данный показатель значимо не превышал уровень контрольной группы в III триместре (p1-5>0,05), что свидетельствует о снижении лептинорезистентности и липотоксичности у пациенток высокого риска ПЭ на фоне двухэтапной профилактики. Динамика уровня кортизола, также играющего важную роль в формировании патологической ИР и гиперинсулинемии на доклинической стадии ПЭ, имела аналогичные закономерности.
Известно, что нарушения липидного профиля (повышение фракции ОХ, ЛПНП и ТГ, снижение фракции ЛПВП) являются одним из основных маркеров дисметаболического звена патогенеза ПЭ [11]. Результаты обследования пациенток 4-й группы подтверждают формирование атерогенных изменений липидограммы у женщин с ПЭ. При этом у беременных 1, 2 и 3-й групп выявлено статистически значимое снижение уровней ТГ, ТГ/ЛПВП и повышение ЛПВП по сравнению с женщинами без профилактических мероприятий (табл. 3). Наибольший эффект превентивной терапии достигнут при применении двухэтапного метода профилактики, что подтверждается достоверно более физиологичными уровнями показателей липидного профиля при сравнении со 2-й группой (р<0,001 к концу гестации). Доказано, что нарушения пуринового обмена ассоциированы с развитием патологической ИР, в том числе и при ПЭ [12]. Согласно полученным результатам, состояние гиперурикемии значимо чаще регистрировалось у пациенток 4-й группы, при этом у пациенток 1-й и 3-й групп значения урикемии были схожи с контролем (р>0,05), что обусловлено превенцией ИМФ. На фоне применения стандартной профилактики НДАСК имело место статистически значимое нарастание уровня мочевой кислоты по сравнению с 1-й и 5-й группами (р1-2, р2-5<0,001).
Большое количество исследований подтверждает формирование при ПЭ провоспалительных изменений. В последние годы показано, что ФНО-α является важным медиатором ИР и гиперинсулинемии [12]. Прием на догестационном этапе ИМФ имеет выраженный протективный эффект, сдерживающий избыточное нарастание ФНО-α; при этом во 2-й группе к III триместру отмечено значимое нарастание ФНО-α по сравнению с 1-й группой и контролем (p1-2<0,01, р2-5<0,001) (рисунок).
В настоящее время эндотелиальная дисфункция рассматривается в качестве патогенетического предшественника формирования артериальной гипертензии при ПЭ и имеет выраженную ассоциативную связь с патологическими ИР и гиперинсулинемией [24]. Важными маркерами дисфункции эндотелия являются ЦЭК, ФН, агрегационная активность тромбоцитов. Анализ количества ЦЭК у беременных 1, 2 и 3-й групп не показал статистически значимых различий с контролем в I триместре (15 [12; 18] кл/100 мкл), p1-5, p2-5, p3-5>0,05, причем у беременных 1-й группы отсутствие различий сохранялось на протяжении всей беременности. Выявленные в 4-й группе уровни ЦЭК имели наибольшие значения, что патогенетически связано с высокой частотой реализации ПЭ (рисунок). Схожие тенденции выявлены при анализе содержания ФН, выделяющегося в плазму при повреждении эндотелиоцитов, что приводит к значительному прокоагуляционному сдвигу [13]. Агрегационная активность тромбоцитов с коллагеном во всех группах нарастала в динамике беременности [25]. На фоне применения разных вариантов профилактики ПЭ у пациенток 1, 2 и 3-й групп уровень агрегации тромбоцитов оставался статистически значимо ниже, чем у беременных, отказавшихся от профилактики (p1-4, p2-4, p3-4<0,001 – в 18–21 и 30–34 недель), и не имел различий с контролем (37,4 [34,5; 41,1]%, 42,1 [40,8; 45,3]%, 46,2 [42,1;48,1]% соответственно I, II, III триместрам), p1-5, p2-5, p3-5>0,05.
Хорошо исследовано при беременности формирование проангиогенного состояния, связанного с устойчивым развитием эмбрио(фето)плацентарного комплекса и защитой эндотелия сосудов от избыточной активации и альтерации [26, 27]. Это подтверждается динамикой ФРП (рисунок). При применении профилактической терапии у женщин 1, 2 и 3-й групп уровни показателя оставались более высокими по сравнению с 4-й группой, причем у женщин с двухэтапной превенцией – догестационным приемом ИМФ и НДАСК во время беременности – отмечаются наиболее схожие с контролем показатели (248 [224; 272], 431 [393; 478], 591 [531; 638] пг/мл соответственно I, II, III триместрам), p1-5, p2-5, p3-5>0,05. Важным пептидом, модулирующим патологическую ИР и играющим роль в патогенезе ПЭ, является ПАМГ-1 [12]. У всех женщин с проведенной профилактикой ПЭ уровень ПАМГ-1 был статистически значимо ниже, чем у пациенток 4-й группы (р<0,001), что соответствовало менее выраженному нарастанию ИР, гиперинсулинемии и меньшей частоте реализации ПЭ.
Следовательно, в основе снижения сердечно-сосудистого риска у женщин с высокой вероятностью реализации ПЭ лежат доказанные в многочисленных исследованиях эффекты ИМФ, реализуемые благодаря активации аденозин-монофосфат-активируемой протеинкиназы – ключевого фермента энергетического гомеостаза и клеточного метаболизма, базового защитного фактора сердечно-сосудистой системы [28], и последующему ингибированию нутриент-сенсорного сигнального пути мишени рапамицина млекопитающих (mammalian target of rapamycin, mTOR), что растормаживает сенесцентные клетки с исчерпанным ресурсом деления, ограничивает их гиперфункцию, в том числе провоспалительную, гиперсекрецию и уменьшает устойчивость к сигналам митогенов, включая инсулин [29]. Достигаемая превенцией ИМФ оптимизация внутриклеточных сигнальных путей на периконцепционном этапе, потенцируемая влиянием гестационного профилактического агента – НДАСК, способствует тому, что гестационные ИР и гиперинсулинемия, нарастающие вследствие действия плацентарных контринсулярных факторов, сохраняют физиологический характер и не инициируют механизмы гестационной гипертензии и полиорганной недостаточности через формирование воспалительно-оксидативно-тромбогенного статуса. Объективизация размера эффекта превентивного вмешательства проведена путем расчета показателей ОР, СОР, САР, ЧБНЛ с 95% ДИ. В группах с различными превентивными подходами показатели распределились соответственно следующим образом: 1-я группа – 0,26 [0,14; 0,49], 73,7% [50,9; 85,9], 36,3% [22,6; 50,1], 3 [2; 4] (χ2=21,58, р<0,001); 3-я группа – 0,37 [0,21; 0,63], 63,4% [36,9; 78,8], 31,3% [16,8; 45,8], 4 [2; 6] (χ2=14,47, р<0,001); 2-я группа – 0,62 [0,41; 0,94], 37,8% [6,0; 58,8], 18,7% [3,1; 34,2], 6 [3; 32] (χ2=4,62, р=0,03), что свидетельствует о более высокой эффективности двухэтапного метода профилактики ПЭ у женщин высокого риска с применением ИМФ на преконцепционном и НДАСК на гестационном этапах.
Заключение
В настоящее время не вызывает сомнения ключевая роль преконцепционной подготовки беременных групп высокого риска, способствующей гармоничной гестационной перестройке и сдерживающей раннюю манифестацию и тяжесть проявлений осложнений беременности.
В ходе исследования проведена оценка эффективности двухэтапного метода профилактики ПЭ, заключающегося в догравидарном применении ИМФ и НДАСК на гестационном этапе. Клинико-лабораторные параллели у беременных высокого риска ПЭ позволили доказать преимущество этапного подхода, реализующего через эпигенетические механизмы положительный «эффект метаболической памяти», что подтверждено усилением механизмов интенсивной компенсации ИР и гиперинсулинемии, содержанием клеточных маркеров повреждения и ремоделирования сосудистого эндотелия и объективизировано показателями размера эффекта превентивного действия. Ограничение профилактических мероприятий догравидарным этапом с использованием ИМФ не обеспечивает сохранения полноценной гестационной адаптации на всем протяжении беременности, что реализуется в меньшей клинической эффективности. Снижение результативности при изолированном применении НДАСК связано с отсутствием периконцепционного влияния на ключевые события ранних сроков гестации, определяющие закономерности последующего течения беременности. Преимуществом двухэтапного подхода к профилактике ПЭ является монотерапия на каждом этапе превенции безопасными препаратами с хорошо известными фармакологическими свойствами, доказанными биологическими эффектами.
Таким образом, новая стратегия в профилактике ПЭ представлена этапным подходом, обеспечивающим снижение сердечно-сосудистого риска путем формирования метаболической устойчивости у женщин высокого риска ПЭ с этапа планирования беременности, и реализована в перспективном высокоэффективном патогенетически обоснованном методе превенции, направленном на улучшение акушерских исходов и стабилизацию сердечно-сосудистого континуума в последующих этапах жизни.



