Любое хирургическое вмешательство сопровождается некрозом тканей в очаге воспаления, патологическим белковым катаболизмом, массовой гибелью клеток и развитием токсических состояний [1]. Помимо некротических изменений, оперативная травма ведет к глубоким нейрососудистым расстройствам в яичниках и гибели части генеративных элементов. Возможно, это связано с нарушением кровообращения и иннервации, возникшим как на фоне доброкачественной опухоли яичника, так и вследствие оперативного вмешательства. Полагают, что это приводит к эндогенной интоксикации в той или иной степени, обусловленной всасыванием продуктов распада травмированных тканей [2]. Необходимость оценки уровня эндогенной интоксикации при проведении операций очень велика, и объективизация ее критериев позволяет следить за динамикой патологического процесса [3].
Для оценки целесообразно анализировать клинические критерии тяжести оперативного вмешательства: двигательную активность пациентки, восстановление акта мочеиспускания, перистальтики кишечника, температурную и болевую реакцию, клинический анализ крови.
Биохимические исследования для оценки степени травматичности ткани до и после оперативного вмешательства включали определение: С-реактивного белка в сыворотке крови путем твердофазного непрямого иммуноферментного анализа; молекулы средней массы (МСМ) в сыворотке крови спектрофотометрическим методом при длине волн 254 и 280 нм; кислоторастворимых фракций нуклеиновых кислот (КФНК) в сыворотке крови спектрофотометрически, путем измерения степени поглощения ультрафиолетового излучения суммарной фракции кислоторастворимых компонентов нуклеиновых кислот; активных продуктов взаимодействия с тиобарбитуратовой кислотой (ТБК-ап) – малоновые диальдегиды (МДА) в сыворотке крови методом Jagi в модификации M. Ishihara.
Цель исследования: провести сравнительное исследование эффективности использования аргоноплазменной коагуляции (АПК) и биполярной коагуляции (БПК) у пациенток с доброкачественными опухолями яичников (ДОЯ).
Материал и методы исследования
Настоящая работа проводилась на клинической базе кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН, гинекологического отделения ГКБ № 79, гинекологического отделения стационара ФГБУ ОБП УД Президента России. В исследование были отобраны и включены 110 пациенток по следующим критериям: 1) репродуктивный возраст (от 18 до 41 года); 2) односторонние ДОЯ (эндометриоидная киста, серозная цистаденома, зрелая тератома), верифицированные по данным гистологического исследования после оперативного лечения; 3) размер опухоли или суммарный размер опухолей в одном яичнике не более 6 см.
Критериями исключения были: 1) пациентки с ДОЯ, ранее перенесшие оперативное вмешательство на яичниках, и сочетанной гинекологической патологией; 2) пациентки с пограничными и злокачественными опухолями яичников.
Все пациентки были разделены на 2 группы. В первую (основную) группу включены 60 пациенток, оперированные по поводу ДОЯ (односторонняя цистэктомия) с использованием АПК (высокочастотный электрохирургический аппарат – коагулятор «ERBE VIO 300 D», производитель – компания ERBE Elektromedizin, Германия). Для проведения оптимальной коагуляции ложа опухолей яичника был использован стандартный режим «Precise APC» [4, 5] .
Во вторую группу (сравнения) были включены 50 пациенток, оперированные по поводу ДОЯ (односторонняя цистэктомия) с использованием только БПК. Данный вид энергии наиболее применяем в оперативной гинекологии и был выделен в качестве сравнения среди остальных в результате расширенного анализа с учетом его технических, физических и биологических свойств при воздействии на ткани [6]. Агрессивность выполненной цистэктомии в большой степени также зависит от техники выполнения оперативного вмешательства [6] .
Критерием для прекращения коагуляция была полная остановка кровотечения из яичниковой ткани.
Перед планируемым оперативным вмешательством всем пациенткам проводилось общеклиническое, эхографическое, допплерометрическое, клинико-лабораторное обследование. Из клинико-лабораторных методов оценки травматизации ткани использовалась оценка скорости оседания эритроцитов (СОЭ), количество лейкоцитов, С-реактивный белок.
Кровь для исследования получали из кубитальной вены в стандартных условиях у всех пациенток утром в день до операции, через 6–12 часов, 72–96 часов и на 5–7-е сутки после операции. Образцы в контейнерах передавали в лабораторию. Информированное согласие на использование крови для проведения исследований было получено у всех пациенток.
 Всем пациенткам перед оперативным вмешательством проводилась трансвагинальная 2D-эхография и 3D-эхография с ангиографией на аппарате VOLUSON-730 Expert (GE Kretz, Zipf, Австрия) по стандартной методике с трансвагинальным датчиком (3,3–10 МГц). По данным сканирования до операции определялись размеры опухоли и ее характер – эндометриоидная киста, серозная гладкостенная цистаденома или дермоидная киста. Применяемые эхографические и допплерометричекие критерии диагностики эндометриоидной кисты: образование округлой формы, фиксированное к задней или боковой поверхности матки; практически стабильные размеры на протяжении двух менструальных циклов; стенка капсулы кисты более 2–4 мм с эффектом «двойного контура»; внутренняя стенка капсулы кисты ровная; мелкодисперсная эхогенная взвесь, иногда с более гиперэхогенными плотными включениями не более 5 мм (в зависимости от длительности существования кисты); встречается до двух образований аналогичного строения в одном яичнике; отсутствие периферического кровотока; отсутствие признака «акустического эффекта» [7]. Эхографические и допплерометричекие критерии диагностики серозной гладкостенной цистаденомы: однокамерное гладкостенное образование с капсулой менее 2 мм и диаметром менее 5 см; папиллярные разрастания не представлены; содержимое однородное анэхогенное; в большем проценте случаев смещаемое; периферического кровотока нет. Эхографические и допплерометрические критерии диагностики дермоидной кисты: однокамерное образование кистозно-солидного строения; толщина капсула более 3 мм, различная толщина на разных участках капсулы; гиперэхогенное аваскулярное содержимое образование с плотными включениями; периферического кровотока нет; симптом «хвост кометы» [8] . При помощи программы VOCAL (Virtual Organ Computer-aided AnaLysis) определили объем яичниковой ткани, прилежащей к образованию, на дооперационном периоде, и объем интактного яичника в ручном режиме (Manual). Подсчет антральных фолликулов выполняли с использованием программы Inversion mode. После выполнения расчетов объема яичника в программе визуализации VOCAL™ на экран выводилась автоматически рассчитанная гистограмма трехмерного изображения (Color Angio) с показателями кровотока: индексом васкуляризации (VI), отражающего процент кровеносных сосудов во всем объеме яичника; индексом кровотока (FI), характеризующего интенсивность перфузии в интраовариальных сосудах. В послеоперационном периоде помимо вышеперечисленных показателей производилась оценка свободной жидкости в малом тазу через 72 часа после оперативного вмешательства.
Всем пациенткам перед оперативным вмешательством проводилась трансвагинальная 2D-эхография и 3D-эхография с ангиографией на аппарате VOLUSON-730 Expert (GE Kretz, Zipf, Австрия) по стандартной методике с трансвагинальным датчиком (3,3–10 МГц). По данным сканирования до операции определялись размеры опухоли и ее характер – эндометриоидная киста, серозная гладкостенная цистаденома или дермоидная киста. Применяемые эхографические и допплерометричекие критерии диагностики эндометриоидной кисты: образование округлой формы, фиксированное к задней или боковой поверхности матки; практически стабильные размеры на протяжении двух менструальных циклов; стенка капсулы кисты более 2–4 мм с эффектом «двойного контура»; внутренняя стенка капсулы кисты ровная; мелкодисперсная эхогенная взвесь, иногда с более гиперэхогенными плотными включениями не более 5 мм (в зависимости от длительности существования кисты); встречается до двух образований аналогичного строения в одном яичнике; отсутствие периферического кровотока; отсутствие признака «акустического эффекта» [7]. Эхографические и допплерометричекие критерии диагностики серозной гладкостенной цистаденомы: однокамерное гладкостенное образование с капсулой менее 2 мм и диаметром менее 5 см; папиллярные разрастания не представлены; содержимое однородное анэхогенное; в большем проценте случаев смещаемое; периферического кровотока нет. Эхографические и допплерометрические критерии диагностики дермоидной кисты: однокамерное образование кистозно-солидного строения; толщина капсула более 3 мм, различная толщина на разных участках капсулы; гиперэхогенное аваскулярное содержимое образование с плотными включениями; периферического кровотока нет; симптом «хвост кометы» [8] . При помощи программы VOCAL (Virtual Organ Computer-aided AnaLysis) определили объем яичниковой ткани, прилежащей к образованию, на дооперационном периоде, и объем интактного яичника в ручном режиме (Manual). Подсчет антральных фолликулов выполняли с использованием программы Inversion mode. После выполнения расчетов объема яичника в программе визуализации VOCAL™ на экран выводилась автоматически рассчитанная гистограмма трехмерного изображения (Color Angio) с показателями кровотока: индексом васкуляризации (VI), отражающего процент кровеносных сосудов во всем объеме яичника; индексом кровотока (FI), характеризующего интенсивность перфузии в интраовариальных сосудах. В послеоперационном периоде помимо вышеперечисленных показателей производилась оценка свободной жидкости в малом тазу через 72 часа после оперативного вмешательства.
Для статистической обработки полученных результатов использовалась компьютерная программа Statistica for Windows Relerase 6.0 компании StatSoft Inc.,США (2002). Достоверность различий параметрических данных оценивали по критерию Стьюдента. Результаты представлены как средние ± SD (М±SD). Различия между группами считались достоверными при р<0,05.
Результаты и обсуждение
Комплексная оценка факторов воздействия АПК на ткани показала, что определяющими в сравнительном анализе с БПК являются: длительность операции (коагуляции), степень травматичности тканей и период послеоперационного реабилитационного процесса.
 Важным фактором является сравнительная оценка площади одномоментной коагуляции АПК и БПК. Геометрия потока аргоновой плазмы, вытекающей из сопла инструмента, представляет собой усеченный конус. Диаметр зоны воздействия на расстоянии 5 мм равен 6 мм. Соответственно, площадь коагуляционной зоны равна минимум 28,26 мм². При использовании биполярного электрокоагулятора, учитывая диаметр бранши инструмента – 4 мм, площадь одномоментной коагуляции составляет 12,56 мм². Следовательно, площадь коагуляционной зоны при АПК больше в 2–3 раза площади воздействия БПК. Таким образом, выявлены достоверные различия в физических и технических свойствах АПК по сравнению с БПК. Совокупность этих свойств АПК позволяет сократить время коагуляции, то есть время оперативного вмешательства более чем в 2 раза.
Важным фактором является сравнительная оценка площади одномоментной коагуляции АПК и БПК. Геометрия потока аргоновой плазмы, вытекающей из сопла инструмента, представляет собой усеченный конус. Диаметр зоны воздействия на расстоянии 5 мм равен 6 мм. Соответственно, площадь коагуляционной зоны равна минимум 28,26 мм². При использовании биполярного электрокоагулятора, учитывая диаметр бранши инструмента – 4 мм, площадь одномоментной коагуляции составляет 12,56 мм². Следовательно, площадь коагуляционной зоны при АПК больше в 2–3 раза площади воздействия БПК. Таким образом, выявлены достоверные различия в физических и технических свойствах АПК по сравнению с БПК. Совокупность этих свойств АПК позволяет сократить время коагуляции, то есть время оперативного вмешательства более чем в 2 раза.
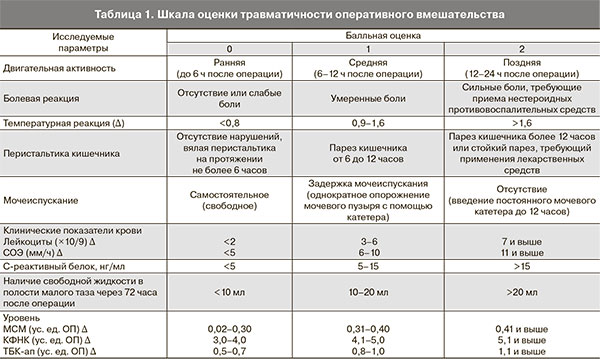
Вторым основным фактором является степень деструкции ткани, которая оценивалась на основе шкалы степени травматичности [2], включающей 9 основных клинических и лабораторных параметров (температурная реакция, болевая реакция, двигательная активность, перистальтика кишечника, мочеиспускание, клинические показатели крови – лейкоциты, СОЭ).
Результаты проведенных исследований позволили оценить степень воспалительно-некротического процесса после БПК и АПК. В процессе сравнительного анализа существенных различий в клинических показателях, таких как двигательная активность, перистальтика кишечника и мочеиспускание в I и II группах не выявлено.
Достоверные отличия при применении АПК и БПК в послеоперационном периоде наблюдались при оценке температурной и болевой реакций. Исследование температурной реакции пациенток после АПК показало, что у 51 (85%) пациентки температура тела в течение всего послеоперационного периода не превышала 37,0˚С, в то же время при БПК это количество составляло 29 (58%) пациенток. Повышение температуры тела от 37,1 до 37,5˚С отмечалось при АПК у 9 (15 %), а при БПК – у 17 ( 34 %) пациенток, то есть в 2 раза чаще. Повышение температуры тела выше 37,5˚С отмечено только у 4 (8%) пациенток при применении БПК, а при применении АПК не отмечено, что связано с менее выраженным процессом эндогенной интоксикации продуктами деструкции ткани.
Изучая болевую реакцию у пациенток в группах, оперированных с использованием АПК и БПК, мы наблюдали различия в течение первых трех суток. Со слабыми болями количество пациенток в I группе (АПК) составило 15 (25%), с умеренными – 6 (10%), с сильными – 2 (3,3%) пациентки. Во II группе – соответственно 30 (60%), 15 (30%), 5 (10%) пациенток. У остальных 37 (61,7 %) пациенток жалобы на боли после применения АПК отсутствовали. То есть при использовании АПК умеренные и сильные боли в послеоперационном периоде встречались реже, чем после БПК.
При оценке клинического анализа крови у всех оперированных женщин наблюдалось повышение значений лейкоцитов и СОЭ после оперативного вмешательства. Необходимо отметить, что средние значения уровня СОЭ и лейкоцитов у пациенток через 6–12 ч, 72–96 ч и на 5–7-е сутки после операции остаются ниже при АПК в сравнении с БПК. По-видимому, одной из причин таких изменений в клиническом анализе крови может быть токсическое воздействие повышенного уровня продуктов деструкции ткани [9, 10] .
Для систематизации полученных результатов и установления между ними взаимосвязи была разработана балльная шкала оценки травматичности оперативного вмешательства при лечении ДОЯ. Выделены три уровня повреждения: низкая степень травматичности (от 0 до 4 баллов), средняя степень (от 5 до 9 баллов), высокая степень (более 10 баллов) (табл. 1).
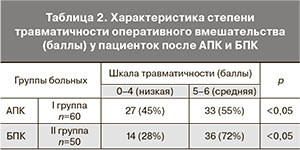
Результаты сравнительной характеристики степени травматичности оперативного вмешательства (баллы) у больных после АПК и БПК представлены в табл. 2.
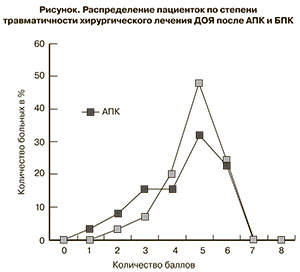
При АПК у пациенток с ДОЯ низкая степень травматичности отмечалась у 27 (45%) пациенток и средняя – у 33 (55%) пациенток (p<0,05), при применении БПК – у 14 (28%) и 36 (72%) пациенток соответственно (p<0,05). Таким образом, количество пациенток с низкой степенью травматичности при АПК больше, чем при БПК в 1,6 раза, а со средней – меньше, чем при БПК в 1,3 раза. Распределение пациенток по степени травматичности хирургического лечения ДОЯ после АПК и БПК представлено на рисунке.
Выводы
Разработана и апробирована бальная шкала оценки травматичности оперативного вмешательства при лечении ДОЯ, позволяющая на основании клинических и лабораторных критериев проводить оценку агрессивности хирургического лечения.
Анализ травматичности лапароскопического вмешательства у больных с ДОЯ с использованием разработанной шкалы показал, что АПК при оптимальном использовании протокола менее травматична (агрессивна) по сравнению с БПК.