Полипы эндометрия (ПЭ) являются наиболее распространенной формой патологии эндометрия, ассоциированной с аномальными маточными кровотечениями (АМК), бесплодием и риском малигнизации [1–4]. Одной из наиболее важных проблем, связанных с ПЭ, остается высокая частота рецидивов, которая, по разным данным, варьирует от 13 до 59,9% [4–6]. Повторные хирургические вмешательства повышают риск формирования внутриматочных синехий, бесплодия и снижают качество жизни женщин. Вероятность рецидивов ПЭ зависит, прежде всего, от способа их удаления и квалификации хирурга. Традиционная гистероскопия и кюретаж эндометрия не позволяют полностью удалить сосудистую ножку ПЭ, что нередко приводит к повторному возникновению заболевания [1, 2, 7]. В настоящее время методом выбора оперативного вмешательства является гистерорезектоскопическая полипэктомия, обеспечивающая аблацию основания ПЭ [1, 2, 7]. Однако данный метод также не гарантирует стойкий терапевтический эффект, частота рецидивов может достигать 13,3–20,9% [6–7]. Остается неясным тот факт, образуются ли ПЭ на прежнем месте или возникают de novo, как это наблюдается после удаления миоматозных узлов [8]. Для получения максимального эффекта от хирургического лечения в постменопаузе при ПЭ зачастую дополнительно проводят аблацию эндометрия, однако этот метод не может быть рекомендован женщинам репродуктивного возраста с нереализованной генеративной функцией. Понятно также, что хирургическое лечение не приводит к элиминации этиологического фактора и не оказывает влияния на механизмы формирования ПЭ [7]. С этих позиций представляется актуальным дальнейший поиск патогенетически обоснованных методов вторичной профилактики ПЭ.
До настоящего времени вопрос о гормональной зависимости ПЭ остается дискуссионным. Ранее было проведено достаточное число исследований, направленных на изучение экспрессии рецепторов к эстрогенам (ЭР) и прогестерону (ПР) в ПЭ, однако их результаты оказались во многом противоречивыми. По данным одних авторов, в ПЭ имеется повышение экспрессии ЭР [9–12], по данным других – снижение [13, 14]. Разноречивость данных касается и ПР – их уровень в ПЭ может быть как повышенным [10–12], так и сниженным [13, 15]. Указанные противоречия могут быть обусловлены тем, что оценка экспрессии гормональных рецепторов проводилась без учета их изоформ, воздействие на которые приводит к разнонаправленным эффектам на эндометрий. Так, ЭР-α опосредует пролиферативное действие, а ЭР-β – антипролиферативное [16–18]. Индукция ПР-А ассоциирована с секреторной трансформацией и децидуализацией эндометрия, тогда как индукция ПР-В – с пролиферацией [17, 19, 20]. Однако исследования по изучению экспрессии различных изоформ стероидных рецепторов в ПЭ крайне малочисленны. Косвенным доказательством роли половых стероидов в генезе ПЭ могут быть сведения о повышении частоты их возникновения в 5–7 раз на фоне адъювантной терапии рака молочной железы тамоксифеном, который оказывает эстрогенный эффект на эндометрий [21, 22]. По данным ряда метаанализов, применение внутриматочной системы с левоноргестрелом (ЛНГ-ВМС) снижает вероятность развития как гиперплазии эндометрия, так и ПЭ у пациенток, получающих терапию тамоксифеном [21, 22]. Однако вопрос о профилактике рецидивов ПЭ, не ассоциированных с приемом тамоксифена, остается нерешенным, в связи с чем проведение исследований в этом направлении представляется перспективным как с научной, так и с практической точки зрения.
Цель данного исследования – изучение экспрессии различных изоформ рецепторов к половым стероидам в ПЭ и эффективности применения ЛНГ-ВМС как метода профилактики их рецидивов.
Материалы и методы
В исследование включены 150 женщин в возрасте от 20 до 50 лет (средний возраст 35,6 (7,0) года), которым была произведена гистероскопия с биопсией эндометрия по поводу АМК, бесплодия или подозрения на патологию эндометрия по данным ультразвукового исследования (УЗИ). В основную группу были включены 130 пациенток с гистологически подтвержденным диагнозом ПЭ (средний возраст 35,5 (6,7) года). Согласно результатам гистологического исследования, в 108 случаях ПЭ были охарактеризованы как железисто-фиброзные, значительно реже – как железистые (n=15) или фиброзные (n=7). Наиболее часто ПЭ выявлялись на фоне неизмененного эндометрия стадии пролиферации (СтП) (n=91), в 32 случаях – на фоне хронического эндометрита и в 7 – на фоне гиперплазии эндометрия. Группу контроля составили 20 женщин (средний возраст 36,4 (6,1) года) с эндометрием СтП без морфологических признаков патологии и клинической симптоматики. В исследование не включались пациентки, принимавшие гормонотерапию в течение 3 месяцев, предшествующих оперативному лечению, а также с онкологической и тяжелой экстрагенитальной патологией. В качестве вторичной профилактики 27 женщинам с ПЭ на фоне гиперплазии эндометрия, а также нуждающимся в контрацепции (средний возраст 34,9 (7,0) года) была введена ЛНГ-ВМС (Мирена), остальные 103 пациентки (средний возраст 34,8 (7,2) года) терапию не получали. Для определения частоты рецидивов ПЭ проводился динамический ультразвуковой мониторинг состояния эндометрия 1 раз в 6 месяцев в течение 12 месяцев. Для оценки состояния слизистой оболочки матки после 12 месяцев терапии пациенткам была выполнена аспирационная биопсия эндометрия при помощи аспирационных кюреток Пайпель де Корнье без предварительного извлечения ЛНГ-ВМС. В 2 случаях в связи с возникшими затруднениями ЛНГ-ВМС была извлечена и введена повторно после получения патоморфологического заключения об отсутствии патологии эндометрия.
Сравнительная оценка клинико-анамнестических данных пациенток групп, получавших и не получавших терапию, не выявила существенных различий по возрасту, индексу массы тела, паритету, наличию АМК, сопутствующим гинекологическим заболеваниям, диаметру, числу и гистологической характеристике ПЭ.
Для оценки роли различных изоформ стероидных рецепторов в формировании ПЭ иммуногистохимическим (ИГХ) методом был произведен анализ экспрессии ЭР-α, ЭР-β, ПР-А, ПР-В в 20 образцах железисто-фиброзных ПЭ на фоне стадии пролиферации, в 20 образцах эндометрия СтП и в 15 образцах эндометрия после 12 месяцев воздействия ЛНГ-ВМС. ИГХ-исследование проводили при помощи набора Tissue-Tek Quick-Ray (Unitma, Корея). ИГХ-реакции проводились на парафиновых срезах толщиной 4 мкм, расположенных на стеклах, покрытых L-полизином, по стандартной методике с использованием иммуногистостейнера Ventana Ultra. В качестве первичных антител использовали мышиные моноклональные антитела к ЭР-α (клон ab75635, RTU, Abcam), ЭР-β (клон ab3576, RTU, Abcam), ПР-А (клон 1E2, RTU, Ventana) и ПР-В (клон C1A2, 1:100, Cell Signaling). Экспрессию стероидных рецепторов оценивали с использованием H-Score. Положительная ИГХ-реакция окрашивания ЭР-α, ЭР-β и ПР-А, ПР-В в образцах ПЭ и эндометрии проявлялась в виде коричневого окрашивания ядер железистых и эпителиальных клеток. Уровни экспрессии оценивались как в железах, так и в строме.
Статистическая обработка данных проводилась с помощью программы Statistica 10.0. Для определения статистической значимости различий использовался метод Манна–Уитни. Данные представлены в виде медианы (Me) и квартилей 25 (Q1) и 75 процентиля (Q3). При оценке статистической значимости различий экспрессии различных изоформ рецепторов при ПЭ, СтП и ЛНГ-ВМС проводилось попарное сравнение указанных групп методом Манна–Уитни. При описании возраста включенных в исследование пациенток данные представлены в виде среднего арифметического (М) и стандартного отклонения (SD). Для качественных признаков данные представлены в виде абсолютного числа и доли в процентах (n (%)). Для оценки статистической значимости различий долей применялся тест χ2 Пирсона. Статистически значимыми считались различия данных при р<0,05.
Результаты
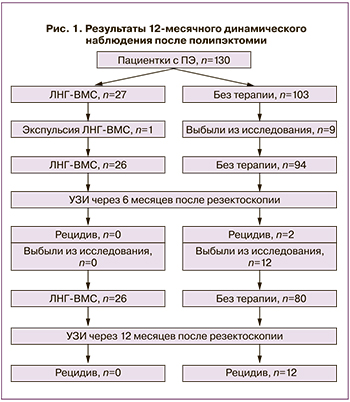 Результаты 12-месячного наблюдения за 130 пациентками после произведенной полипэктомии схематично представлены на рис. 1. Как видно, в течение первых 6 месяцев из группы женщин, не получавших гормонотерапию, были исключены 9: 3 – в связи с наступившей беременностью, 1 – в связи со вступлением в программу ЭКО и еще 5 выбыли по неустановленным причинам. У одной пациентки через 2 месяца была отмечена экспульсия ЛНГ-ВМС. С учетом приведенных данных, контрольное УЗИ через 6 месяцев после полипэктомии было проведено 26 пациенткам с ЛНГ-ВМС и 94 – без терапии. У 2 (2,1%) пациенток контрольной группы были обнаружены эхографические признаки ПЭ, при этом одна из них предъявляла жалобы на рецидив обильных менструальных кровотечений, что составило 1,1%. Среди остальных пациенток этой группы АМК не отмечалось. В группе ЛНГ-ВМС 8 (30,76%) пациенток предъявляли жалобы на незначительные ациклические кровянистые выделения из половых путей в течение первых 6 месяцев после введения. Рецидивов в указанной группе не отмечено, толщина М-эхо варьировала от 0,2 до 0,5 см.
Результаты 12-месячного наблюдения за 130 пациентками после произведенной полипэктомии схематично представлены на рис. 1. Как видно, в течение первых 6 месяцев из группы женщин, не получавших гормонотерапию, были исключены 9: 3 – в связи с наступившей беременностью, 1 – в связи со вступлением в программу ЭКО и еще 5 выбыли по неустановленным причинам. У одной пациентки через 2 месяца была отмечена экспульсия ЛНГ-ВМС. С учетом приведенных данных, контрольное УЗИ через 6 месяцев после полипэктомии было проведено 26 пациенткам с ЛНГ-ВМС и 94 – без терапии. У 2 (2,1%) пациенток контрольной группы были обнаружены эхографические признаки ПЭ, при этом одна из них предъявляла жалобы на рецидив обильных менструальных кровотечений, что составило 1,1%. Среди остальных пациенток этой группы АМК не отмечалось. В группе ЛНГ-ВМС 8 (30,76%) пациенток предъявляли жалобы на незначительные ациклические кровянистые выделения из половых путей в течение первых 6 месяцев после введения. Рецидивов в указанной группе не отмечено, толщина М-эхо варьировала от 0,2 до 0,5 см.
В течение последующих 6 месяцев в группе без гормонотерапии 9 женщин сообщили о наступившей беременности, 1 вступила в программу ЭКО и 2 выбыли из исследования по неизвестным причинам. С учетом этого, через 12 месяцев УЗИ было проведено 80 женщинам, не получавшим терапию, и 26 пациенткам с ЛНГ-ВМС. В группе без терапии выявлено еще 12 рецидивов ПЭ (15%), из них в 5 (6,1%) случаях пациентки предъявили жалобы на обильные менструации, в 3 (3,7%) – отмечали ациклические кровянистые выделения. В группе ЛНГ-ВМС 3 (11,5%) пациентки сообщили о периодических скудных кровянистых выделениях, при этом признаков внутриматочной патологии по УЗИ выявлено не было, толщина М-эхо составила 0,2–0,4 см. Общее число рецидивов в течение 12 месяцев наблюдения среди женщин, не получавших гормонотерапию, составило 14 (17,1%), в группе ЛНГ-ВМС рецидивов не было. Согласно гистологическому заключению, во всех образцах эндометрия после 12 месяцев терапии отмечались атрофические изменения, децидуальноподобная реакция стромы и железы, выстланные эпителием, без признаков функциональной активности.
Результаты ИГХ-анализа стероидных рецепторов в образцах ПЭ, СтП, а также в биоптатах эндометрия после 12 месяцев воздействия ЛНГ-ВМС представлены в таблице. Уровни экспрессии ЭР-α как в железах, так и в строме были практически равными в ПЭ и в эндометрии СтП. Экспрессия рецептора ЭР-β, опосредующего антипролиферативный эффект, в ПЭ оказалась ниже, чем в неизмененном эндометрии в железистом и стромальном компонентах (р=0,01; р=0,04).
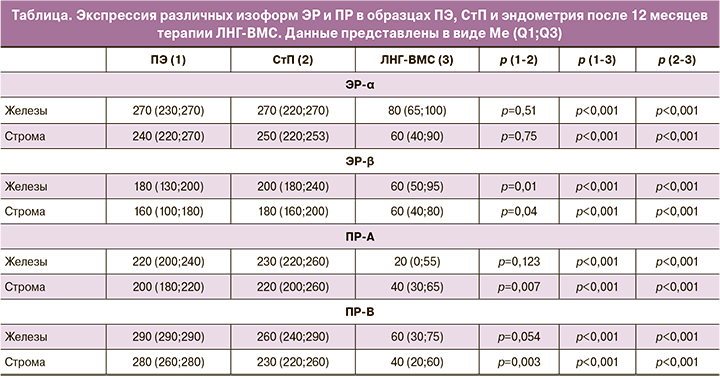
Средний уровень экспрессии ПР-А, осуществляющего секреторную трансформацию и децидуализацию, в железах ПЭ оказался схожим с таковым в СтП, при этом в стромальном компоненте был существенно ниже (р=0,007). Экспрессия ПР-В, опосредующего индукцию пролиферации, в стромальном компоненте ПЭ была значимо выше по сравнению со СтП (р=0,003). В железах ПЭ также отмечено повышение экспрессии ПР-В, усиливающего пролиферацию, но указанные различия имели недостаточную статистическую значимость (р=0,054).
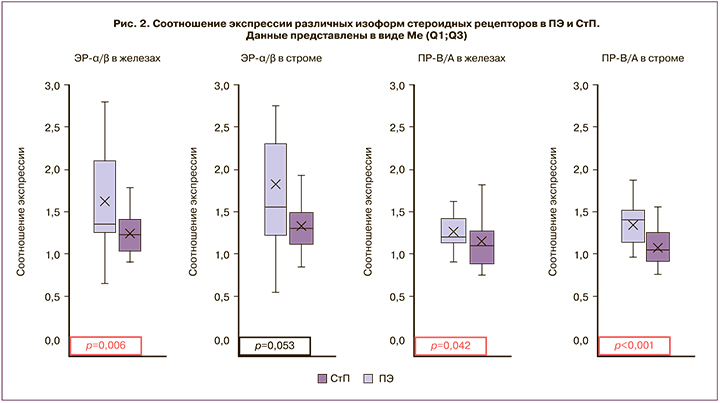
Дисбаланс рецепторов к половым стероидам отражен и в соотношении экспрессии изоформ, опосредующих разнонаправленное влияние на эндометрий: ЭР-α/ЭР-β и ПР-В/ПР-А (рис. 2). Соотношение экспрессии ЭР-α/β в железах ПЭ составило в среднем 1,4, что значимо выше, чем в железах эндометрия СтП – 1,2 (р=0,006). В стромальном компоненте ПЭ этот показатель также был выше по сравнению с неизмененным эндометрием – 1,6 и 1,3, однако статистически значимых различий обнаружено не было (р=0,053). Соотношение уровней экспрессии ПР-В/А оказалось выше в ПЭ, по сравнению со СтП, как в железистом, так и в стромальном компонентах исследованных образцов. В железах этот показатель составил 1,2 и 1,1 (р=0,04), а в строме – 1,4 и 1,1 (р<0,001) соответственно.
После 12 месяцев воздействия ЛНГ-ВМС экспрессия стероидных рецепторов была в значительной мере подавлена как в железистом, так и в стромальном компонентах эндометрия (таблица). Экспрессия ЭР-α оказалась ниже в 3,4 раза в железах и в 4 раза в строме, по сравнению с таковой до лечения, а уровень ЭР-β был понижен в 2,6 раза в железах и в 3 раза в строме. Еще более выраженные изменения были выявлены в отношении экспрессии ПР. А-изоформа оказалась ниже в 11 раз в железистом и в 5 раз – в стромальном компонентах. ПР-В продемонстрировал снижение в 4,8 раза в железах и 7 раз в строме.
Обсуждение
Несмотря на то что ПЭ являются наиболее распространенной формой внутриматочной патологии, механизмы, лежащие в основе их формирования и рецидивирования, остаются не вполне ясными. Одним из наиболее дискуссионных является вопрос о гормонозависимости ПЭ. В рамках данного исследования была предпринята попытка объяснить имеющиеся противоречия на основе более детального изучения рецепторного фенотипа эндометрия с учетом экспрессии различных изоформ ЭР и ПР.
Традиционное представление о том, что эстрогены усиливают пролиферацию, а гестагены обладают супрессивным влиянием на эндометрий, было сформировано еще в 1960-х гг. и существенно пересмотрено в конце XX в. ввиду открытия изоформ ЭР (α и β) и ПР (А и В), которые опосредуют разнонаправленное влияние гормонов на слизистую оболочку матки [16, 17]. В настоящее время известно, что стимуляция ЭР-α индуцирует ряд транскрипционных факторов (АР-1, SP-1, STAT5), регуляторов клеточного цикла (CEBPβ, циклин D1), ростовых сосудистых факторов (VEGF, CD105), сигнальных путей (NFκB, Wnt-путь), приводящих к усилению процессов пролиферации, ангиогенеза и малигнизации. Тогда как взаимодействие эстрогенов с ЭР-β, напротив, может ингибировать указанные факторы и сигнальные каскады [16, 17]. Это подтверждается исследованием Winuthayanon W et al., в котором на нокаутных по ЭР-α мышах было продемонстрировано, что длительное экзогенное влияние эстрадиола на оставшийся ЭР-β приводило не к пролиферации, а напротив, к усилению апоптоза и атрофии эндометрия [23].
Прогестерон также оказывает разнонаправленное действие: его связывание с ПР-А вызывает децидуализацию, секреторную трансформацию и индуцирует процесс апоптоза; тогда как ПР-В усиливает рост эндометрия за счет активации факторов транскрипции, регуляторов клеточного цикла, пролиферации, ангиогенеза (CEBPβ, Ki-67, HER2, NFκB, CYR61, VEGF) [17, 20, 24–26]. Способность ПР-В к индукции пролиферации была продемонстрирована в исследовании Mulac-Jericevic B. et al. на мышах, нокаутных по ПР-А. Отмечено, что при экзогенном введении эстрогенов наблюдалась умеренная пролиферация эндометрия; в то время как введение комбинации эстрогенов и гестагенов приводило к значительно более выраженному его росту. Авторы связывают данный эффект с дополнительной стимуляцией ПР-В в условиях отсутствия ПР-А-зависимой децидуализации и супрессии остальных рецепторов [19]. В настоящее время считается, что эффект половых стероидов на эндометрий зависит от соотношения изоформ рецепторов в тканях, даже при воздействии одного и того же лиганда [16, 17].
Результаты проведенного исследования продемонстрировали, что в ПЭ наблюдается повышение стромальной экспрессии ПР-В, стимуляция которого индуцирует пролиферацию слизистой оболочки матки, при снижении уровней рецепторов, обуславливающих супрессивное влияние на эндометрий: ЭР-β в железах и в строме, а также ПР-А в строме. Сходным образом некоторые авторы отмечают, что потеря протективного влияния ЭР-β является одним из механизмов, приводящих к формированию гиперплазии, рака эндометрия, а также рака молочных желез и яичников [16, 27]. Дисбаланс стероидных рецепторов наиболее наглядно продемонстрировало сравнение соотношения пролиферативных и антипролиферативных изоформ рецепторов. В ПЭ наблюдается превалирование экспрессии ЭР-α за счет снижения ЭР-β, что может приводить к локальной относительной гиперэстрогении, индуцирующей пролиферацию клеток эндометрия. Полученные результаты также свидетельствуют о превалировании ПР-В над ПР-А, что также может усиливать пролиферативную активность. Дисбаланс ЭР и ПР, отражающий избыточное пролиферативное и недостаточное супрессивное влияние на эндометрий, может приводить к активации ряда ростовых и ангиогенных факторов и лежать в основе формирования ПЭ [2, 12, 17, 28]. Полученные данные могут свидетельствовать о гормональной зависимости ПЭ, в связи с чем пациенткам, не заинтересованным в беременности, после полипэктомии была введена ЛНГ-ВМС. На фоне 12 месяцев терапии рецидивы ПЭ не наблюдались ни в одном случае; при этом экспрессия ЭР и ПР была существенно снижена по сравнению с исходными значениями. В группе пациенток, не получавших терапию, несмотря на ранее проведенную гистерорезектоскопию, частота рецидивов через 12 месяцев составила 17,1%, в первые 6 месяцев – 2,1%, в последующие – 15,0%. Это сходно с литературными данными о частоте, достигающей 13–20% [6, 7]. Полученные сведения о профилактическом эффекте ЛНГ-ВМС согласуются с результатами ряда метаанализов о снижении рисков развития ПЭ у пациенток, находящихся на адъювантной терапии тамоксифеном [21, 22]. Протективный эффект ЛНГ-ВМС можно объяснить подавлением экспрессии всех изоформ ЭР и ПР и снижением чувствительности эндометрия к гормональным воздействиям. Информации об ингибирующем влиянии ЛНГ-ВМС на экспрессию стероидных рецепторов в ПЭ в доступной литературе найти не удалось, однако подобный механизм лежит в основе лечебного эффекта ЛНГ при ряде других гинекологических заболеваний, например, гиперплазии эндометрия [29, 30]. Под действием ЛНГ-ВМС предотвращаются ЭР- и ПР-обусловленные реакции, приводящие к усилению пролиферации и ангиогенеза и способствующие формированию ПЭ.
Заключение
Результаты исследования позволяют сделать заключение, что одним из механизмов формирования ПЭ является дисбаланс изоформ ЭР и ПР, сопряженный со снижением супрессивного влияния и повышением пролиферативной активности эндометрия, что свидетельствует о гормоночувствительности данного заболевания. Рецидив ПЭ в течение первого года после резектоскопической полипэктомии можно ожидать у каждой 5–6-й пациентки, в то время как при воздействии ЛНГ-ВМС, на фоне супрессии всех изоформ ЭР и ПР, а также атрофии железистого эпителия рецидивов не наблюдается. В связи с этим введение ЛНГ-ВМС можно рассматривать в качестве перспективного метода вторичной профилактики ПЭ у женщин, не заинтересованных в беременности. Можно полагать, что проведение клинической апробации на большей выборке пациенток позволит валидировать данный метод и рекомендовать его внедрение в клиническую практику.



