Внимание многих ученых сегодня привлекает изучение особенностей маточно-плацентарной гемодинамики у пациенток с наследственными нарушениями соединительной ткани (ННСТ) [1]. Глубина вовлечения соединительной ткани в патологический процесс коллагенообразования репродуктивных органов и общие механизмы и закономерности определяют степень нарушений маточно-плацентарного комплекса. Известно, что зоной взаимного влияния считается децидуальная оболочка, которая в материнском организме посредством гормонов и рецепторов имеет тесный контакт с плодом через амниотическую полость и подлежащий миометрий. Метаболические, гормональные, иммунные процессы во время беременности обеспечиваются через сосудистую систему матери и плода, а перфузионное давление в капиллярах ворсин хориона стимулирует плацентарный ангиогенез. Патология маточно-плацентарного комплекса проявляется нарушением артериального притока крови в межворсинчатое пространство, затруднением венозного оттока крови из него и изменениями реологических и коагуляционных свойств крови матери и плода (гиперкоагуляция, гиперагрегация, нарушения вязкости крови) [2, 3]. При этом носительство протромбогенных аллельных полиморфизмов у женщин с ННСТ усугубляет склонность, как к формированию тромбозов, так и к неудачам беременности [4–8]. Возникающие гемореологические нарушения характеризуются обширными кровоизлияниямим и тромбозами межворсинчатого пространства плаценты, гиповаскуляризацией ворсин, очагами фиброза и массивными отложениями кальцификатов [9, 10].
Система гемостаза с момента нидации плодного яйца перестраивается в ответ на беременность. Отмечаются процессы, способствующие прикреплению бластоцисты и последующему развитию маточно-плацентарных взаимоотношений. В результате первой (в 5 недель) и второй (8 недель беременности) волны инвазии трофобласта децидуальные сегменты спиральных артерий замещаются прорастающим в них трофобластом и формирующимся фибриноидом. К концу I триместра беременности (3-я волна инвазии) клетки трофобласта, занимающие просвет спиральных артерий, покидают его, что сопровождается значительным притоком крови к межворсинчатому пространству. Трансформированные спиральные сосуды обеспечивают улучшение перфузии плаценты и, поскольку они лишены гладкомышечных клеток, то становятся неспособными реагировать на действие сосудосуживающих факторов, и в 14–20 недель трофобласт внедряется в стенки артериальных сосудов, расположенных в миометрии. Весь процесс гестационной сосудистой перестройки спиральных артерий матки завершается к концу 20-й недели беременности, обеспечивая тем самым в первой половине беременности последующее развитие плода [1, 11].
Известно, что уровень гормонов плаценты и плода – прогестерон, эстриол, PAPP-А (ассоциированный с беременностью протеин А плазмы), β-субъединица хорионического гонадотропина человека (β-ХГЧ), α-фетопротеин (АФП), отражает состояние не только самой плаценты и плода, но и состоятельность маточно-плацентарного кровотока. Однако ХГЧ способствует не только синтезу эстрогенов и прогестерона и влияет на функционирование желтого тела при беременности. Этот гликопротеин, наряду с PAPP-A и АФП, способствует также и торможению иммунологических реакций организма беременной путем индукции супрессорных Т-клеток, препятствуя отторжению плодного яйца. Наивысшего уровня β-ХГЧ достигает в 10 недель, после чего его концентрация уменьшается с повторным пиком в 32–34 недели [1]. Кроме того, в I триместре вневорсинчатый трофобласт, а в более поздние сроки – синцитиотрофобласт осуществляет основной синтез плацентарного лактогена (ПЛ), который способствует поддержанию желтого тела яичников при беременности и выработке им прогестерона, снижающего активность гладкой мускулатуры и стимулирующего рост матки, на фоне подавления реакции отторжения плодного яйца. При нехватке данного гормона во время беременности используются натуральные и синтетические прогестины, среди которых благоприятный эффект на метаболизм (антиандрогенный, антиминералокортикоидный) оказывает дидрогестерон [12]. «Парциальный» эффект синтетического прогестагена обусловлен взаимодействием с рецепторами других стероидных гормонов, что способствует сохранению беременности и улучшению маточно-плацентарного кровотока.
Функционирование фетоплацентарного комплекса характеризует также оценка концентрации эстриола (Е3) в сыворотке крови [13], который при беременности улучшает ток крови по сосудам матки, снижая их сопротивление. Но при этом функционирование сосудов плаценты неразрывно связано с уровнем АФП, оказывающего стимулирующее воздействие на рост и пролиферацию фибробластов и обладающего синергизмом по отношению к эпидермальному, трансформирующему и инсулиноподобному фактору роста, тем самым оказывая влияние на метаболизм стероидных гормонов [14].
Один из главных механизмов регуляции трансспецифических генов, в числе которых ген АФП, основан на межклеточных взаимодействиях, которые осуществляются через взаимодействие клетки со специфическим матриксом. В свою очередь, матрикс – межклеточное вещество, создаваемое клетками соединительной ткани, взаимодействует с рецепторами клеток, поддерживает их форму и способствует образованию тканеспецифических структур. В связи с вышеизложенным, актуальность изучения изменений в системе гемостаза и механизмов межклеточных взаимодействий и формирования плацентарных нарушений у пациенток с ННСТ несомненна, так как позволяет провести мероприятия по своевременному улучшению плацентарного кровотока.
Целью исследования явилось изучение особенностей системы гемостаза и плацентарных нарушений у пациенток с ННСТ в ранних сроках беременности.
Материал и методы исследования
Проспективно изучено течение беременности, особенностей системы гемостаза, уровня гормонов плазмы крови, эхографического и в последующем ретроспективно морфологического строения плаценты у 731 беременной в I триместре беременности. К критериям включения в группу обследования были отнесены наличие ННСТ, расстройства менструаций в пубертатном периоде (РМПП), возраст 18–24 года. Нами были сформированы 4 группы беременных пациенток для выявления роли ННСТ в генезе формирования плацентарных нарушений и тромботических осложнений беременности. Пациентки с ННСТ и РМПП в анамнезе (n=295) были включены в 1-ю группу, 2-я группа – пациентки с ННСТ и физиологическим ритмом менструаций с менархе (ФМ) (n=123), 3-я группа – пациентки без признаков ННСТ и с ФМ (n=240), 4-я группа – пациентки без ННСТ, но с РМПП в анамнезе (n=73). Критериями исключения были аномалии развития репродуктивных органов, синдром поликистозных яичников и хромосомные нарушения.
У пациенток групп сравнения во время беременности проведено молекулярно-генетическое исследование структуры протромбогенных аллельных генов 5, 10 – метилентетрагидрофолатредуктазы MTHFR (677T), ингибитора активатора плазминогена 1 типа PAI-1 (675 5G/4G), фактора V Лейден (Arg506Gln), фактора II протромбина (G20210A), генов, кодирующих функцию тромбоцитарных гликопротеинов, участвующих в тромбоцитарном гемостазе (GP1ba (VNTR), GpIa (С807T)-интегрин-α2)), GpIIIa(T1565C)-интегрин-бета-3)), (GP VI- тромбоцитарный гликопротеин 6 (С683Е)).
Для диагностики состояния синцитиотрофобласта определена концентрация гормонов фетоплацентарного комплекса в 10 недель беременности. Диагностика фенотипических и локомоторных проявлений ННСТ осуществлялась в ходе клинического обследования пациенток с учетом критериев выраженности дисплазии соединительной ткани [15].
Эхографические исследования проводились с использованием цветового и допплеровского картирования на аппаратах «TOSHIBA», «ACCUVIX» с вычислением индексов резистентности в автоматическом режиме при исследовании маточных артерий у пациенток во время беременности.
Статистическая обработка полученных данных проводилась с помощью пакета компьютерных программ Statistic 7.0. Использовался дисперсионный анализ для проверки статистических гипотез. Применялся парный двухвыборочный t-тест для средних. Описание выборки проводили с помощью подсчета среднего значения признака (M), стандартного отклонения (SD), медианы (Me). В случаях нормального распределения признаков, а также равенства выборочных дисперсий, для сравнения использовали t-критерий Стьюдента. Научно-исследовательский проект был утвержден 30.11.2009 г. (протокол № 10) и соответствовал этическим стандартам локального биоэтического комитета при ГБОУ ВПО Алтайский государственный медицинский университет Минздрава России. Все лица, участвующие в исследовании, их родители, подписали информированное согласие на участие в исследовании.
Результаты исследования
Репродуктивные потери в анамнезе (p<0,001) установлены наиболее часто у женщин с ННСТ и характеризовались самопроизвольными абортами (12,2 и 8,7%) и неразвивающейся беременностью (2,9 и 2,6%) в 1-й и 2-й группе соответственно по сравнению с 3-й группой, в которой потерь на ранних сроках беременности не было, а в 4-й группе самопроизвольные аборты выявлены в 8,3%. У 13,3% женщин с ННСТ из 1-й группы наблюдались осложненное течение беременности в виде склонности к тромбозам: преждевременная отслойка нормально расположенной плаценты, субхориальная гематома в I триместре беременности. Кроме того, наряду с клиническими проявлениями тромботических осложнений плацентарного русла, носительство протромбогенных аллельных полиморфизмов MTHFR(677Т), (G20210A), PAI-1(-675 5G/4G), (Arg506Gln) (p<0,0001) как предиктор риска возникновения тромбозов свидетельствовало в 1-й и 2-й группах о возможной реализации на фоне стрессорных факторов (беременности) активации свертывания крови, несмотря на геморрагические проявления в течение жизни у пациенток с ННСТ [16]. У каждой второй пациентки с дисплазией соединительной ткани (в 1-й и 2-й группе 57,1 и 50,0% соответственно) выявлены полиморфизмы генов, кодирующих функционирование тромбоцитарных гликопротеинов (интегринов), за счет которых происходит взаимодействие рецепторов тромбоцитов с тканевыми белками по сравнению (p<0,01) с пациентками 3-й группы без ННСТ, у которых частота таковых оказалась статистически меньше (25,0%). При этом отсутствие искомых аллельных полиморфизмов в три раза чаще (p<0,01) выявлено у женщин без признаков дисплазии в сравнении с пациентками, имевшими ННСТ.
Одной из причин осложненной беременности может быть неадекватный кровоток во внутриворсинчатом пространстве, последствия таких нарушений проявляются в виде спорадической потери беременности и привычного выкидыша [2]. С ранних сроков беременности у пациенток с ННСТ обнаружена взаимосвязь высокой частоты угрозы самопроизвольно выкидыша с аномалиями расположения плаценты. Невынашивание беременности у них нередко сопровождалось формированием субхориальной гематомы, что по современным представлениям расценивается как маркер тромбогенности плацентарного русла и результат ишемического нарушения кровоснабжения синцитиотрофобласта [11]. Эпизоды кровотечений и патологическое прикрепление плаценты оказались сопряжены с признаками дисплазии у беременных-носительниц протромбогенных генов белков свертывания крови. Каждая четвертая пациентка (24,5%) с ННСТ и РМПП имела признаки угрозы самопроизвольного выкидыша в раннем сроке беременности (p<0,0001) по сравнению с пациентками без ННСТ (6,0%). У 7,8% беременных с ННСТ и РМПП в ранних сроках наблюдалась отслойка хориона с формированием субхориальной гематомы, тогда как у пациенток без ННСТ данное осложнение во время беременности не выявлено.
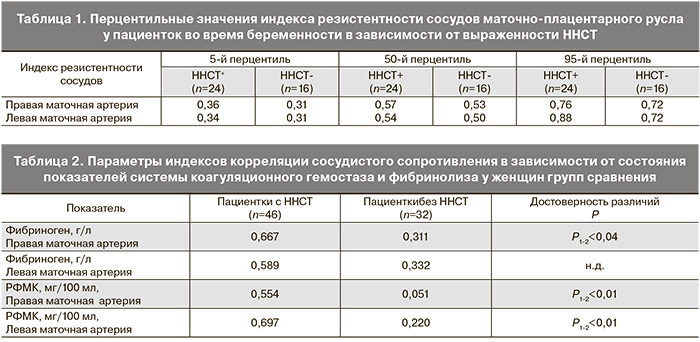
Астеники с миопическим нарушением зрения и пролабированием сердечных клапанов наиболее часто имели во время беременности субхориальную гематому. При этом две трети беременных из 1-й группы (p<0,0001) имели аномалии расположения плаценты в ранних сроках беременности в виде краевого или низкого прикрепления хориона в полости матки (67,3%) по сравнению с пациентками 3-й и 4-й групп (33,0 и 23,0% соответственно). В ходе исследования нами установлено, что эхографические показатели кровотока в маточных артериях у пациенток с ННСТ в I триместре беременности характеризовались повышенными значениями индекса резистентности, что свидетельствовало о низкой скорости кровотока и признаках вазоспазма в указанных сосудах (табл. 1).
Кроме того, увеличение индекса резистентности у пациенток с ННСТ оказалось взаимосвязанным с некоторыми показателями системы свертывания крови и фибринолиза (с уровнем фибриногена, растворимых фибрин-мономерных комплексов (РФМК)) и имело средней степени корреляционную зависимость (табл. 2). В предыдущих исследованиях нами установлено, что именно в ранние сроки беременности важную роль в формировании состояния тромботической готовности имеет избыточная генерация тромбина [17] – ключевого фермента гемокоагуляции, особенности образования которого решающим образом сказываются на исходах гемостатических и воспалительных реакций [18]. У женщин с ННСТ в ранних сроках гестации отмечено увеличение эндогенного тромбинового потенциала (ЭТП) по сравнению с беременными без признаков ННСТ. Так, генерация тромбина была ускорена (p<0,02) у пациенток с ННСТ, что подтверждало увеличение параметров ЭТП в I триместре (1949,8±481,0 нмоль×мин) по сравнению беременными без ННСТ (1468,2±379,6 нмоль×мин). Для оценки состояния системы «мать-плацента» проведено определение концентрации прогестерона, синтезируемого в хорионе и децидуальной оболочке. Уменьшение значений β-ХГЧ, оказывающего стимулирующее воздействие на функциональную активность желтого тела и непрерывную продукцию прогестерона, привело к снижению уровней прогестерона, вырабатываемого децидуальной оболочкой, у беременных с ННСТ.
Средние значения прогестерона в первой группе оказались меньше по сравнению с пациентками без ННСТ (3340,0±958,1 нг/мл и 3500,0±1430,62 нг/мл), что свидетельствовало о недостаточной перфузии субэндометриальных слоев вследствие тромботической готовности сосудистого русла. Одновременно отмечено втрое большее повышение (p<0,02) уровня ПЛ в первой группе (1,532±1,730 мг/л) по сравнению с пациентками без признаков ННСТ (0,500±0,303 мг/л). Известно, что ПЛ поддерживает функционирование желтого тела яичников и секрецию прогестерона при беременности [1]. Компенсаторные механизмы в маточно-плацентарном комплексе с ранних сроков проявились у пациенток с ННСТ не только увеличением ПЛ, но и в 2-кратном повышении (p<0,05) Е3 (7,066±5,713 нмоль/л и 3,962±4,755 нмоль/л), который улучшает ток крови по сосудам матки во время беременности, снижая их сопротивление. Во время первой и второй волн инвазии трофобласта у беременных с ННСТ выявлены признаки повышенной тромботической готовности в кровеносном русле, которые ассоциировались со снижением значений β-ХГЧ по сравнению с женщинами без признаков дисплазии в 3-й и 4-й группах. Это подтверждало нарушение кровоснабжения сосудов эндометрия и трофобласта в ранних сроках беременности, и возможное снижение рецепторной чувствительности к гормонам фетоплацентарного комплекса.
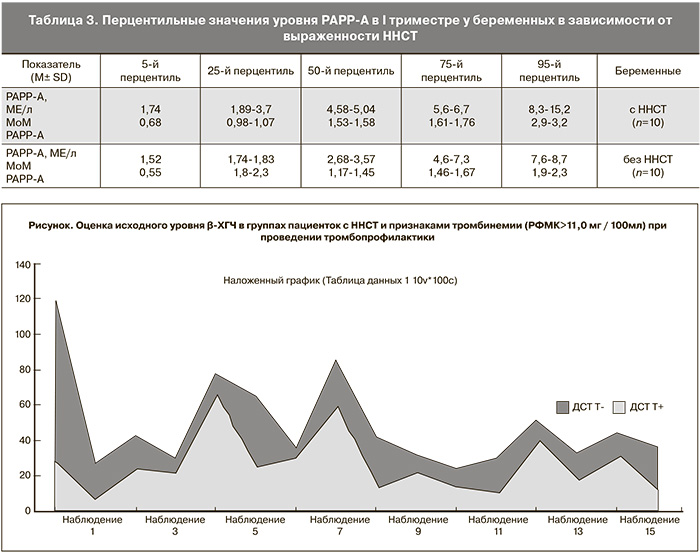
Пациентки с ННСТ, имеющие признаки тромбинемии в плазме крови, превышающей нормативные значения для I триместра беременности (РФМК>11,0 мг / 100 мл), получали тромбопрофилактику инъекционными препаратами низкомолекулярного гепарина в инъекционной или трансдермальной форме гепарина. На фоне применения тромбопрофилактики, способствующей снижению тромботической готовности маточно-плацентарного русла, уровень β-ХГЧ у них оказался выше (рисунок) по сравнению с пациентками, у которых тромбопрофилактика по различным причинам не проводилась (p<0,05). При этом наилучшим сочетанием оказалось применение препаратов низкомолекулярного гепарина фраксипарин (Nadroparini calcium) (SANOFI-WINTHROP INDUSTRIE, Франция) по 0,3 мл раствора (2850 МЕ) в сутки в течение 10–14 дней на фоне синтетического аналога прогестерона – дидрогестерона, не оказывающего прокоагулянтного воздействия на систему гемостаза у беременных. При сравнении параметров β-ХГЧ и PAPP-A в группах беременных при проведении тромбопрофилактики (p<0,001) оказалось, что использование препаратов гепарина способствовало повышению значений указанных гормонов у беременных с ННСТ соответственно (26,04±16,86 мМЕ/мл и 6,29±4,40МЕ/мл) по сравнению с беременными без тромбопрофилактики (22,05±18,89 мМЕ/мл и 3,94±2,18МЕ/мл), что являлось признаком улучшения кровотока в маточно-плацентарном русле. У пациенток, не применявших тромбопрофилактику, низкие значения β-ХГЧ явились косвенным подтверждением «обеднения» маточно-плацентарного кровотока и низкой стимуляции выработки β-ХГЧ вследствие нарушения кровоснабжения и перфузии субплацентарных-субэндометриальных слоев.
Изучение уровней гликопротеинов, участвующих в модуляции иммунного ответа (PAPP-А, АФП) у пациенток с ННСТ (табл. 3), показало, что перцентильные значения и МоМ (коэффициент отклонения значения от медианы) оказались выше у них по сравнению с беременными без ННСТ, что свидетельствовало о напряжении иммунологических механизмов у пациенток с ННСТ. Уровни корреляции параметров агрегационной активности тромбоцитов к коллагену и β-ХГЧ были идентично высокими в группах женщин с ННСТ (r=0,609) и без ННСТ (r=0,734), но при этом установлена взаимосвязь между МоМ PAPP-A у пациенток с ННСТ (r=0,657). В группе беременных без ННСТ такой закономерности не выявлено, и корреляционная зависимость между МоМ PAPP-A и агрегационной активностью тромбоцитов к коллагену оказалась слабой (r=0,333). Это может свидетельствовать о наличии у пациенток с ННСТ в ранних сроках беременности сочетания нарушений гемостаза и иммунологических дисфункций, в том числе и с вовлечением тромбоцитов, способствующих активации свертывающего каскада крови.
Заключение
Таким образом, у беременных с ННСТ изменения в системе гемостаза характеризуются повышенной тромботической готовностью крови с ранних сроков и ассоциируются с признаками первичной плацентарной недостаточности. Проведение медикаментозной тромбопрофилактики в сочетании с терапией дидрогестероном в I триместре беременности способствует улучшению функционирования маточно-плацентарного комплекса.



