Еще несколько лет назад синдром гиперстимуляции яичников (СГЯ) в программах экстракорпорального оплодотворения (ЭКО) встречался довольно часто и являлся грозным осложнением, требующим длительного стационарного лечения, а иногда, к счастью, довольно редко – приводящим к смерти молодых женщин. Несомненным достижением вспомогательных репродуктивных технологий явилась успешная борьба с этим осложнением, позволившая снизить частоту тяжелых форм СГЯ до минимальных значений, а именно до 0,5% (744 случая) по данным регистра РАРЧ за 2017 г. [1].
Обобщение клинического опыта привело к определению предикторов возможного СГЯ – уровня антимюллерова гормона (АМГ) и числа антральных фолликулов, а также к разработке эффективных мер профилактики – использованию схем стимуляции с небольшими дозами гонадотропинов в протоколе с антагонистом гонадотропин-рилизинг-гормона (антГнРГ), замене триггера овуляции, криоконсервации всех эмбрионов. Эти меры оказались реально эффективными и способствовали заметному снижению числа тяжелых и среднетяжелых форм СГЯ [2].
Долгое время обсуждали и использовали в клинической практике различные лекарственные препараты, способные осуществлять профилактику СГЯ, – альбумин, нестероидные противовоспалительные препараты, производные каберголина. Агонисты дофаминовых рецепторов широко применялись в клинической практике в течение последнего десятилетия. Механизм действия этих препаратов основан на снижении зависимой от сосудисто-эндотелиального фактора роста (VEGF) проницаемости сосудов путем ингибирования фосфорилирования и передачи сигналов к рецепторам VEGFR-2 [3]. В кохрейновском обзоре 2016 г., включающем 16 рандомизированных контролируемых исследований с участием 2091 женщины с высоким риском развития СГЯ, продемонстрирована эффективность назначения каберголина в профилактике умеренного или тяжелого СГЯ (ОШ 0,27, 95% ДИ 0,19–0,39; доказательства умеренного качества) без влияния на частоту имплантации и клинической беременности, а также частоту живорождений. Согласно этим данным, при условном риске тяжелого СГЯ у 29% женщин использование агонистов допамина позволяет снизить этот показатель до 7–14% [4]. Однако на сегодняшний день эффективность этих препаратов объективно не доказана, что отражено в клинических рекомендациях ESHRE 2019 г.
В последние годы при риске развития СГЯ и замене триггера овуляции назначают антГнРГ в дозе 0,25–0,5 мг со дня пункции яичников в течение 2–4 дней. Впервые о данном подходе сообщили Lainas et al. (2007) [5]. Клиницисты положительно отзываются об эффективности этой методики, указывая на то, что снижение уровней гормонов и менструация отмечаются в среднем на 6–7-й день после забора ооцитов.
Еще большую актуальность вопросы нивелирования гиперстимуляции, быстрого уменьшения размеров яичников и провоцирования менструации приобретают в случаях, когда речь идет о стимуляции яичников для предварительного забора и сохранения репродуктивного материала у онкологических больных. После трансвагинальной пункции больным предстоит химиотерапевтическое лечение, проводить которое нежелательно в условиях гиперстимулированных яичников, с точки зрения как степени гонадотоксичности, так и общего соматического статуса пациенток.
Ниже представлены два клинических случая, демонстрирующие быстрое купирование гиперстимуляции известным способом, а именно назначением антГнРГ и разработанной нами методикой применения ингибиторов ароматазы.
Клиническое наблюдение №1
Пациентка А.К., 30 лет, направлена онкологом с целью предварительного забора и криоконсервации репродуктивного материала перед планирующейся гонадотоксичной терапией. В декабре 2020 г. у пациентки диагностирован рак правой молочной железы T2N0M0 G3, IIA, Her2-, ki 65–85%. При генетическом обследовании мутации в генах BRCA1/ BRCA2 не обнаружены.
Проведен мультидисциплинарный консилиум с участием профильных специалистов репродуктологов, маммологов, онкологов. Учитывая молодой возраст женщины, желание в дальнейшем реализовать репродуктивную функцию и благоприятный прогноз выживаемости, по заключению онкологов решено провести стимуляцию яичников, забор ооцитов и их криоконсервацию. Все необходимые аспекты предстоящего лечения разъяснены пациентке, ею подписаны информированные согласия.
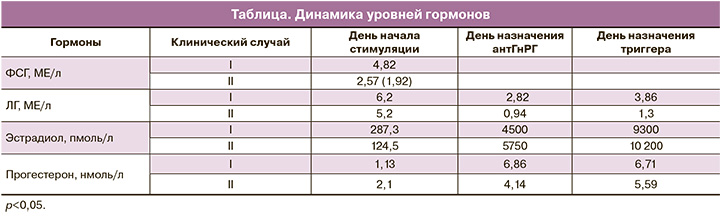
Результаты обследования, проведенного на 3-й день менструального цикла, показали высокие характеристики овариального резерва: уровни фолликулостимулирующего гормона (ФСГ) – 5,61 МЕ/л; лютеинизирующего гормона (ЛГ) – 10,98 МЕ/л; АМГ – 7,5 нг/мл; эстрадиола – 129,4 пмоль/л. При ультразвуковом исследовании констатировано наличие мультифолликулярных яичников размерами 4,1×2,2×3,7 см и 3,9×1,9×3,5 см; в каждом яичнике визуализировали 10–12 антральных фолликулов. Согласно международным рекомендациям по проведению стимуляции яичников у больных раком молочной железы, был назначен ингибитор ароматазы (летрозол 2,5 мг/сут). Стартовая доза гонадотропинов (рекомбинантный ФСГ) составила 225 МЕ/сут, учитывая антиэстрогенное влияние ингибиторов ароматазы. На 6-й день стимуляции назначен антГнРГ (цетротид) в дозе 0,25 мг/сут. На 10-й день контролируемой овариальной стимуляции назначен триггер финального созревания ооцитов. С целью снижения рисков развития СГЯ произведена замена триггера на агонист ГнРГ (диферелин 0,2 мг). Введение триггера осуществляли за 37 ч до трансвагинальной пункции фолликулов. В день назначения триггера овуляции размеры яичников составили 8,7×4,2×8,4 см и 8,9×4,5×8,6 см; в каждом из них визуализировались 10–12 фолликулов диаметром 17–21 мм. Аспирировано 30 фолликулов, получено 27 ооцитов, из них 23 зрелых.
В день трансвагинальной пункции с целью купирования СГЯ назначен антГнРГ (цетротид) в суточной дозе 0,5 мг.
На 6-й день после трансвагинальной пункции у женщины появились менструальноподобные кровяные выделения, что свидетельствовало о резком снижении уровня половых стероидов. Ультразвуковое исследование на момент начала кровяных выделений продемонстрировало выраженные явления лютеолиза и сокращения объема яичников до 5,5×6,3×5,2 см и 4,9×2,7×5,3 см.
Клиническое наблюдение №2
Пациентка Б.И., 32 лет, направлена онкологом с целью предварительного забора и криоконсервации репродуктивного материала перед планирующейся гонадотоксичной терапией. В мае 2020 г. у пациентки диагностирован рак правой молочной железы T2N0M0 G3, IIA, ER+, PR+. Her2-, ki 67–87%. Обращает на себя внимание семейный анамнез пациентки: у бабушки со стороны матери – рак молочной железы и рак кишечника, у мамы – рак молочной железы, у дедушки со стороны матери – лейкоз. При исследовании ДНК, выделенной из лимфоцитов периферической крови, выявлена герминальная мутация 5382incC в 1755 кодоне 20 экзона гена BRCA1 в гетерозиготной форме. Проведен мультидисциплинарный консилиум с участием профильных специалистов – репродуктологов, маммологов, онкологов. Учитывая молодой возраст женщины, желание в дальнейшем реализовать репродуктивную функцию и благоприятный прогноз выживаемости по заключению онкологов, решено провести стимуляцию яичников, забор ооцитов и их криоконсервацию. Все необходимые аспекты предстоящего лечения разъяснены пациентке, ею подписаны информированные согласия.
 Результаты обследования, проведенного на 5-й день менструального цикла, показали высокие характеристики овариального резерва: уровни ФСГ – 4,82 МЕ/л; ЛГ – 6,2 МЕ/л; АМГ – 10,18 нг/мл; эстрадиола – 287,3 пмоль/л. При ультразвуковом исследовании констатировано наличие мультифолликулярных яичников. Размеры яичников на момент начала стимуляции составили 4,5×2,1×3,2 см и 3,8×2,0×2,7 см. В каждом яичнике визуализировали 8–10 антральных фолликулов. Стимуляцию яичников проводили, как и в предыдущем случае, в протоколе с антГнРГ; начальная доза рекомбинантного ФСГ составила 225 Ме/сут; в протокол стимуляции включен летрозол в дозе 2,5 мг в сутки. На 10-й день контролируемой овариальной стимуляции назначен триггер финального созревания ооцитов – агонист ГнРГ (диферелин 0,2 мг). Введение триггера осуществляли за 37 ч до трансвагинальной пункции фолликулов. В преовуляторный период размеры яичников составили 9,0×4,3×7,3 см и 8,7×3,4×5,6 см. В каждом яичнике визуализировали 8–12 фолликулов. Аспирировано 32 фолликула, получено 28 ооцитов, из них 25 зрелых.
Результаты обследования, проведенного на 5-й день менструального цикла, показали высокие характеристики овариального резерва: уровни ФСГ – 4,82 МЕ/л; ЛГ – 6,2 МЕ/л; АМГ – 10,18 нг/мл; эстрадиола – 287,3 пмоль/л. При ультразвуковом исследовании констатировано наличие мультифолликулярных яичников. Размеры яичников на момент начала стимуляции составили 4,5×2,1×3,2 см и 3,8×2,0×2,7 см. В каждом яичнике визуализировали 8–10 антральных фолликулов. Стимуляцию яичников проводили, как и в предыдущем случае, в протоколе с антГнРГ; начальная доза рекомбинантного ФСГ составила 225 Ме/сут; в протокол стимуляции включен летрозол в дозе 2,5 мг в сутки. На 10-й день контролируемой овариальной стимуляции назначен триггер финального созревания ооцитов – агонист ГнРГ (диферелин 0,2 мг). Введение триггера осуществляли за 37 ч до трансвагинальной пункции фолликулов. В преовуляторный период размеры яичников составили 9,0×4,3×7,3 см и 8,7×3,4×5,6 см. В каждом яичнике визуализировали 8–12 фолликулов. Аспирировано 32 фолликула, получено 28 ооцитов, из них 25 зрелых.
В день трансвагинальной пункции с целью купирования СГЯ назначен ингибитор ароматазы (летрозол) в дозе 7,5 мг/сут. На 4-й день после трансвагинальной пункции пациентка отметила наличие менструальноподобных выделений. Ультразвуковое исследование на момент начала кровяных выделений продемонстрировало выраженные явления лютеолиза и сокращения объема яичников до 5,5×6,3×5,2 см.
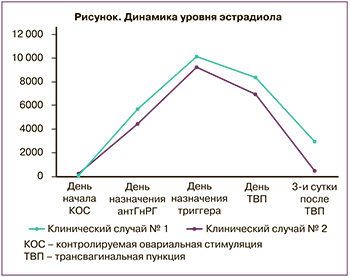
С целью оценки параметров стероидогенеза проводили анализ уровней эстрадиола и прогестерона в течение всего стимулированного цикла и после трансвагинальной пункции фолликулов (рисунок, таблица).
Представленные в таблице данные не продемонстрировали различий уровней гормонов в течение фолликулярной фазы индуцированного цикла, тогда как назначение ингибиторов ароматазы в лютеиновую фазу привело к быстрому, в течение 3 дней, снижению уровня эстрадиола, что манифестировалось закономерной менструальноподобной реакцией. При использовании антГнРГ подобные эффекты произошли лишь на 6-й день введения препарата (рисунок).
Обсуждение
Представленные клинические наблюдения продемонстрировали большую эффективность ингибиторов ароматазы для купирования гиперстимуляции яичников в аналогичных ситуациях. Эти наблюдения можно расценить как единичные; но мы имеем уже некоторый опыт, подтверждающий клиническую состоятельность назначения ингибиторов ароматазы. Во всех, пока еще немногочисленных, наблюдениях отмечены быстрое снижение уровней эстрадиола и прогестерона, уменьшение яичников и менструальное кровотечение через 3 дня после назначения препарата. Более того, механизм действия сравниваемых средств подтверждает мнение о возможном более выраженном клиническом эффекте ингибиторов ароматазы. Так, антГнРГ действуют в первую очередь на гипоталамо-гипофизарную систему, блокируют выработку гонадотропинов, поддерживающих, как считается, функцию желтого тела. Но только этим механизмом вряд ли можно объяснить снижение уровня половых стероидов и уменьшение размеров яичников, т.к. желтые тела, особенно в ситуации гиперстимуляции, являются в значительной степени автономными структурами. Изучая этот вопрос, исследователи пришли к выводам о наличии у антГнРГ периферического влияния путем взаимодействия с рецепторами ГнРГ в гранулезо-лютеиновых клетках яичника [4, 5]. Было показано, что экспрессия мРНК и белка для VEGF и рецептора VEGF снижается в культивируемых гранулезо-лютеиновых клетках приматов и человека при введении антагониста ГнРГ [6–8]. Тaylor et al. (2004) сообщили об использовании антГнРГ в лютеиновой фазе для быстрого лютеолиза у пациентов с раком, требующих овариальной стимуляции для сохранения генетического материала. Авторы отметили быстрое снижение уровня прогестерона в начале менструации через 2–4 дня после введения антГнРГ [9]. Сравнивая механизмы естественного лютеолиза и вызванного введением антГнРГ, Del Canto et al. сообщили о различиях этих двух механизмов. Таким образом, лютеолиз под воздействием антГнРГ осуществляется путем быстрого уменьшения уровней вазоактивных цитокинов, прежде всего VEGF, продуцируемых желтым телом [10, 11]. Этим механизмом в большей степени можно объяснить эффекты антГнРГ в отношении гиперстимулированного яичника. Что касается ингибиторов ароматазы, то они действуют непосредственно на внутрияичниковый стероидогенез, блокируют ароматазную реакцию, в результате чего андростендион не конвертируется в эстрогены, и уровни эстрогенов резко снижаются. Помимо этого, ингибиторы ароматазы также оказывают непосредственно влияние на экспрессию факторов ангиогенеза. На экспериментальных моделях было показано, что однократное добавление летрозола в день введения триггера снижает как размер яичников, так и уровень VEGF, повышая при этом уровень PEDF (пигментный фактор эпителиального происхождения) [12]. Интересно отметить наблюдение Haas et al., который, напротив, обнаружил повышение экспрессии как VEGF, так и PEDF в фолликулярной жидкости пациенток, которым проводилась стимуляция яичников под прикрытием ингибиторов ароматазы [13]. Данный факт позволяет нам делать первоначальные выводы о том, что добавление ингибиторов ароматазы к гонадотропинам во время овариальной стимуляции не профилактирует развитие СГЯ. В то же время добавление летрозола в больших дозах непосредственно в день трансвагинальной пункции и в первые несколько суток после нее позволяет в значительно более ускоренном режиме «обрушить» уровни половых стероидов.
Тем не менее неясным является вопрос о необходимых дозах и длительности введения того или иного препарата. На сегодняшний день их назначают эмпирически. Возможно, назначение препаратов в дозах, зависящих от степени гиперстимуляции, нивелирует разницу в эффектах двух препаратов.
Заключение
Представленные клинические наблюдения, показывающие эффективность применения ингибиторов ароматазы для быстрого купирования симптомов гиперстимуляции, являются интересными и требующими дальнейших исследований. Нельзя не отметить, что такой способ является более экономичным по сравнению с антГнРГ. Так, стоимость одной упаковки антГнРГ (цетротид) составляет около 9000 рублей, стоимость ингибитора ароматазы (летрозол) – не более 2500 рублей.



