Ресвератрол (3,5,4'-тригидроксистильбен) представляет собой полифенол, который проявляет значительную биологическую активность и является одним из самых известных и наиболее изученных полифенолов, встречающихся в природе. Ресвератрол образуется из фенилаланина и существует в двух изомерных формах: транс- и цис-ресвератрола. Биодоступность транс‐формы выше относительно цис‐формы. Кроме того, транс‐изомер является преобладающей и более стерически стабильной формой. Ресвератрол всегда был хорошо известен во врачебном сообществе как антиоксидант, действующий путем предотвращения образования свободных радикалов и блокирующий каскад патологических механизмов оксидативного стресса. Различные клинические исследования показали, что антиоксидантные свойства ресвератрола выше, чем у витаминов. Однако в последнее время все более актуальными становятся данные об эстрогеноподобных свойствах ресвератрола. Так, он был охарактеризован как фитоэстроген на основании его способности связываться как с альфа-, так и с бета-эстрогеновыми рецепторами, а следовательно, обладать более широким спектром действия по сравнению с другими фитоэстрогенами [1]. Благодаря своему механизму действия ресвератрол обладает рядом преимуществ именно в менопаузальный период, когда необходима компенсация дефицита эстрогенов. Мощное эстрогеноподобное действие ресвератрола проявляется в положительных эффектах при многих расстройствах, связанных с основными проявлениями климактерического синдрома, включая приливы и снижение минеральной плотности костной ткани [2]. Кроме того, доклинические данные показывают, что ресвератрол может стимулировать пролиферацию и дифференцировку костных клеток и подавлять апоптоз хондроцитов за счет противовоспалительных механизмов.
Ресвератрол относится к стильбенам, одному из основных классов фитоэстрогенов, которые представляют собой семейство разнообразных полифенольных соединений (табл. 1. [3]), полученных из растений, которые структурно или функционально имитируют эффект эстрогена в репродуктивной системе млекопитающих. Поэтому фитоэстрогены широко применяются в гинекологической практике в качестве альтернативы менопаузальной гормональной терапии (МГТ) при климактерическом синдроме [4].


Однако эффект фитоэстрогенов не ограничивается влиянием на эстрогенные сигналы, они могут также влиять на ряд физиологических и патологических процессов и быть полезными для профилактики и лечения симптомов менопаузы, старения кожи, остеопороза, некоторых онкологических, сердечно-сосудистых, нейродегенеративных, иммунных и метаболических заболеваний [5].
Растения синтезируют ресвератрол и другие стильбены в ответ на стрессовые условия, включая ультрафиолетовое облучение, экстремальные температуры, механические повреждения и активность микроорганизмов, таких как грибы и бактерии. Поэтому ресвератрол первоначально был охарактеризован как фитоалексин из-за его фунгицидного действия, и только позже был оценен широкий спектр его биологической активности, значимой для профилактики и лечения различных заболеваний [6].
В перечень фармакологических эффектов ресвератрола входят: эстрогенное/антиэстрогенное, противовоспалительное, антиоксидантное, репаративное, противоопухолевое, противовозрастное и др. [7]. Наиболее изученными и представляющими практический интерес являются: эстрогеноподобный эффект, который заключается в снижении проявления менопаузальных расстройств и положительном действии на костный метаболизм; антиоксидантный, основывающийся на торможении реакции перекисного окисления, и антивозрастной – реализующийся в потенциальном положительном влиянии на продолжительность жизни [8]. Эстрогеноподобный эффект крайне важен еще и потому, что разные ткани, не относящиеся к репродуктивному тракту, содержат эстрогеновые рецепторы (ЭР). В частности, эффекты ресвератрола на ЭР включают противовоспалительные действия, такие как защита от травмы, вызванной кровотечением, и подавление экспрессии интерлейкина-6 (IL-6) в печени, кишечнике и сердечно-сосудистой системе. Кроме того, активно исследуется потенциальная роль ресвератрола в терапии ряда заболеваний, таких как сахарный диабет, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), ожирение, онкологические, сердечно-сосудистые и многие другие заболевания.
Фармакокинетика ресвератрола
Ресвератрол отличается рядом фармакокинетических характеристик (низкая растворимость в воде и вариабельная биодоступность), которые ограничивают его клиническое использование.
Стабильность обеих изоформ ресвератрола и растворимость в воде зависят от pH и температуры [9]. Так, растворимость ресвератрола при pH 1,2 составляет 64 мкг/мл, тогда как она становится 61 и 50 мкг/мл при pH 6,8 и 7,4 соответственно. После растворения в воде ресвератрол стабилен при комнатной температуре или температуре тела только в кислой среде; с повышением pH стильбен деградирует экспоненциально.
В кислой среде желудка ресвератрол может быть гидролизован до олигомерных фенолов и/или подвергаться изомериизации. Кроме того, гликозилирование резидентными бактериями приводит к появлению ресвератрол-3-O-бета-глюкозида, который может всасываться в кишечнике [10]. Модификация ресвератрола также может происходить в кишечнике и печени в результате реакции конъюгации. Кишечные бактерии могут расщеплять ресвератрол на бензойную, фенилуксусную и пропионовую кислоты, в то время как в печени он подвергается метаболизму фазы II с образованием глюкуронидов, сульфатов и метилированных продуктов, которые, как известно, сохраняют часть биологической активности родительского соединения [11]. Интересно, что ресвератрол может активировать свой собственный метаболизм за счет индукции ферментов печеночной фазы II.
После перорального приема ресвератрол абсорбируется кишечным эпителием путем пассивной диффузии или мембранными переносчиками, а затем высвобождается в кровоток, где обнаруживается как в неизмененном виде, так и в виде метаболитов. Фактически в кишечнике это соединение претерпевает пресистемный метаболизм за счет глюкуронизации и сульфатной конъюгации фенольных групп и гидрирования алифатической двойной связи [12].
В кровотоке ресвератрол связывается с транспортерами, такими как интегрины, альбумины и липопротеины низкой плотности (ЛПНП), образуя комплексы, которые, в свою очередь, могут диссоциировать на клеточной мембране, где альбумин и ЛПНП взаимодействуют с соответствующими рецепторами, обеспечивая транспорт ресвератрола в клетки [13]. Образование комплексов с белками и ЛПНП плазмы повышает стабильность ресвератрола, поскольку транспортные белки плазмы могут действовать как естественные in vivo резервуары. Данные комплексы способствуют проникновению ресвератрола в различные ткани. В кровотоке альбумин имеет решающее значение для связывания, транспортировки, стимулирования клеточной абсорбции и распределения ресвератрола по клеткам-мишеням.
Основной метаболизм фазы II ресвератрола и его метаболитов происходит в печени. В моче обнаружено пять метаболитов: моносульфат, две изомерные формы моноглюкуронида, дигидроресвератрола моносульфат и дигидроресвератрола моноглюкуронид [14]. Большинство метаболитов ресвератрола в плазме имеют очень низкую биологическую активность [15]. Чрезвычайно быстрая конъюгация сульфата кишечником/печенью, по-видимому, является лимитирующей стадией биодоступности ресвератрола. Сульфаты и глюкурониды могут превращаться в ресвератрол в тканях-мишенях (печень). Кроме того, метаболиты ресвератрола подвергаются энтерогепатической рециркуляции. Период полувыведения и концентрация метаболитов ресвератрола в плазме крови в 10 раз выше, чем нативного соединения [16].
Концентрация неизмененного ресвератрола в плазме зависит от дозы. Пероральная доза 25 мг ресвератрола приводила к концентрации в плазме неизмененной молекулы в следовых количествах – в диапазоне от 1 до 5 нг/мл [17]. Введение более высоких доз (до 5 г) приводило к непропорциональному увеличению концентрации неизмененной молекулы до 530 нг/мл [18]. Это объясняет тот факт, что прием более высоких пероральных доз не решает вопрос повышения выраженности эффектов ресвератрола, но может вызвать такие побочные эффекты, как диарея, тошнота и боль в животе [19].
Так, было показано, что при дозах транс-ресвератрола выше 2500 мг возникают расстройство желудочно-кишечного тракта и диарея у здоровых людей, а также возможно обострение язв желудочно-кишечного тракта в эксперименте. Кроме того, существует озабоченность по поводу приема высоких доз транс-ресвератрола в определенных клинических группах населения. Суточная доза 5000 мг была связана с почечной недостаточностью у пациентов с множественной миеломой. Эти побочные эффекты ограничили пероральную дозу до 1000 мг в большинстве исследований на людях. На самом деле большинство доступных биологически активных добавок содержат менее 500 мг ресвератрола в пероральной форме.
По биофармацевтической классификации (BCS) ресвератрол относится ко второму классу веществ, характеризующихся низкой растворимостью в воде (~30 мг/л) и высокой проницаемостью через мембраны энтероцитов [20]. Эта классификация позволяет объяснить корреляции его растворения in vitro и биодоступности in vivo. Поскольку ресвератрол имеет ограниченную скорость растворения в водной среде, небольшое увеличение растворимости может значительно повысить его биодоступность [21]. В последнее десятилетие для повышения биодоступности ресвератрола были разработаны различные методологические подходы. К ним относится несколько систем доставки, таких как инкапсуляция в липидные наноносители или липосомы, эмульсии, мицеллы, введение в полимерные наночастицы, твердые дисперсии и нанокристаллы.
В частности, наноэмульсии позволяют повысить растворимость ресвератрола, придают стабильность фармацевтической форме, обеспечивают замедленное высвобождение действующего вещества, облегчают мембранный пассивный транспорт и клеточный захват. При этом наноэмульсии не проявляют цитотоксических свойств [22].
Влияние ресвератрола на проведение эстрогенного сигнала в клетке-мишени
Известными и основными внутриклеточными мишенями для ресвератрола выступают рецепторы эстрадиола, белки-сиртуины и активные формы кислорода.
Влияние ресвератрола на проведение эстрогенного сигнала опосредовано множеством биологических факторов. К ним относятся смешанное агонистическое и антагонистическое действия в отношении ЭР в разных тканях и органах, ингибирование ферментов стероидогенеза и модуляция ферментов и белков, важных для распределения эстрогенов и стероидов.
Одной из первых идентифицированных мишеней ресвератрола был ЭР, это еще одна из причин, по которой ресвератрол классифицирован как фитоэстроген. Поводом для начала исследования эстрогенных эффектов ресвератрола стало его структурное сходство с эстрогенами – природным 17b-эстрадиолом и синтетическим диэтилстильбэстролом. Кроме того, ресвератрол в доклинических исследованиях продемонстрировал некоторые эффекты эстрогенов. Например, кардиопротективное действие – давно известный и хорошо изученный биологический эффект эстрогенов. Ресвератрол связывается с обоими типами ядерных рецепторов эстрадиола (ЭРα и ЭРβ) со сравнимым аффинитетом, который примерно на 3 порядка ниже, чем у эстрадиола. Ресвератрол имеет сродство с небольшим предпочтением по отношению к изоформе ЭРβ, но оно значительно уступает по аффинитету естественным эстрогенам. Это контрастирует с данными, полученными для других фитоэстрогенов, которые связывают ЭРβ с более высоким сродством, чем ЭРα. Интересно, что синтетический эстроген диэтилстильбэстрол, который имеет структурную аналогию с ресвератролом, демонстрирует большее сродство к ЭРα [23].
ЭР принадлежит к семейству ядерных рецепторов, которое также включает рецепторы стероидов, витамина D, ретиноидов и пр. Естественными лигандами для ЭР являются наиболее эффективный 17b-эстрадиол (E2), эстрон (E1) и эстриол (E3). Активация ЭР этими лигандами вызывает в основном геномные эффекты, которые приводят к активации или репрессии транскрипции зависимых генов. Идентифицирован и мембранный рецептор эстрогенов, связанный с G-белком, который опосредует быстрые негеномные клеточные ответы (изменения активности регуляторных белков) на эстрадиол. У млекопитающих существует две изоформы ЭР, которые обозначены как ЭРα и ЭРβ. Они имеют низкую (около 60%) гомологию в гормонсвязывающем домене, что объясняет различное сродство данных подтипов к отдельным лигандам. Относительная экспрессия двух изоформ варьирует в разных тканях, и их активация эстрогеном может вызывать противоположные эффекты. Например, активация ЭРα увеличивает клеточную пролиферацию клеток эндометрия, тогда как активация ЭРβ тормозит эффекты ЭРα и подавляет пролиферацию [24]. Ресвератрол действует как агонист с некоторым преимуществом к ЭРβ, поэтому ткани, в которых преимущественно экспрессируются ЭРβ, более чувствительны к эстрогенной активности ресвератрола. В клетках ресвератрол в отсутствие E2 стимулирует экспрессию рецепторов прогестерона (ПР), но, когда клетки культивируют с обоими соединениями, ресвератрол снижает стимулированную E2 транскрипцию гена ПР. Исследователи пришли к выводу, что ресвератрол действует как частичный агонист, направление эффекта которого зависит от клеточного и тканевого контекста [7].
Таким образом, направленность эффекта ресвератрола зависит от присутствия эндогенных эстрогенов. В отсутствие эстрадиола он проявляет агонистическую активность (снижение симптомов дефицита эстрогенов в пери- и постменопаузе). Так, согласно данным рандомизированного контролируемого двойного-слепого исследования с перекрестным дизайном (n=50, 2012–2014 гг.) с использованием оценки по визуально-аналоговой шкале, сублингвальный транс-ресвератрол снижал количество и интенсивность умеренных и тяжелых вазомоторных эпизодов в переходный период у 78,6% пациентов (р<0,001) [25]. В присутствии эндогенных эстрогенов ресвератрол проявляет сдерживающее действие на чрезмерный эстрогенный сигнал.
Ресвератрол также подавляет метаболизм эстрогенов в печени и кишечнике и повышает в крови уровень глобулина, связывающего половые гормоны. Большинство этих эстрогенных эффектов выявлено in vitro при использовании микромолярных концентраций ресвератрола. Кроме того, ресвератрол взаимодействует с мембранным ЭР и модулирует негеномную эстрогенную активность. Существуют и косвенные механизмы влияния ресвератрола на эстрогенный сигнал – он вмешивается в стероидогенез и биосинтез эстрогена на нескольких уровнях.
Влияние ресвератрола на метаболизм стероидных гормонов
Скорость стероидогенеза в клетке определяется регуляторным белком StAR, контролирующим вход холестерина в митохондрии. Экспрессия StAR особенно высока в тканях гонад и надпочечников, где стероидогенез активен и регулируется клеточными уровнями циклического аденозинмонофосфата. Ресвератрол в микромолярных концентрациях замедляет биосинтез стероидных гормонов за счет подавления StAR и снижения митохондриального притока холестерина [26]. Ресвератрол подавляет каталитическую активность CYP17A1 в клетках карциномы надпочечников человека (H295R). Ароматаза (цитохром P45019, CYP19) катализирует заключительный этап биосинтеза эстрогенов – ароматизирует кольцо А в андрогенах. Снижение экспрессии ароматазы под действием ресвератрола приводит к снижению уровней и активности фермента в клетках [27]. Ресвератрол ингибирует сульфатирование E2 и образование катехолэстрогенов.
Трудно определить наиболее восприимчивую мишень к ресвератролу в сети ферментов и белков, регулирующих гомеостаз эстрогена и других стероидных гормонов. По-видимому, это метаболизм стероидов в печени. Вмешательство ресвератрола в метаболизм стероидных гормонов может вызвать повышение концентрации эстрогенов и других стероидов и усиление их центральных и периферических эффектов. Следовательно, к прямым эстрогенным эффектам ресвератрола, опосредованным взаимодействием с ЭР, добавляются косвенные эстрогенные эффекты на активность эстрогенного сигналинга.
Активный поиск дополнительных молекулярных мишеней ресвератрола за последние два десятилетия выявил широкий спектр клеточных эффектов, которые потенциально обеспечивают его пользу для здоровья. Например, исследования показали, что ресвератрол подавляет активность циклооксигеназы-1 и -2 (ЦОГ-1 и -2), рибонуклеотидредуктазы (RNR), ядерного фактора каппа B (NF-κB), передатчика сигнала и активатора транскрипции 3 (STAT3) и арилуглеводородного рецептора (AhR). С другой стороны, было показано, что ресвератрол активирует АМФ-активируемую протеинкиназу (AMPK), митоген-активированную протеинкиназу (MAPK), p53 и НАД-зависимую деацетилазу сиртуин-1 [28].
Ресвератрол: фитоэстроген с мультитаргетными эффектами как универсальный инструмент в руках клинициста
Опубликованные данные литературы показывают, что, помимо основных, ресвератрол обладает множеством дополнительных, но не менее значимых эффектов, например, противовоспалительным, иммуномодулирующим и вазопротекторным действиями.
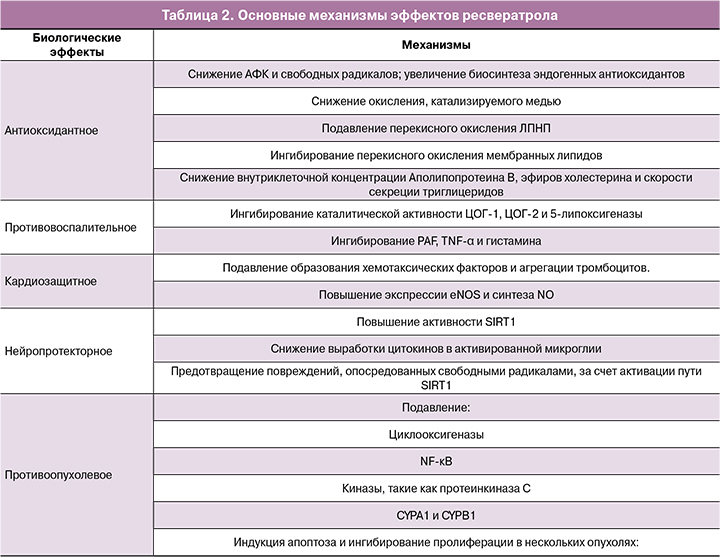
Проведенные исследования указывают на положительное влияние ресвератрола на сахарный диабет [29], нейродегенеративные заболевания [30], онкологические заболевания [31], ожирение [32], сердечно-сосудистые заболевания [33], процесс старения [34]. Основные биологические эффекты и обеспечивающие их механизмы представлены в таблице 2.
Некоторые исследования ранее показали, что ресвератрол может обладать сосудорасширяющим эффектом в плечевой артерии и в артериях головного мозга людей, что указывает на эффективность ресвератрола для улучшения общего кровообращения, опосредованного повышением биодоступности оксида азота. В клиническом исследовании в группе женщин, принимавших ресвератрол, продемонстрирована тенденция к улучшению общей когнитивной функции, а также вербальной и семантической памяти, что указывает на потенциал ресвератрола для улучшения всех функций памяти и поддерживает представление о преимуществах добавления ресвератрола в качестве потенциальной стратегии для предотвращения преждевременного снижения когнитивных функций в постменопаузе. Авторы также наблюдали незначительное улучшение настроения, что указывает на возможность дополнительных преимуществ для качества жизни в период пери- и постменопаузы [35].
Ресвератролу также присущи свойства, особенно актуальные для женщин среднего и старшего возраста: имитация ограничения калорий, увеличение расхода энергии за счет митохондриального биогенеза, уменьшение накопления жира в печени, активация SIRT1 [36].
Значительное количество доклинических и клинических исследований доказало потенциал ресвератрола в лечении метаболического синдрома. Ресвератрол борется с окислительным стрессом, тем самым подавляя повреждение β-клеток поджелудочной железы [37] и оказывает ингибирующее действие на адипокины, приводя к снижению воспаления и резистентности к инсулину. Ресвератрол не только подавляет эффекты ожирения, приводящие к диабету, но также усиливает метаболизм жировой ткани за счет увеличения активности липогенных ферментов, влияет на микробиоту кишечника и чувство сытости. За счет увеличения биогенеза митохондрий ресвератрол регулирует энергетический обмен в мышцах, что улучшает тканевой метаболизм.
В рандомизированном клиническом исследовании (Mendez-del Villar, 2014) применение ресвератрола у пациентов с диабетом в течение 90 дней показало снижение веса, индекса массы тела, жировой массы, окружности талии и индекса HOMA-IR. Кроме того, в этой группе пациентов было отмечено положительное воздействие на когнитивные функции. Позитивные эффекты ресвератрола в отношении диабета реализуются за счет улучшения чувствительности к инсулину.
Другой аспект в лечении сердечно-сосудистых заболеваний, которым обладает ресвератрол, – это противовоспалительные свойства, которые могут предотвратить повреждение кардиомиоцитов, связанное с воспалением. В исследовании с участием 75 пациентов с сердечной недостаточностью лечение назначалось в форме экстракта винограда вместе с ресвератролом в дозе 8 мг. Это лечение привело к увеличению выработки противовоспалительного адипонектина и изменению факторов транскрипции и генов, влияющих на воспаление [38].
Положительное воздействие ресвератрола также наблюдалось в группе пациентов, перенесших инфаркт, – на фоне его применения было отмечено улучшение диастолической функции левого желудочка, улучшение эндотелиальной функции, снижение уровня ЛПНП, предотвращение неблагоприятных гемореологических изменений, снижение диастолического давления [39].
Ресвератрол продемонстрировал свою способность увеличивать фибринолиз за счет снижения ингибитора активатора плазминогена типа 1. Следовательно, противовоспалительная и фибринолизирующая активность ресвератрола доказывает его терапевтический потенциал для людей с высоким риском сердечно-сосудистых заболеваний. Ресвератрол давно известен своей способностью снижать уровень ЛПНП и увеличивать уровень липопротеинов высокой плотности (ЛПВП) [40]. Исследование 1000 участников из Испании, которые имели высокий риск сердечно-сосудистых заболеваний и придерживались средиземноморской диеты, показало, что концентрация общих метаболитов ресвератрола в моче напрямую связана с улучшением уровня ЛПВП, триглицеридов плазмы, частоты сердечных сокращений и уровня глюкозы натощак [41]. Ресвератрол позитивно влияет на агрегацию тромбоцитов, воспаление, окислительный стресс, уровни липидов, ангиогенез, аутофагию, артериальное давление и энергетический метаболизм. Следовательно, он является мощным потенциальным средством при коррекции менопаузальных проявлений, особенно у женщин с сердечно-сосудистыми заболеваниями, метаболическим синдромом и другими возраст-ассоциированными состояниями [42]. В экспериментах in vitro и in vivo ресвератрол благоприятно модулировал метаболизм липопротеинов, уменьшал биосинтез тромбоксана B2 и связанных с ним эйкозаноидов и подавлял агрегацию тромбоцитов.
Важно отметить, что ресвератрол оказывает эстрогеноподобное действие на кости, увеличивая экспрессию остеопротегерина – белка, который ингибирует RANKL (лиганд рецептора-активатора ядерного фактора κB), чтобы противодействовать дифференцировке остеокластов на стадии предшественника и зрелых форм. Исследователями была высказана гипотеза о способности ресвератрола модулировать передачу сигналов рецептора витамина D. Как фитоэстроген, ресвератрол регулирует экспрессию рецепторов витамина D в остеобластоподобных клетках, чтобы влиять на костеобразование [43]. По сравнению с монотерапией ресвератролом комбинация витамина D с ресвератролом увеличивала внутриклеточную концентрацию ресвератрола, повышала активацию ЭРβ и экспрессию рецептора витамина D, что приводило к улучшению биодоступности ресвератрола и витамина D, тем самым повышая их способность быстро проникать сквозь клеточную мембрану и достигать тканей-мишеней [44].
Благодаря способности ресвератрола потенцировать эффект других известных молекул, отлично зарекомендовавших себя в противовозрастной стратегии, таких как витамин D и витамин Е [45], рациональной является комбинация перечисленных компонентов в строго подобранных оптимальных дозах. На рынке фитоэстрогенов в РФ такая комбинация представлена линейкой продуктов: сублингвальными нанотаблетками «Феминатабс» и сублингвальным наноспреем «Феминаспрей».
Ресвератрол – фитоэстроген нового поколения для негормональной поддержки женского здоровья в пери- и постменопаузе Milia R. [46] было проведено исследование, целью которого было установить эффективность нового нутрицевтического продукта на основе транс-ресвератрола в коррекции симптомов, связанных со снижением уровня эстрогенов у женщин в постменопаузе (n=30), в частности приливов жара.
Оценивалась динамика наиболее распространенных проявлений климактерического синдрома с помощью анализа общего балла по шкале оценки менопаузальных симптомов (Menopause Rating Scale) на фоне приема транс-ресвератрола в сочетании с витаминами D и Е в виде сублингвального спрея (4 впрыскивания дважды в день в течение 3 месяцев), способного попадать непосредственно в системный кровоток без первичного прохождения через желудочно-кишечный тракт.
Было получено статистически значимое снижение общего балла по шкале оценки менопаузальных симптомов, а также среднего балла приливов (р=0,01).
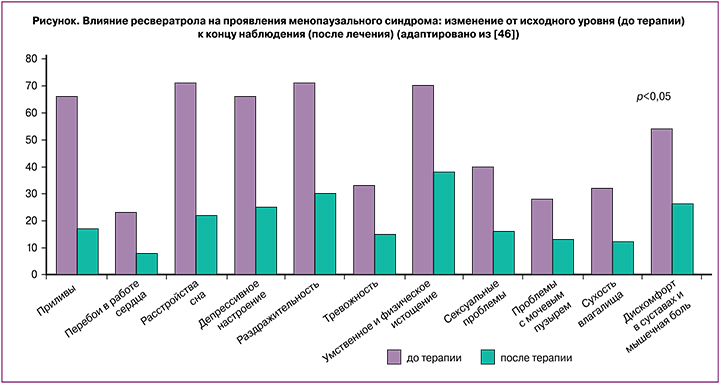
Следующие симптомы шкалы показали статистически значимое снижение (рисунок) (p<0,05):
- дискомфорт в сердце;
- проблемы со сном;
- депрессивное настроение;
- раздражительность;
- физический и психический дискомфорт;
- суставной и мышечный дискомфорт.
Более того, ни у одной пациентки не было отмечено побочных эффектов, и соблюдение режима лечения было оптимальным.
Результаты этого исследования, несмотря на небольшой размер выборки, показывают, что новый сублингвальный спрей на основе транс-ресвератрола дает статистически значимое снижение основных проявлений менопаузы. Результаты клинических исследований подтверждают, что сублингвальная форма транс-ресвератрола является адекватной для значительного улучшения качества жизни женщин в период менопаузы, поскольку она позволяет избежать метаболизма в печени при первичном прохождении.
Мишень ресвератрола – сиртуины: регуляция метаболизма и старения как основа здорового долголетия
Продолжительность жизни организма в значительной степени определяется его способностью противостоять стрессовым воздействиям, как метаболическим, так и генотоксическим. Дефекты в механизмах противодействия метаболическим стрессам ведут к повреждению соматических клеток, а генотоксическим стрессам – к повреждениям генома и нарушению процессов обновления и пролиферации клеток. В настоящее время продолжается активный поиск генов, регулирующих процессы старения, и возможных агентов, модулирующих их активность. Ресвератрол продлевает продолжительность жизни экспериментальных животных, получавших высококалорийную диету, путем программирования метаболического состояния, имитирующего ограничение калорий [7]. Антивозрастное действие ресвератрола связано с активацией белков семейства сиртуинов (Sirt) и уменьшением окислительного стресса.
Сиртуины – это НАД-зависимые деацетилазы, которые контролируют апоптоз, клеточное репрограммирование, репарацию ДНК. Сиртуины также вовлечены в регуляцию прогрессии рака, старения яичников, окислительно-восстановительного гомеостаза и углеводно-липидного метаболизма [47].
На сегодняшний день у млекопитающих идентифицировано семь членов семейства сиртуинов (SIRT1-7), которые контролируют функции многих органов, в частности яичников.
Ресвератрол является наиболее мощным природным лигандом SIRT1. Активированный SIRT1 связывает различные молекулярные мишени, включая NF-kB, p53, FOXO-1, -3, -4, фактор, индуцируемый гипоксией 2-α (HIF-2-α) и др. [48]. Активируя эти молекулы, ресвератрол регулирует энергетический гомеостаз, сайленсинг (молчание) генов, стабильность генома и жизнеспособность клеток.
Белки семейства FOXO (forkhead box O) являются транскрипционными факторами, контролирующими экспрессию генов, ответственных за пролиферацию, дифференцировку, апоптоз и реакцию клеток на внешние стрессы. Регулируя экспрессию генов-мишеней, FOXO защищают организм от неблагоприятных внешних воздействий, активируют защитные механизмы и тем самым замедляют процессы старения [8].
Существуют и другие механизмы антивозрастных эффектов ресвератрола. Ингибирование NF-каппа В под влиянием ресвератрола замедляет индуцированное повреждением ДНК старение у мышей. Полученные данные позволили предположить регулирующую роль этого транскрипционного фактора в процессах старения человека. Имеются данные о тесной связи процессов старения с нарушением функции митохондрий, обусловленных их морфологическими изменениями и мутациями в митохондриальной ДНК. При старении организма наблюдается нарушение деления митохондрий, а также восстановления и аутофагии при их повреждении. В недавнем исследовании обнаружена способность ресвератрола оказывать положительное влияние на процессы деления, репарации и аутофагии митохондрий в кардиомиоцитах [49].
Антиоксидантные эффекты ресвератрола связаны с наличием в его структуре фенольных групп, которые действуют как ловушки свободных радикалов. Благодаря своим антиоксидантным свойствам ресвератрол уменьшает содержание реактивных форм кислорода в кератиноцитах кожи под влиянием ультрафиолетового облучения и предупреждает повреждение и дистрофические изменения в эпидермисе. Ресвератрол снижает синтез меланина и препятствует гиперпигментации кожи и ее фотостарению, а также оказывает ингибирующий эффект на эластазу, гиалуронидазу и коллагеназу, активность которых повышается под влиянием ультрафиолетового излучения, воспаления, а также с возрастом [8]. Кроме того, ресвератрол активирует такие антиоксидантные ферменты, как каталаза, глутатионпероксидаза и супероксиддисмутаза [50].
Антипролиферативное действие ресвератрола
Повышенный интерес к ресвератролу возник после выяснения его терапевтического эффекта на онкологические процессы – ресвератрол ингибирует появление опухоли и препятствует ее распространению и прогрессированию. Первое сообщение об антипролиферативном эффекте ресвератрола было получено на клетках карциномы молочной железы человека. Ресвератрол подавляет рост и снижает жизнеспособность ЭР-положительных клеток MCF-7, ЭР-отрицательных неканцерогенных MCF-10F и инвазивных клеток MDA-MB-231. Следовательно, ресвератрол вызывает независимые от ЭР антипролиферативные эффекты, которые, вероятно, опосредованы активацией клеточного апоптоза [51]. А так как ресвератрол обладает эстрогеноподобным эффектом, здесь закономерно возникает вопрос о возможной пролиферации клеток тканей-мишеней, в которых есть оба типа ЭР.
В исследовании биологических эффектов, оказываемых ресвератролом в комбинации с витамином D3, было продемонстрировано, что, в отличие от других агонистов ЭРα, ресвератрол не вызывает пролиферации тканей молочной железы или матки, что объясняет хороший профиль его безопасности и позволяет принимать его в качестве пищевой добавки [44]. Более того, есть данные о том, что ресвератрол оказывает протективное воздействие на ткани молочной железы у женщин высокой группы риска [52].
Особенности сублингвальной формы ресвератрола
Одной из главных целей при разработке инновационной формы транс-ресвератрола является преодоление вариабельности биодоступности. Биодоступность ресвератрола в конвенционной форме (обычной) широко варьирует и зависит от метаболизма в кишечнике, циркадных ритмов (выше в утренние часы), и первичного прохождения через печень.
Биодоступность ресвератрола при приеме внутрь в конвенционной форме низкая и не превышает 1%. Рациональный путь доставки вещества в кровь обеспечивается использованием сублингвальных форм. В этом случае всасывание происходит быстро через слизистую оболочку ротовой полости, благодаря чему исключаются воздействие в кишечнике и метаболизм в печени при первичном прохождении. Однако через слизистую ротовой полости хорошо всасываются только гидрофильные вещества, у ресвератрола же растворимость в воде довольно низкая. Преодолеть данное препятствие помогли современные фармацевтические нанотехнологии – создание систем доставки активных компонентов [53].
Инновационная запатентованная технология доставки компонентов NANOEMULSION DELIVERY SYSTEM обеспечивает более высокую биодоступность транс-ресвератрола, поскольку обходит печеночный метаболизм при первом прохождении, попадая непосредственно в системный кровоток.
МГТ, которая включает как монотерапию эстрогенами, так и комбинацию эстрогенов с прогестагенами, в настоящее время признана наиболее эффективным методом лечения менопаузальных симптомов [54]. Однако с целью улучшения качества жизни женщин с проявлениями дефицита эстрогенов, которым МГТ не может быть назначена по различным причинам, можно использовать альтернативные средства растительного происхождения.
Феминаспрей содержит фитоэстроген нового поколения с сублингвальной формой доставки транс-ресвератрола, который эффективен в качестве средства «скорой помощи» при приливах жара как самостоятельно, так и в дополнение к любому виду терапии климактерических расстройств – по мере потребности. Основное преимущество сублингвального наноспрея заключается в скорости купирования вазомоторных эпизодов, именно поэтому его можно применять в тех ситуациях, когда требуется немедленное воздействие на приливы жара – в момент приступа. Феминаспрей допустимо комбинировать с любым (гормональным или негормональным) методом лечения климактерических расстройств при наличии такой необходимости.
Новый продукт «Феминаспрей», содержащий транс-ресвератрол, витамин D3 и витамин Е в виде сублингвальной эмульсии-спрея, приводит к статистически значимому снижению основных менопаузальных проявлений при измерении с помощью проверенного метода.
Заключение
В заключение следует отметить, что транс-ресвератрол одновременно обладает множеством эффектов, основными из которых являются способность влиять на приливы жара и другие проявления дефицита эстрогенов, антиоксидантный эффект, противовозрастные свойства и многие другие. Эти эффекты реализуются преимущественно через рецепторы эстрогенов (частичный агонист рецепторов) и сиртуины (универсальные регуляторы активности клеток). Важным аспектом безопасности ресвератрола является его хорошая переносимость, в том числе и при длительном использовании как в форме наноспрея, так и сублингвальных таблеток. Очевидным достоинством Феминатабса и Феминаспрея является тот факт, что это практически единственные продукты среди множества пищевых добавок для поддержания здоровья женщины с менопаузальными проявлениями, в состав которых входит не смесь фитоэстрогенов, которую сложно стандартизировать, а отдельный фитоэстроген – транс-ресвератрол, имеющий более выраженную активность и широкую доказательную базу.



