Всевозрастающий научный интерес к проблеме неразвивающейся беременности обусловлен появлением новых технологических возможностей, позволяющих уточнить важнейшие этиологические аспекты и патогенетические механизмы нарушения процессов имплантации и эмбриогенеза, разработать инновационные лечебные мероприятия для предотвращения рецидивов данной патологии. Удельный вес неразвивающейся беременности среди самопроизвольных выкидышей составляет 15%, а на ранних сроках беременности достигает 45–80% [1, 2].
Мировым сообществом акушеров-гинекологов принята научная концепция, согласно которой каждая неразвивающейся беременность ассоциируется с хроническим эндометритом, как на уровне причины, так и неизбежного следствия [3].
Поражение эндометрия при хроническом эндометрите сопровождается развитием рецепторной недостаточности [4, 5]. Снижается чувствительность слизистой оболочки матки к стероидам, поэтому даже при удовлетворительном синтезе эстрогенов и прогестерона отмечается неполноценность циклических превращений эндометрия [6–8]. Вследствие нарушения деградации эстрогенов и активации локальных факторов роста при длительном воспалении возникает локальная гиперэстрогения и избыточная пролиферация эндометрия, который не подвергается адекватной секреторной трансформации вследствие снижения числа рецепторов к прогестерону во всех заинтересованных отделах – в клетках эндометриальных желез, строме, а также на регуляторных Th-лимфоцитах [8–10]. Это может привести к нарушению процессов имплантации.
Трудности медикаментозного лечения больных с хроническим эндометритом объясняются резистентностью микроорганизмов к лекарственным средствам, сложностью создания и длительного сохранения терапевтической концентрации этих средств в очаге воспаления, а также аутоиммунным характером воспаления при хроническом эндометрите. В этой связи наше внимание привлекла возможность использования в терапии хронического эндометрита низкочастотного ультразвукового кавитационного орошения полости матки посредством аппарата ультразвуковой кавитации «Фотек» АК100.
Метод основан на значительной биологической потенции ультразвуковых колебаний. Бактерицидный эффект низкочастотного ультразвука объясняют кавитационным воздействием микрополостей озвученной среды на стенку бактерий, что приводит к ее тепловому и механическому повреждению. Противовоспалительный эффект связан с сокращением в 2–3 раза фазы гидратации раневого процесса, снижения микробной контаминации и улучшения микроциркуляции [11, 12].
Цель работы – оценить эффективность применения ультразвукового кавитационного орошения полости матки для восстановления эндометрия у женщин после прерывания регрессирующей беременности.
Материал и методы исследования
Обследованы 78 женщин репродуктивного возраста с неразвивающейся беременностью в первом триместре. Из них первую группу составили 38 пациенток, которым после вакуум-аспирации плодного яйца по поводу неразвивающейся беременности в комплексе терапии был проведен курс ультразвукового кавитационного орошения полости матки.
Вторую группу составили 32 пациентки после вакуум-аспирации плодного яйца, в лечении которых не использовались внутриматочные орошения. Контрольную группу составили 8 условно здоровых женщин.
На 7–10-й день следующего менструального цикла всем пациенткам была выполнена пайпель-биопсия эндометрия с гистологическим и иммуногистохимическим (ИГХ) исследованием биоптата.
Материалы биоптатов для гистологического исследования фиксировали в 10% нейтральном формалине, заключали в парафин, делали срезы толщиной 5 мкм и окрашивали гематоксилином и эозином.
Для ИГХ-реакций парафиновые срезы обрабатывали по стандартной методике с использованием мышиных моноклональных антител к эстрогеновым рецепторам-α (ERα) (клон 1D5 «DAKO») и прогестероновым рецепторам (PR) (клон 636 «DAKO»). При ИГХ-исследовании рецепторов эстрогенов и прогестерона отдельно анализировались клетки стромы (отросчатые фибробласты) и эпителия желез. При оценке результатов ИГХ окрашивания в отношении стероидных рецепторов в расчетах учитывалось только ядерное окрашивание.
Для анализа результатов ИГХ-реакций использовали метод гистологического счета H-score по формуле: HS=1a+2b+3c, где а – % слабо окрашенных клеток, b – % умеренно окрашенных клеток, с – % сильно окрашенных клеток, 1, 2, 3 – интенсивность окрашивания, выраженная в баллах.
Кавитационное орошение полости матки осуществлялось физиологическим раствором ультразвуковым аппаратом АК 100 «Фотек» с использованием усовершенствованного маточного наконечника. Орошение проводилось на третий день после прерывания регрессирующей беременности. Курс составлял 5 процедур длительностью 3–5 минут.
Статистическая обработка полученных данных проводилась с использованием пакета прикладных программ Statistica 7.0 BIOSTAT и программного обеспечения Microsoft Excel 2000. Результаты обрабатывались методами вариационной статистики и представлены в виде M±m. Оценка достоверности различий средних величин и относительных показателей проводилась с использованием t-критерия (критерия Стьюдента). За уровень значимости в исследовании принято р<0,05.
Результаты исследования
Все пациентки в группах наблюдения были сопоставимы по возрасту. Средний возраст больных в первой группе составил 30,21±3,14 года, во второй – 31,69±3,68 года, в контрольной – 33,5±3,3 года (р>0,05).
В группах женщин с регрессирующей беременностью около трети пациенток – первобеременные (31,4%). Средняя частота привычного невынашивания беременности в первой группе составила – 37,1%, во второй – 32,6%.
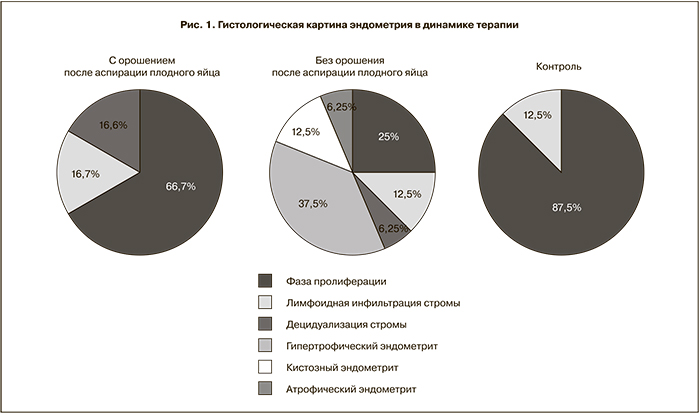
В работе были проанализированы результаты гистологического исследования биоптатов эндометрия в раннюю стадию фазы пролиферации после проведенной терапии по проводу регрессирующей беременности в группах наблюдения.
Среди женщин первой группы, которым проведено в комплексе терапии ультразвуковое кавитационное орошение полости матки, наблюдались наилучшие результаты лечения. Гистологическая картина, соответствующая ранней стадии фазы пролиферации без признаков воспалительной реакции стромы, отмечалась в 66,7%. У 16,6% женщин данной подгруппы эпителий желез эндометрия соответствовал фазе пролиферации, однако наблюдалась стромальная лимфоидная инфильтрация различной степени выраженности, у 16,7% сохранялась децидуализация стромы, гистологическая картина не соответствовала фазе менструального цикла.
В группе пациенток с регрессирующей беременностью, которым проводилась терапия без кавитационного орошения полости матки, гистологическая картина ранней стадии фазы пролиферации без признаков стромальной лимфоидной инфильтрации отмечалась в 25,0%, картина эпителия желез эндометрия в фазе пролиферации со стромальной лимфоидной реакцией – в 12,5%, децидуализация стромы эндометрия – в 6,25%. Гистологическая картина атрофического эндометрита выявлена у двух пациенток (6,25%), кистозного эндометрита – у четырех (12,5%), в 37,5% наблюдений выявлена гистологическая картина гипертрофического эндометрита.
В контрольной группе большинство женщин демонстрировали гистологическую картину эпителия желез эндометрия в фазе пролиферации (87,5%), у остальных пациенток на фоне соответствия развития желез эндометрия фазе менструального цикла отмечалась единичная лимфоидная инфильтрация стромы (рис. 1).
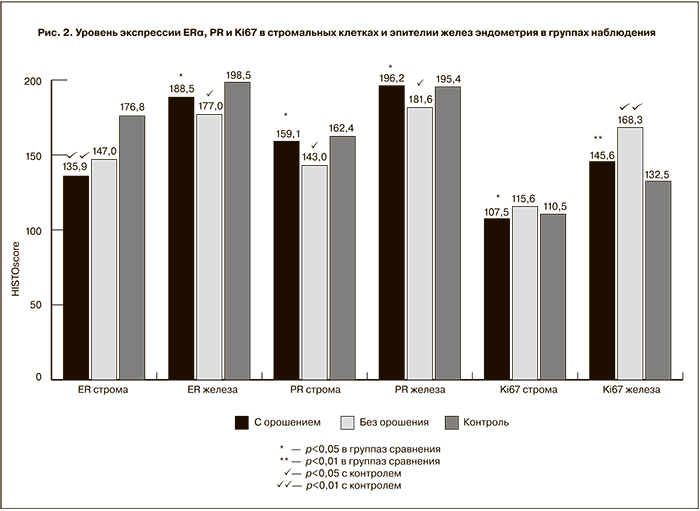
Для оценки механизмов реализации лечебного воздействия ультразвукового кавитационного орошения полости матки на эндометрий определялась экспрессия ERα и PR, маркера пролиферации – Кi67 в динамике терапии.
В группе пациенток, которым проводилось кавитационное орошение полости матки (первая группа), в железах эндометрия определялась достоверно более высокая экспрессия ERα 188,54±1,97 балла – по сравнению с 177,01±5,29 балла (р<0,05) в группе пациенток, которым данная процедура не проводилась (вторая группа). Уровень экспрессии ERα в строме эндометрия достоверно не отличался в группах наблюдения, но был значимо ниже контрольных значений – в первой группе 135,9±9,94 балла, во второй группе 147,02±7,14 балла против 176,8±6,12 балла в контроле (р<0,05).
Отмечался достоверно более высокий уровень экспрессии PR в строме и в железах эндометрия в группе женщин, получавших кавитационное орошение полости матки после прерывания регрессирующей беременности. Экспрессия PR в строме составила в первой группе 159,09±4,82 балла против 143,01±8,19 балла во второй группе (р<0,05). Экспрессия PR в железах эндометрия составила 196,18±1,94 балла в первой группе против 181,66±3,18 балла во второй группе (р<0,01). Следует отметить, что значения экспрессии PR в строме и на железах в первой группе достоверно не отличались от контрольных значений.
Уровень экспрессии Ki67 в строме и железах был достоверно выше в группе женщин, не получавших кавитационного орошения полости матки. Экспресия Ki67 в строме составила в первой группе 107,45±2,93 балла, во второй группе 115,66±3,86 балла (р<0,05), экспрессия Ki67 в железах соответственно: 145,63±5,43 балла против 168,33±14,59 балла, что значительно выше контрольных показателей 132,51±4,25 балла (р<0,01). Следует отметить, что во всех группах наблюдения в фазу пролиферации уровень экспрессии Ki67 в железах эндометрия был выше, чем в строме (рис. 2).
Обсуждение
Неразвивающаяся беременность – патология, при которой смерть эмбриона/плода предшествует экспульсии плодного яйца. Прекращение эмбрио-плацентарного кровотока при длительном функционировании маточно-плацентарной циркуляции, продолжающаяся продукция хорионом иммуносупрессивных агентов препятствует наступлению выкидыша и таким образом способствует формированию воспалительного ответа в эндометрии [13, 14].
Доказано, что в основе неразвивающейся беременности лежит хронический аутоиммунный эндометрит (FIGO, 2006) [3].
Лечение хронического эндометрита – непростая задача. Показано, что в хронической стадии эндометрита антибактериальные средства малоэффективны [15]. Наше внимание привлекла возможность использования в терапии хронического эндометрита энергии низкочастотного ультразвука.
Приоритет использования низкочастотного ультразвука средней интенсивности в лечении воспалительных процессов принадлежит отечественным исследователям [16, 17]. Сущность метода заключается в воздействии на пораженные ткани жидкими средами, предварительно озвученными энергией низкочастотного ультразвука. При прохождении ультразвука через жидкостную среду в ней возникает целый ряд физических (кавитация, барботирование, тепловой и фонофоретический эффекты и др.) и биологических эффектов (бактерицидный, противовоспалительный, улучшение микроциркуляции, регенерации тканей, микромассаж) [18–20].
Бактерицидный эффект низкочастотного ультразвука объясняют кавитационным воздействием микрополостей озвученной среды на стенку бактерий, что приводит к ее тепловому и механическому повреждению [20, 21]. Противовоспалительный эффект кавитированных растворов определяется снижением микробной контаминации, активацией макрофагальной реакции, усилением пролиферативной и синтетической активности фибробластов [11, 22]. В многочисленных экспериментах показано, что низкочастотный ультразвук обладает потенциально важным эффектом воздействия на функциональную активность эпителиальных клеток, который может заметно влиять на восстановление тканей и процессы регенерации в естественных условиях [23]. Низкочастотный ультразвук вызывает расширение кровеносных сосудов и увеличение регионарного кровотока в 2–3 раза, инициирует благоприятные изменения в микроциркуляторном русле и адвентиции сосудов, развитие коллатерального кровотока [22].
Вышеизложенные эффекты низкочастотного ультразвука, а также внушительный опыт использования данного метода в хирургии, травматологии, ортопедии, стоматологии для лечения раневой инфекции и хронических воспалительных процессов определил наш научный интерес в изучении возможностей применения энергии ультразвуковых колебаний для восстановления морфологической структуры и функциональной активности эндометрия после прерывания неразвивающейся беременности.
Изучение морфологической картины эндометрия после прерывания регрессирующей беременности и в фазу пролиферации следующего менструального цикла в динамике терапии демонстрирует значение кавитационного орошения полости матки в профилактике и терапии хронического эндометрита. Наилучших результатов восстановления морфологической структуры эндометрия удалось добиться при использовании метода орошения в первом же цикле после аспирации регрессирующей беременности. Около 70% пациенток демонстрировали картину ранней фазы пролиферации без лимфоидной инфильтрации стромы. Это значительно превышает соответствующие результаты в группе сравнения, где орошение не применялось. В этой группе только 25% образцов эндометрия соответствовали фазе пролиферации без стромальной лимфоидной реакции, а гистологическая картина эндометрита в следующем цикле после аспирации плодного яйца верифицирована в 56% наблюдений. Это соответствует данным В.М. Сидельниковой и соавт. (2008) о высокой частоте распространения хронического эндометрита в популяции небеременных женщин с невынашиванием беременности в анамнезе [1].
Хронический воспалительный процесс в железистых и стромальных клетках функционального слоя эндометрия способствует снижению уровня экспрессии рецепторов прогестерона и в меньшей степени – рецепторов эстрогенов [24, 25].
Многочисленные исследования, посвященные изучению потенциальных маркеров восприимчивости эндометрия при наступлении беременности, определили клеточные и молекулярные механизмы имплантации (аппозиция, адгезия, инвазия) [26, 27]. Тем не менее, использование даже наиболее изученных в настоящее время биомаркеров имплантации в клинической практике крайне ограничено. Большинство идентифицированных маркеров имплантации регулируются путем прямого или опосредованного влияния эстрадиола и прогестерона [27, 28]. Однако важен не только уровень половых стероидов в организме, но и сохранение всех путей реализации гормонального эффекта, в чем решающую роль играет количество функционально полноценных рецепторов ткани эндометрия к соответствующим стероидным гормонам.
В проведенном исследовании изучались молекулярные эффекты энергии низкочастотного ультразвука в отношении восстановлении рецепторного поля эндометрия. Выявлена потенция кавитированых жидких сред в восстановлении уровня экспрессии ERα преимущественно в железах эндометрия до уровня, сопоставимого с контрольными значениями. Стромальный пул ERα на фоне орошения достоверно не изменялся. Это может объясняться более поверхностным воздействием на ткани ультразвуковых волн, однако здесь требуются дальнейшие исследования.
Уровень экспрессии маркера пролиферации Ki67 в строме и железах эндометрия был достоверно выше в группе пациенток, не получавших кавитационного ультразвукового орошения полости матки. Это пациентки, страдающие хроническим эндометритом. Роль хронического воспаления в генезе повышения пролиферативной активности желез и стромы эндометрия подчеркивалась многими исследователями [2, 6, 15]. Хронический воспалительный процесс на уровне паракринной регуляции приводит повышению синтеза факторов роста, усиливает межклеточные и стромально-паренхиматозные нарушения, активирует процессы неоангиогенеза, что стимулирует пролиферацию клеток и может способствовать развитию опухолевого процесса. Преимущественно автономный путь регуляции пролиферации при хроническом воспалении подтверждается более низкой экспрессией эстрогеновых рецепторов во второй группе наблюдения.
Наиболее оптимистичным представляется эффект ультразвуковой кавитации в отношении экспрессии PR. В проведенном исследовании показана достоверно более высокая экспрессия PR в железах эндометрия и в строме у женщин после кавитационного орошения полости матки в сравнении с пациентками, не получавшими данной процедуры. Следует отметить, что в целом рецепторный фенотип женщин после проведенной реабилитации был достоверно неотличим от контроля. Рецептор к прогестерону – фактор, широко изучающийся в контексте рецептивности эндометрия [29]. В нормальном цикле эндометрий максимально экспрессирует PR во время пролиферативной фазы, а затем наблюдается снижение экспрессии PR в середине лютеиновой фазы. Это плато экспрессии эпителиальных PR позволяет переключить регуляцию имплантации с системной на более тонкую паракринную [24, 25].
Низкая экспрессия PR в пролиферативную фазу и отсутствие плато PR в лютеиновую фазу сочетается в дальнейшем с потерей других маркеров рецептивности. Наиболее неблагоприятным вариантом для наступления беременности является отсутствие снижения экспрессии ERα в фазу секреции [29]. Нарушение паттерна экспрессии рецепторных белков может служить причиной неполноценной имплантации.
Выводы
Ультразвуковое кавитационное орошение полости матки является эффективной технологией реабилитации рецепторного поля эндометрия после прерывания регрессирующей беременности.
Наилучших результатов в плане восстановления морфо-функциональной структуры эндометрия удалось добиться, используя метод в первом цикле после прерывания неразвивающейся беременности.



