Женщины постменопаузального периода относятся к группе риска по возникновению различных патологий эндометрия на фоне инволютивных изменений матки и яичников [1]. Согласно данным GLOBOCAN (совместный проект Всемирной организации здравоохранения и Международного агентства исследований рака), рак эндометрия занимает 6-е место среди злокачественных заболеваний у женщин в мире [2]. По данным Аксель Е.М., в России (2015) почти 60% рака эндометрия выявляют у женщин в постменопаузальном периоде, причем пик заболеваемости отмечен в возрасте 55–69 лет [3]. В работе врача акушера-гинеколога с пациенткой в период постменопаузы первостепенной задачей является исключение или подтверждение злокачественного процесса эндометрия. По данным гистологического заключения рак эндометрия подтверждается примерно у 10% женщин с жалобами на кровяные выделения из половых путей в постменопаузе, в 60% случаев – это атрофия эндометрия, примерно с одинаковой частотой встречаются полипы эндометрия и гиперплазия эндометрия, а также другие изменения эндометрия доброкачественного генеза [4]. Таким образом, в большинстве случаев причиной кровотечений в постменопаузе являются изменения эндометрия доброкачественного характера. Однако к периоду постменопаузы женщина приходит с определенным соматическим багажом, который, по данным литературы, может увеличивать риски развития патологии эндометрия у данной категории больных. Тем самым может повлиять на возможность и ограничить использование менопаузальной гормональной терапии (МГТ). Мощными факторами риска рака эндометрия в постменопаузе являются: ожирение, нарушения углеводного обмена, прием тамоксифена, поздняя менопауза [5].
В исследовании Lortet-Tieulent J. и соавт. (2018) по распространенности рака эндометрия в мире показан рост заболеваемости в некоторых странах. Отмечено увеличение более чем в 2 раза в популяциях, где ранее показатели были низкими: например, в Индии и Южной Африке; а максимальные цифры были получены в Японии, Филиппинах, Беларуси, Сингапуре, Коста-Рике и Новой Зеландии. При этом самые высокие показатели авторы исследования наблюдали у белых женщин в США и Словакии (19/100 000); в Европе – Швейцарии, Франции, Австрии, Голландии, Ирландии и Исландии показатели, напротив, были самыми низкими (10–12/100 000). Интересно, что, например, во Франции, Голландии, Дании, Норвегии и Чехии показатели не изменились у женщин в постменопаузе, но снизились у женщин в периоде менопаузы. Основными причинами данных изменений можно считать снижение числа родов и увеличение заболеваемости ожирением [6]. За последние 20 лет, после результатов WHI, отмечено снижение применения МГТ, но этот факт не изменил частоту заболеваемости раком эндометрия. Причины уменьшения числа случаев рака эндометрия в период менопаузы неочевидны, но могут быть следствием выраженного протективного эффекта широкого использования комбинированных оральных контрацептивов [6].
Эндометрий – это сложная, многокомпонентная система, состоящая из покровного и железистого эпителия, стромы, основного вещества, кровеносной сети сосудов. Последний слой обладает способностью видоизменяться под влиянием половых стероидов и ряда других факторов (например, наличие у женщины ожирения, сахарного диабета 2 типа (СД 2)) и состоит из железистого эпителия, стромы и выраженной сосудистой сетки. В климактерическом периоде происходит постепенная атрофия функционального слоя, но базальный слой сохраняет рецепторный аппарат, обладает «памятью» и регенеративными свойствами, в результате чего даже после менопаузы остается таргетным органом для половых стероидов. Эндометрий – это автономная часть матки, включающая ферментативный аппарат, иммунную систему, способная к локальному стероидогенезу (синтез эстрадиола, эстрона сульфата, андрогенов и пролактина), а также с возможностью образования простагландинов и ростовых факторов. Половые гормоны сыворотки крови, локальный стероидогенез, клеточный гомеостаз оказывают влияние на пролиферацию и дифференциацию клеток эндометрия.
В постменопаузе влияние на эндометрий экзогенно вводимых половых стероидов идентично их эндогенному воздействию у женщин репродуктивного периода. Эстрогены способны оказывать прямой стимулирующий эффект на эндометрий, связываясь с эстрогенными рецепторами, а также существует опосредованное влияние через активацию ростовых факторов. Прогестерон же подавляет активность эстрогенных рецепторов, способствует повышению синтеза белка, связывающего инсулиноподобный фактор роста, и синтеза фермента 17b-дегидрогеназы, способствующего превращению более активного эстрадиола в менее активный эстрон, регулирует процессы апоптоза. Прогестагены в составе МГТ оказывают эффект только при наличии рецепторов к ним, синтез которых, в свою очередь, стимулируют эстрогены. Таким образом, рассматривать влияние половых стероидов на процесс трансформации эндометрия возможно только комплексно [7, 8, 9].
В последние годы активно изучается вопрос рецепторного аппарата половых стероидных гормонов в ткани эндометрия. Данные о содержании рецепторов эстрадиола (ER) и прогестерона (PR) достаточно противоречивы. Ряд авторов показали связь между видом пролиферативного процесса эндометрия и составом и выраженностью половых стероидных рецепторов в эндометрии. Например, авторами показано повышение уровня ER и отношения ER/PR в эндометрии при железистой гиперплазии без атипии и максимальная концентрация обоих рецепторов при атипической гиперплазии [10, 11]. Другие авторы отметили максимальную степень пролиферативной активности в ткани при железистой гиперплазии и снижение при атипической гиперплазии и аденокарциноме эндометрия [12, 13]. Hapangama D. и соавт. [14] показали прямо противоположные результаты: отсутствие зависимости концентрации стероидных рецепторов от типа патологии эндометрия. Одной из возможных причин противоречивых данных, по-видимому, может быть то, что не во всех работах авторы учитывали возраст женщин, период жизни пациенток согласно STRAW+10, так как гормональный статус коррелирует с рецепторным профилем зависимых тканей. Исследование Бреусенко В.Г. показало, что существует рецепторно-гомеостатическая модель эндометрия, которая максимально стабильна в непораженной ткани эндометрия и нарушается при патологическом процессе в ткани. При различных пролиферативных заболеваниях эндометрия степень тяжести нарушений стероидно-рецепторного профиля эндометрия прямо пропорциональна степени дифференцировки клеток, а также зависит от возрастного периода женщины и ее гормонального статуса. Варианты рецепторно-гомеостатической модели эндометрия могут быть причиной и разъяснением особенностей различных пролиферативных заболеваний эндометрия у женщин различных периодов и иметь значение при выборе терапевтической тактики [15]. Teresiński L. и соавт. провели анализ морфологической структуры и рецепторного аппарата эндометрия (рецептора эстрогена α (ER-α), PR и рецептора андрогена (AR)) у женщин в следующих группах: группа I – от 1 до 5 лет после менопаузы, группа II – от 6 до 10 лет после менопаузы, группа III – более 11 лет после менопаузы и группа IV – женщины старше 70 лет. Анализ морфологических изменений в эндометрии и миометрии выявил наличие нарастающих регрессивных изменений, таких как атрофия, фиброз и кальцификация, которые прогрессировали в зависимости от количества лет после менопаузы. Кроме того, наблюдались полипы эндометрия, очаги эндометриоза и лейомиомы. На основании результатов морфометрических измерений в исследуемых группах отмечалось постоянное уменьшение толщины эндометрия и миометрия (I–IV). Значительные различия между группами наблюдались по количеству ER-α-положительных клеток в миометрии, но не в железистом эпителии эндометрия. Статистически значимые различия в количестве АР-положительных клеток были обнаружены в эпителии эндометрия [16]. По-видимому, эти данные стоит учитывать при выборе гестагена в составе МГТ.
Сопутствующие состояния и заболевания женщины в постменопаузе могут быть существенными факторами риска патологии эндометрия в этом периоде:
- отсутствие родов в анамнезе;
- ожирение;
- артериальная гипертензия;
- нарушения углеводного обмена, в особенности СД 2;
- терапия эстрогенами;
- терапия селективными модуляторами эстрогеновых рецепторов;
- генетические факторы (синдром Линча);
- соматический анамнез: заболевания мочеиспускательного канала, мочевого пузыря и прямой кишки [17, 18].
Прием МГТ часто ошибочно считается клиницистами абсолютным фактором риска онкопатологии эндометрия, работы в этой области активно ведутся по настоящий момент. Женщины с кровянистыми выделениями из половых путей, получающие гормональную терапию в постменопаузе, имеют более низкий риск развития рака эндометрия в сравнении с женщинами, не получающими ее [17, 19]. В большом проспективном исследовании Clarke M.A. и соавт. было показано, что прием гормональной терапии обратно пропорционален риску развития рака эндометрия (прием гормональных контрацептивов корреляции с онкопатологией эндометрия не показан) [20]. Безусловно, женщина с кровянистыми выделениями из половых путей в постменопаузе, получающая гормональную терапию в циклическом или непрерывном режиме, должна быть обследована для исключения патологии эндометрия. Не стоит забывать, что причиной кровотечения могут быть нарушение режима приема препарата, заболевания печени, нарушение лекарственного взаимодействия препаратов, другие гинекологические заболевания, а также не гинекологическая патология (например, заболевания мочевыводящих органов, ЖКТ) [19]. Полипы эндометрия – одна из доброкачественных патологий матки, в том числе и в периоде постменопаузы, они могут малигнизироваться в 1,5–12,9% [21, 22].
Длительное (более 10 лет) последовательное (<15 дней гестагена в месяц) использование гестагена и эстрогена положительно коррелировало с риском рака эндометрия (ОR=1,88; 95% ДИ 1,36–2,60), тогда как непрерывное (>25 дней гестагена в течение месяца) применение эстроген плюс гестаген ассоциировалось со сниженным риском (ОR=0,64; 95% ДИ 0,49–0,83) [23]. Целью исследования Hein A. и соавт. (2020) было изучение влияния предшествующей МГТ в постменопаузе и других факторов риска на прогноз течения инвазивной карциномы эндометрия. Важно, что авторы проанализировали такие факторы риска онкопатологии, как возраст на момент постановки диагноза, МГТ в постменопаузе, ИМТ, нарушение углеводного обмена (СД 2), стадию опухоли, тип (I или II) и рецидивы. Возраст (чем старше, тем хуже) и стадия опухоли (чем выше, тем хуже) оказали значительное влияние на общую выживаемость пациенток. Без оценки других факторов риска в группе приема МГТ была отмечена более длительная выживаемость, чем в группе без МГТ. Однако модель пропорциональных рисков Кокса показала, что такие протективные воздействия дает не сама МГТ, а эпигенетические факторы и отсутствие сопутствующей патологии женщины. Что касается рецидива, то не было отмечено корреляции ни в группе с МГТ, ни без нее [24]. Аналогичные результаты в отношении прогноза выживания были получены и в исследовании Di Donato V. и соавт. [25]. Ghoubara А. и соавт. показали, что распространенность рака эндометрия – 8%, с повышением риска в 5,5 раза при толщине эндометрия более 10 мм и в 3,5 раза у женщин с индексом массы тела >32,5 кг/м2. Таким образом, сопутствующий анамнез женщины является более выраженным и существенным фактором риска онкологической патологии эндометрия [21]. Rotenberg O. и соавт. также в своей работе показали, что высокий ИМТ (33,9 кг/м2) ассоциирован с гиперплазией эндометрия с атипией [26]. В исследовании Luo J. и соавт., в которое были включены более 58 тысяч женщин в возрасте 50–79 лет, ожирение было названо самостоятельным фактором риска рака эндометрия, а снижение веса – одним из возможных терапевтических подходов [27]. В целом наиболее распространенными видами рака, связанными с ожирением и нарушениями углеводного обмена, являются рак молочной железы, эндометрия, колоректальный и постменопаузальные раки [28]. Наряду с ожирением изменение микробиома во влагалище является дополнительным фактором риска патологии эндометрия по данным исследования Walsh D.M. и соавт. Повышенный ИМТ, менопауза, изменение pH среды во влагалище способны влиять на микробиом во влагалище, что, в свою очередь, может быть фактором риска рака (например, Porphyromonas somerae был назван как наиболее прогнозирующий микробный маркер онкопатологии эндометрия) [29].
При отсутствии противопоказаний пациенткам в постменопаузе в случае необходимости могут назначаться пероральные препараты МГТ. В рутинной клинической практике врача-клинициста возникают вопросы в отношении возможного влияния этих препаратов на эндометрий. Международные клинические рекомендации признают целесообразность использования низких эффективных доз МГТ в период постменопаузы, подобранных для каждой женщины индивидуально в соответствии с целями лечения [30, 31]. При интактной матке эндометрий должен быть защищен от пролиферативного действия эстрогенов гестагеном. Использование правильной дозировки прогестагенов и конкретных доз эстрогенов при непрерывном, а не циклическом режиме обеспечивает лучшую защиту эндометрия.
Общеизвестно, что использование дроспиренона (ДРСП) в комбинации с 17β-эстрадиолом (Э) в качестве МГТ для облегчения симптомов климактерического синдрома показано в период постменопаузы [32–34]. Фармакологический профиль ДРСП, сходный с эндогенным прогестероном, обладая антиминералокортикоидным и антиандрогенными эффектами, делает его лидером в программах антиэйджинговой терапии [34–36]. Комбинированный препарат Э/ДРСП представлен в дозах Э 0,5 мг/ДРСП 0,25 мг и Э 1 мг/ДРСП 2 мг, его принимают внутрь, непрерывно, один раз в день.
Genazzani A.R. и соавт. было проведено рандомизированное плацебо-контролируемое двойное слепое исследование, где оценивались эффективность и безопасность ультранизких доз ДРСП/Э для лечения климактерического синдрома средней тяжести и тяжелой степени у женщин в постменопаузе. Целью работы являлось выявление наименьшей эффективной дозы ДРСП/Э для купирования вазомоторной симптоматики [34, 37], а одной из задач исследования – определение состояния эндометрия у женщин с сохраненной маткой. Патология эндометрия была выявлена в группе приема ДРСП 0,25 мг/Э 0,5 мг (n=183) в виде гиперплазии эндометрия у 3 женщин (1,6%), в группе контроля (n=180) – у 5 женщин (2,8%). Кровянистые выделения из половых путей были выявлены во время лечения в группе приема ДРСП 0,25 мг/Э 0,5 мг у 26 женщин (29,2%), в группе контроля – у 11 женщин (14,1%). При проведении биопсии эндометрия через 12 недель наблюдения в обеих группах гиперплазии с/без атипии или рака эндометрия выявлено не было.
Исследование Gerlinger C. и соавт. было посвящено оценке рисков патологии эндометрия (гиперплазии) и особенностям кровянистых выделений из половых путей на фоне приема ДРСП 0,25 мг/Э 0,5 мг в течение 1 года. Авторы анализировали изменения эндометрия и картину кровотечения во время непрерывной, длительной терапии ДРСП 0,25 мг/Э 0,5 мг в сравнении с терапией 0,5 мг ацетатом норэтистерона (НЭТА)/Э 1,0 мг (препаратом, содержащим двойную дозу Э, в отличие от ДРСП 0,25 мг/Э 0,5 мг) [38]. Одним из показателей безопасности терапии была доля женщин с гистологически верифицированной патологией («гиперплазия или атипия») по данным биопсии эндометрия, которая оценивалась тремя независимыми патоморфологами. Категории биопсии были основаны на гистологических критериях [39, 40]. Одним из показателей эффективности получаемой терапии была длительность аменореи, согласно дневникам самоконтроля. Также во время исследования авторы оценивали частоту урогенитальных симптомов, психологический статус, физическое здоровье посредством анкетирования. В исследование были включены 662 женщины: 490 – в группу ДРСП 0,25 мг/Э 0,5 мг (группа 1) и 172 – в группу НЭТА 0,5 мг/Э 1,0 мг (группа 2). Группы были сопоставимы по демографическим и оцениваемым клиническим показателям. Средний возраст менопаузы составил 48,9 года, длительность менопаузы в среднем 5 лет. Важно отметить, что побочные эффекты приводили к прекращению приема препарата у 12,2% женщин в группе 2 против 7,3% в группе 1. Кровянистые выделения из половых путей были основной причиной отмены препаратов (1,0% случаев в группе 1 и 2,9% – в группе 2). Данные биопсии эндометрия представлены в таблице.
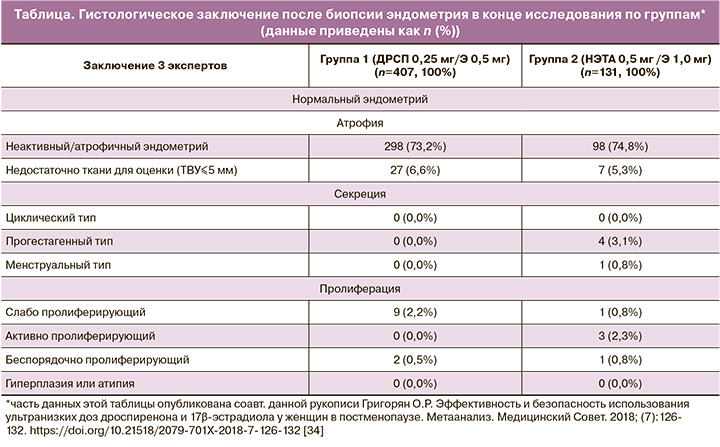
По результатам гистологического исследования в обеих группах не было зарегистрировано гиперплазии эндометрия или онкопатологии.
Средняя толщина эндометрия при первичном обследовании была 2,810 мм (диапазон: 0,40–13,00 мм) в группе 1 и 3,094 мм (диапазон: 0,25–19,80 мм) в группе 2. При проведении трансвагинального ультразвукового исследования (ТВУЗИ) отклонения от нормальных показателей эндометрия были зарегистрированы у 52 женщин (11,6%) в группе 1 и у 20 женщин (13,2%) в группе 2. По окончании исследования внутриматочные изменения (увеличение толщины эндометрия, полипоз эндометрия и миома матки) были выявлены у 5 из 52 женщин (9,6%) в группе 1 и у 2 из 20 женщин (10,0%) в группе 2. Частота отсутствия кровяных выделений из половых путей (аменореи) была выше в группе 1, чем в группе 2 во время 90-дневного 1 периода (69,0% против 56,0%), и была сопоставима в обеих группах в течение 90-дневного 4 периода (79,7% против 82,5% соответственно).
В более поздней работе Gerlinger C. и соавт. была показана безопасность при приеме 1,0/0,5 Э в сочетании с дроспиреноном у женщин в постменопаузе [32].
Таким образом, данное рандомизированное клиническое исследование (РКИ) оценило и показало безопасность в отношении эндометрия ДРСП 0,25 мг/Э 0,5 мг, а также позволило подробно проанализировать характер эндометрия и кровяных выделений из половых путей у данной когорты женщин (постменопауза, интактная матка).
При анализе исследований [32, 34, 38], вероятно, можно сделать вывод, что самыми низкими эффективными дозами МГТ в постменопаузе являются ДРСП 0,25 мг/Э 0,5 мг. Данная комбинация позволяет купировать вазомоторные симптомы климактерического синдрома, оказывая на эндометрий минимально негативное влияние. При анализе РКИ очевидно, что комбинация ДРСП 0,25 мг/Э 0,5 мг обладает крайне низким риском развития пролиферативной патологии эндометрия (гиперплазии с/без атипии или рака), а также стоит отметить снижение частоты кровотечений на фоне приема данной комбинации, что будет способствовать повышению приверженности к терапии. Не стоит забывать, что при назначении МГТ нужно учитывать такие сопутствующие состояния, как ожирение, СД 2 типа, курение и т.д. По результатам изучения фармакокинетики и фармакодинамики было отмечено, что эффективность низких доз ДРСП/Э коррелирует с экспозицией эстрадиола и дроспиренона в сыворотке крови, а курение снижает эффективность МГТ.
На основании демографических данных, в результате старения населения к 2030 г. каждый пятый человек на земле будет в возрасте старше 65 лет [1]. В связи с этим консультирование женщин по вопросам МГТ крайне актуально в клинической практике в рамках позиции оптимизации рисков. Особую актуальность и важность в гинекологии обрели заболевания постменопаузального периода женщины, а именно профилактика, диагностика и лечение пролиферативных процессов эндометрия. Женщин постменопаузального периода относят к группе повышенного риска возникновения внутриматочной патологии на фоне инволютивных изменений матки и яичников и соматического статуса пациентки. По данным различных исследований, частота пролиферативных процессов эндометрия в период постменопаузы зависит от ее длительности и сопутствующей патологии женщины (курение, ожирение, СД 2, артериальная гипертензия). Особенности внутриматочной патологии у женщин старшей возрастной группы остаются актуальной проблемой врача акушера-гинеколога в реальной клинической практике. Для профилактики и выявления пролиферативных заболеваний эндометрия необходимо ежегодное диспансерное наблюдение женщины в постменопаузе у врача-гинеколога [1].
Заключение
Таким образом, в обзоре литературы представлены данные РКИ, в которых был проведен анализ минимально эффективной и безопасной дозы МГТ и ее влияние на состояние эндометрия.



