Артериальная гипертензия (АГ) при беременности – актуальная проблема многих десятилетий и в науке, и в практическом акушерстве. Гипертензивные расстройства осложняют до 30% беременностей [1, 2] и являются неоднородным понятием, включающим в себя несколько нозологических форм – гестационную АГ, преэклампсию (ПЭ), хроническую артериальную гипертензию (ХАГ) и ХАГ с присоединившейся протеинурией (преэклампсией) [3]. Нередко в клинической практике специалистам приходится сталкиваться с трудностями дифференциальной диагностики АГ у беременных. Сложности диагностического поиска могут быть обусловлены несколькими причинами: отсутствием контроля артериального давления женщинами до и во время беременности, физиологической гипотензией на протяжении первого и второго триместра, стабильными значениями артериального давления на фоне гипотензивной терапии у женщин с ХАГ, стертым и малосимптомным течением ПЭ. Таким образом, по данным анамнеза, общему состоянию женщины, уровню артериального давления и протеинурии не всегда удается определить форму АГ, а также оценить истинную тяжесть ПЭ, особенно если она присоединилась к существовавшей ранее гипертензии. Важное медико-социальное значение данной группы осложнений беременности определяет необходимость поиска дополнительных дифференциально-диагностических критериев гипертензивных расстройств у беременных с целью своевременного начала лечения и определения тактики ведения пациенток. Известно, что гипертензивные расстройства у беременных сопровождаются изменениями иммунологических показателей – повышением функциональной активности гранулоцитов, моноцитов, лимфоцитов, активацией системы комплемента, повышением продукции цитокинов [4–6]. Изменение цитокинового профиля с преобладанием провоспалительных фракций (интерлейкин (IL)-6, IL-1β, IL-8, IL-16) сопровождается активацией лейкоцитов и развитием системного воспалительного ответа [7, 8]. Под действием медиаторов воспаления усиливается экспрессия адгезионных молекул на эндотелиоцитах и на циркулирующих клетках крови, что способствует еще большей активации, мобилизации и экстравазации лейкоцитов. Накопление активированных клеток в субэндотелиальном слое и периваскулярном пространстве является основой асептического воспаления и одним из механизмов развития эндотелиальной дисфункции в организме беременной женщины [6, 9]. Вазоспазм и гипоксически-ишемические изменения тканей при эндотелиозе отражают системный характер повреждения сосудистого русла, что клинически проявляется формированием АГ.
Цель исследования: на основании изучения экспрессии молекул клеточной адгезии (CD11b, CD49b и CD99) нейтрофилами и моноцитами венозной крови у беременных с различными формами АГ предложить новые дифференциально-диагностические критерии данной патологии.
Материал и методы исследования
 На базе ФГБУ ИвНИИ МиД им. В.Н. Городкова Минздрава России были обследованы 164 женщины в сроке беременности 20–37 недель. В первую группу вошли 50 женщин с ПЭ (шифр по МКБ-Х – О14.0, О14.1), во вторую – 36 женщин с ХАГ (шифр по МКБ-Х – О10), в третью – 33 женщины с ХАГ с присоединившейся ПЭ (шифр по МКБ-Х – О11). Контрольную группу составили 45 женщин с неосложненным течением беременности без гипертензивных расстройств. Критерии включения в основные группы исследования: женщины с гипертензивными расстройствами при беременности разного генеза и степени тяжести, наличие информированного согласия женщины на участие в исследовании. Согласно Федеральным клиническим рекомендациям «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» (2013 г.) в первую группу включались женщины с АГ (уровень систолического давления 140 мм рт. ст. и выше, диастолического – 90 мм рт. ст. и выше), выявленной после 20-й недели беременности, в сочетании с протеинурией, равной 0,3 г/л и более в суточной моче либо в двух пробах, взятых с интервалом в 6 часов; во вторую группу: женщины с АГ, диагностированной до наступления беременности или до 20-й недели беременности. В третью группу включались женщины с диагностированной ранее хронической АГ и появившейся после 20 недель протеинурией (0,3 г белка и более в суточной моче либо в двух пробах, взятых с интервалом в 6 часов) или с увеличением ранее имевшейся протеинурии; женщины с прогрессирующей АГ, у которых до 20 недели беременности артериальное давление контролировалось. Критерии исключения: острые и обострение хронических воспалительных заболеваний на момент обследования; аллергические реакции на момент обследования; опухоли различной локализации; системные заболевания соединительной ткани; хроническая почечная недостаточность.
На базе ФГБУ ИвНИИ МиД им. В.Н. Городкова Минздрава России были обследованы 164 женщины в сроке беременности 20–37 недель. В первую группу вошли 50 женщин с ПЭ (шифр по МКБ-Х – О14.0, О14.1), во вторую – 36 женщин с ХАГ (шифр по МКБ-Х – О10), в третью – 33 женщины с ХАГ с присоединившейся ПЭ (шифр по МКБ-Х – О11). Контрольную группу составили 45 женщин с неосложненным течением беременности без гипертензивных расстройств. Критерии включения в основные группы исследования: женщины с гипертензивными расстройствами при беременности разного генеза и степени тяжести, наличие информированного согласия женщины на участие в исследовании. Согласно Федеральным клиническим рекомендациям «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» (2013 г.) в первую группу включались женщины с АГ (уровень систолического давления 140 мм рт. ст. и выше, диастолического – 90 мм рт. ст. и выше), выявленной после 20-й недели беременности, в сочетании с протеинурией, равной 0,3 г/л и более в суточной моче либо в двух пробах, взятых с интервалом в 6 часов; во вторую группу: женщины с АГ, диагностированной до наступления беременности или до 20-й недели беременности. В третью группу включались женщины с диагностированной ранее хронической АГ и появившейся после 20 недель протеинурией (0,3 г белка и более в суточной моче либо в двух пробах, взятых с интервалом в 6 часов) или с увеличением ранее имевшейся протеинурии; женщины с прогрессирующей АГ, у которых до 20 недели беременности артериальное давление контролировалось. Критерии исключения: острые и обострение хронических воспалительных заболеваний на момент обследования; аллергические реакции на момент обследования; опухоли различной локализации; системные заболевания соединительной ткани; хроническая почечная недостаточность.
 Средний возраст беременных второй (32,3±0,9 года) и третьей групп (33,2±1,2 года) был достоверно выше, чем в контрольной группе (27,4±1,1 года) (р=0,04 в обоих случаях), средний возраст женщин первой группы составил 28,8±1,2 года. Женщины моложе 25 лет достоверно чаще встречались в первой группе по сравнению со второй и третьей группами (р=0,04, р=0,03 соответственно), а пациенток старше 36 лет было больше в третьей группе по сравнению с первой (p=0,02). Обследованные женщины были сопоставимы по социальному статусу (p>0,05 во всех случаях). У всех беременных с гипертензивными нарушениями была выявлена высокая частота встречаемости хронических заболеваний мочевыводящих путей по сравнению с группой контроля (р<0,05 во всех случаях). Ожирение чаще встречалось у женщин второй и третьей групп по сравнению с контрольной группой (р=0,001, р=0,002 соответственно). Из осложнений гестационного процесса у обследуемых первой группы достоверно чаще по сравнению со второй и третьей группами встречались ранний гестоз (р=0,01 во всех случаях) и фетоплацентарная недостаточность (р=0,002, р=0,03 соответственно). Частота преждевременных родов была достоверно выше у женщин первой и третьей групп в сравнении со второй и контрольной группой (р=0,0001 во всех случаях).
Средний возраст беременных второй (32,3±0,9 года) и третьей групп (33,2±1,2 года) был достоверно выше, чем в контрольной группе (27,4±1,1 года) (р=0,04 в обоих случаях), средний возраст женщин первой группы составил 28,8±1,2 года. Женщины моложе 25 лет достоверно чаще встречались в первой группе по сравнению со второй и третьей группами (р=0,04, р=0,03 соответственно), а пациенток старше 36 лет было больше в третьей группе по сравнению с первой (p=0,02). Обследованные женщины были сопоставимы по социальному статусу (p>0,05 во всех случаях). У всех беременных с гипертензивными нарушениями была выявлена высокая частота встречаемости хронических заболеваний мочевыводящих путей по сравнению с группой контроля (р<0,05 во всех случаях). Ожирение чаще встречалось у женщин второй и третьей групп по сравнению с контрольной группой (р=0,001, р=0,002 соответственно). Из осложнений гестационного процесса у обследуемых первой группы достоверно чаще по сравнению со второй и третьей группами встречались ранний гестоз (р=0,01 во всех случаях) и фетоплацентарная недостаточность (р=0,002, р=0,03 соответственно). Частота преждевременных родов была достоверно выше у женщин первой и третьей групп в сравнении со второй и контрольной группой (р=0,0001 во всех случаях).
Материалом для исследования являлась периферическая венозная кровь. Методом проточной цитофлюориметрии определялось количество нейтрофилов и моноцитов, экспрессирующих молекулы CD11b, CD49b и CD99 на проточном цитофлюориметре FACSCantoII в программе FACSDiva (Becton Dickinson, США). Статистический анализ полученных результатов осуществлялся в пакете прикладных лицензионных программ Microsoft Office 2010, Statistica for Windows 6.0 и MedCalc v7.4.4.1. Проверка рядов данных на нормальность распределения осуществлялась с помощью критериев Колмогорова и Шапиро–Уилка. Достоверность различий между показателями независимых выборок оценивалась по непараметрическому критерию U Манна–Уитни и t-критерию Стьюдента (уровень значимости р<0,05 считался достоверным).
Результаты исследования и обсуждение
Анализ полученных данных показал, что экспрессия молекул адгезии нейтрофилами и моноцитами имеет определенные отличия в зависимости от нозологической формы гипертензивных нарушений (таблица).
Установлено, что у женщин с ПЭ в периферической венозной крови по сравнению с аналогичными показателями группы контроля отмечено достоверное повышение количества CD49b+ нейтрофилов (р=0,01). Наличие ХАГ у женщин ассоциировано с повышенным содержанием CD99+ клеток в популяции нейтрофилов и сниженным уровнем CD11b+ клеток в популяции моноцитов по сравнению с группой контроля (р=0,002, р=0,03 соответственно). В группе женщин с ХАГ с присоединившейся ПЭ выявлено повышение CD99+ и CD49b+ клеток в популяции нейтрофилов по сравнению с группой контроля (р=0,03, р=0,0001 соответственно). Сравнительный анализ показателей в группах между собой выявил, что в отличие от группы женщин с ПЭ при ХАГ имело место достоверное повышение CD99+ и CD49b+ нейтрофилов (р=0,002, р=0,04 соответственно), но более низкое содержание CD11b+ моноцитов (р=0,01); а при ХАГ с присоединившейся ПЭ – повышение уровня CD99+ нейтрофилов (р=0,04). В группе беременных с ХАГ с присоединившейся ПЭ, в отличие от женщин с ХАГ без ПЭ, выявлено повышение содержания CD49b+ нейтрофилов и CD11b+ моноцитов (р=0,0001, р=0,02 соответственно).
Выявленные изменения экспрессии молекул адгезии периферическими фагоцитами при АГ могут быть обусловлены воспалительной реакцией, как было отмечено исследованиями некоторых авторов [10]. Однако различия патогенетических механизмов формирования гипертензии при ПЭ и при ХАГ отражаются и в разнонаправленных изменениях экспрессии молекул адгезии периферическими фагоцитами. Как известно, на каждом этапе транссосудистой миграции клеток при взаимодействии лейкоцитов с эндотелием сосудов участвуют определенные виды молекул адгезии. Поскольку молекулы CD49b задействованы непосредственно на этапе прочной адгезии, вероятно, рост клеток, экспрессирующих данные интегрины, при ПЭ как раз отражает процесс их активации и мобилизации. Вероятно, аналогичным механизмом обусловлено и повышение CD11b+ моноцитов при развитии ПЭ у женщин с ХАГ. Учитывая, что молекулы CD49b экспрессируются на поздних этапах активации лейкоцитов, можно предположить, что активация нейтрофилов имела место в более ранние сроки гестации. Это может быть обусловлено воздействием факторов плодово-плацентарного происхождения [11] либо за счет хронической инфекционно-воспалительной патологии, поскольку наличие инфекционных заболеваний, в том числе урогенитального тракта, рассматривается как фактор риска развития ПЭ, что подтверждается многими исследованиями [12]. Характерное повышение содержания CD99+ нейтрофилов при ХАГ так же может отражать особый механизм формирования АГ при данной нозологической форме. Поскольку данный вид молекул участвует на этапе непосредственного прохождения клеток через сосудистую стенку в периваскулярное пространство, повышение содержания CD99+ клеток может способствовать усиленной транссосудистой миграции лейкоцитов с развитием асептического воспаления, которое носит хронический характер и приводит к деструктивным изменениям коллагенового каркаса сосудистой стенки [6, 10].
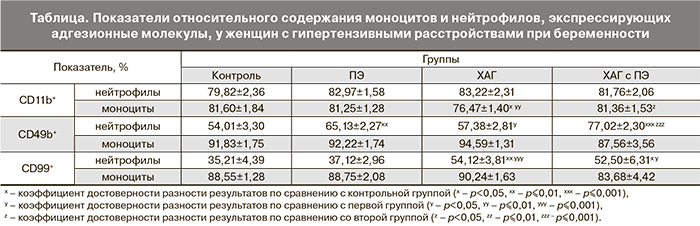
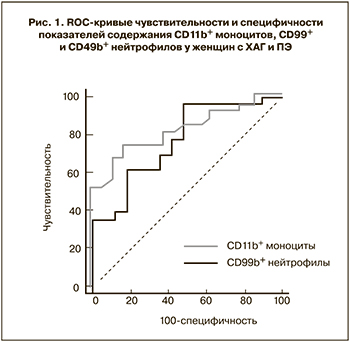
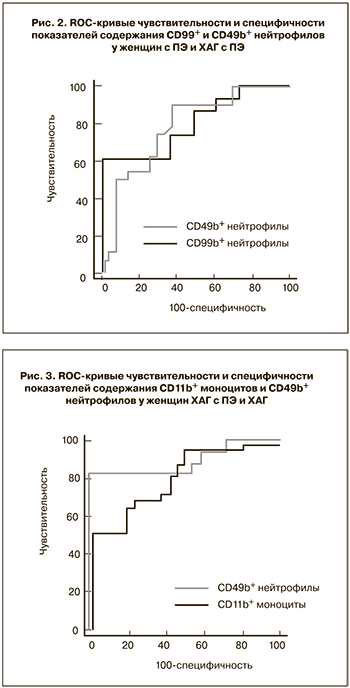
На основании полученных данных с целью выявления наиболее чувствительных и специфичных методов диагностики различных форм гипертензивных нарушений у беременных был проведен ROC-анализ. Выявлено, что определенные значения исследуемых показателей могут являться дополнительными дифференциально-диагностическими критериями разных форм гипертензивных расстройств при беременности. Так, наиболее информативными показателями в дифференциальной диагностике ПЭ и ХАГ оказались: CD99+ нейтрофилы (площадь под ROC-кривой (AUC) составила 0,770, чувствительность 95,7%, специфичность 52,9%) и CD11b+ моноциты (AUC=0,832, чувствительность 74,2%, специфичность 85,7%) (рис. 1). Наибольшая значимость в дифференциальной диагностике ПЭ и ХАГ с присоединившейся ПЭ была отмечена у показателя содержания CD49b+ нейтрофилов (AUC=0,770, чувствительность 88,9%, специфичность 61,5%) и CD99+ нейтрофилов (AUC=0,800, чувствительность 60,0%, специфичность 96,0%) (рис. 2). В диагностике ПЭ у женщин с ХАГ наиболее точными показателями оказались – содержание CD11b+ моноцитов (AUC=0,801, чувствительность 68,2%, специфичность 76,2%) и уровень CD49b+ нейтрофилов (AUC=0,893, чувствительность 88,5%, специфичность 91,7%) (рис. 3).
Заключение
Гипертензивные нарушения у беременных сопровождаются изменением экспрессии молекул адгезии нейтрофилами и моноцитами, что может являться одним из патогенетических механизмов формирования сосудистой воспалительной реакции, эндотелиоза и вазоспазма. Определение уровня моноцитов и нейтрофилов, экспрессирующих молекулы CD11b, CD49b и CD99, в периферической венозной крови у беременных женщин можно использовать в качестве дополнительных диагностических критериев при определении формы АГ с целью определения дальнейшей тактики ведения пациенток.



