На сегодняшний день бесплодие затрагивает каждую седьмую семейную пару. При этом, в четверти случаев нарушение овуляции является основным этиологическим фактором [1]. Нормогонадотропная ановуляция, также классифицируемая, как ановуляция группы II ВОЗ, является наиболее распространенной причиной эндокринного бесплодия. Ановуляция у пациенток данной группы может быть обусловлена, как центральными регуляторными нарушениями, так и овариальными факторами, к которым можно отнести изменение активности овариальной ароматазы [2]. Фермент ароматаза Р450 является ключевым ферментом в образовании эстрадиола (Э2) в гранулезных клетках антральных фолликулов и играет важную роль в определении динамики фолликулогенеза, подготовки эндометрия к имплантации эмбриона, как в физиологических условиях, так и при контролируемой овариальной стимуляции (КОС) гонадотропинами. Активность овариальной ароматазы является одним из определяющих факторов успешного созревания ооцитов [3]. Имеются данные о существенной роли овариальной ароматазы в патогенезе ановуляции; снижение ее активности может приводить к недостаточному синтезу Э2 для запуска положительной обратной связи [4].
На данный момент разработаны различные методики, позволяющие оценивать активность овариальной ароматазы, как с помощью получения ткани яичника или клеток гранулезы, так и косвенным путем. К одной из них относится определение коэффициента активности ароматазы овариальных фолликулов по соотношению Э2 и антимюллерова гормона (АМГ), отражающего число антральных фолликулов на 2 день менструального цикла [5]. Наличие достоверной высокой корреляционной взаимосвязи между экспрессией ароматазы в клетках гранулезы фолликулов, полученных при трансвагинальной пункции в протоколах ЭКО и эмпирически вычисленной активностью овариальной ароматазы [6], позволило нам использовать предложенный метод для оценки активности ароматазы яичников, не прибегая к инвазивным методам. В литературе также существуют данные об ассоциации между ароматазной активностью яичников, определенной по наличию полиморфизма в гене СУР19, и показателями КОС у женщин в протоколах ЭКО [7, 8].
Целью настоящего исследования явилась оценка влияния активности овариальной ароматазы на эффективность протоколов ЭКО/ИКСИ у пациенток с нормогонадотропной ановуляцией.
Материал и методы исследования
В проспективное когортное исследование было включено 98 пациенток с ановуляторным бесплодием. Критериями включения являлись: возраст 20–38 лет, наличие бесплодия, требующего применения ЭКО (ЭКО/ИКСИ), АМГ более 1,0 нг/мл и наличие ановуляторного цикла. Критериями исключения явились: индекс массы тела менее 18 кг/м2 и более 35 кг/м2, наружный генитальный эндометриоз III/IV ст., сахарный диабет 1 типа, наличие противопоказаний для проведения ЭКО согласно приказу МЗ от 30.08.2012 N 107н (ред. от 11.06.2015). Диагноз хронической ановуляции был установлен по наличию аменореи либо опсоменореи с учетом данных ультразвукового исследования (УЗИ) (отсутствие желтого тела), в сочетании с уровнем прогестерона в венозной крови менее 16 нмоль/л во II фазе менструального цикла, и/или при отсутствии пика ЛГ в середину менструального цикла, определяемому с использованием мочевых тест-полосок [9]. Перед началом стимуляции суперовуляции (на 2-ой день менструального цикла) у всех пациенток определяли содержание Э2 и АМГ в сыворотке крови. Активность овариальной ароматазы определялась путем вычисления коэффициента по формуле КА = Э2/АМГ, где КА – коэффициент активности ароматазы овариальных фолликулов; Э2 – базальный уровень эстрадиола в крови на 2 д.м.ц. в нмоль/л; АМГ – уровень антимюллерова гормона в крови на 2 д.м.ц. в нг/мл. При КА меньше 37,8 овариальная ароматазная активность оценивалась как низкая; при КА от 37,8 до 90,7 — нормальная; при КА больше 90,7 — высокая [5].
В зависимости от ароматазной активности фолликулов все пациентки были разделены на 3 группы: I группа – с низкой (60 женщин, 61,2%); II группа – с нормальной (24 человека, 24,5%); III группа – с высокой активностью овариальной ароматазы (14 обследованных, 14,3%).
С целью стимуляции суперовуляции использовался протокол с антагонистами гонадотропин-рилизинг гормона (ГнРГ). Введение рекомбинантного ФСГ (р-ФСГ) (пурегон, Organon, Нидерланды, гонал-Ф, Merck Serono, Италия) проводилось ежедневно со 2–3-го дня менструального цикла. На 5-й день стимуляции суперовуляции проводилась коррекция дозы гонадотропинов и решался вопрос о назначении антагонистов ГнРГ (цетротид, Merck Serono, Швейцария) для предотвращения преждевременного пика ЛГ при достижении одним или несколькими лидирующими фолликулами среднего размера 14 мм. Критерием назначения триггера финального созревания ооцитов являлось достижение тремя лидирующими фолликулами среднего размера не менее 17 мм. В качестве триггера овуляции использовался препарат рекомбинантного хорионического гонадотропина человека (ХГЧ): овитрель в дозе 250 мкг (Merc Serono, Италия), либо агонист ГнРГ – диферелин в дозе 0,2 мг (Ipsen Pharma, Франция).
Через 36 часов после введения триггера овуляции проводилась трансвагинальная пункция фолликулов (ТВП) и аспирация ооцитов. Оплодотворение осуществляли методом ЭКО или ИКСИ по общепринятой методике. Оценку эффективности оплодотворения проводили через 17–18 часов по содержанию в зиготе двух пронуклеусов. Качество эмбрионов оценивали на 4 день [10]. Поддержка лютеиновой фазы у всех пациенток осуществлялась по стандартному протоколу с назначением натурального микронизированного прогестерона вагинально в дозе 600 мг/сутки со дня проведения ТВП. При назначении агониста ГнРГ, в качестве триггера финального созревания фолликулов, использовалась усиленная поддержка с дополнительным применением эстрогенов [11]. Перенос не более 2-х эмбрионов в полость матки проводили на 4–5 день культивирования под контролем УЗИ с помощью мягкого катетера Cook.
Оценивали следующие показатели эффективности протоколов ЭКО: стартовую дозировку гонадотропинов; длительность стимуляции яичников гонадотропинами; курсовую дозу гонадотропинов; количество полученных ооцит-кумулюсных комплексов при ТВП; частоту оплодотворения ооцитов; процент зрелых ооцитов; количество эмбрионов хорошего качества на 4 день развития; эффективную дозу гонадотропинов; количество криоконсервированных эмбрионов; частоту гиперэргического ответа (более 16 ооцитов); толщину эндометрия на момент переноса эмбрионов. Эффективная доза определялась количеством затраченных гонадотропинов для получения 1 ооцита/эмбриона хорошего качества. Частота оплодотворения вычислялась отношением диплоидных зигот к общему числу полученных ооцит-кумулюсных комплексов. Доля зрелых ооцитов определялась отношением ооцитов на стадии MII к общему числу полученных ооцитов пациентки. Биохимической беременностью считали положительный анализ крови на ХГЧ на 14 день после переноса эмбриона. Клинической беременностью считалось наличие плодного яйца с определением сердцебиения по данным УЗИ на 21 день после переноса эмбриона. Оценку частоты наступления беременности и родов проводили в расчете на перенос эмбриона.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). При нормальном характере распределения методы описательной статистики для количественных признаков были представлены как среднее значение (М) ± стандартная ошибка среднего (m). Для оценки межгрупповых различий применяли однофакторный дисперсионный анализ. Для количественных признаков с распределением, отличающимся от нормального, рассчитывали медиану (Ме), 25-го и 75-го процентили (L-H). Для сравнительного анализа данных, полученных в двух группах, использовали критерий U Манна-Уитни, в нескольких группах – критерий ANOVA по Краскелу-Уоллису. Статистическую обработку качественных номинальных данных проводили при построении таблиц 2×2 с применением критерия хи-квадрат (χ2). Различия между группами считались достоверными при р<0,05.
Результаты исследования
Доля пациенток с низкой активностью овариальной ароматазы была наибольшей среди исследованных женщин и составила 61,2%, нормальная активность была определена у 24,5%, а высокая у – 14,3%. В группе с низкой активностью овариальной ароматазы СПКЯ являлся преобладающим фактором бесплодия, в остальных группах основным был трубно-перитонеальный фактор. При сравнении клинико-анамнестических характеристик группы были сопоставимы по индексу массы тела и длительности течения бесплодия. Пациентки с высокой активностью имели более старший возраст среди исследуемых групп. Базальный уровень ФСГ среди групп не отличался, в то время как уровень АМГ был наибольшим в I группе и наименьшим в III (табл. 1).
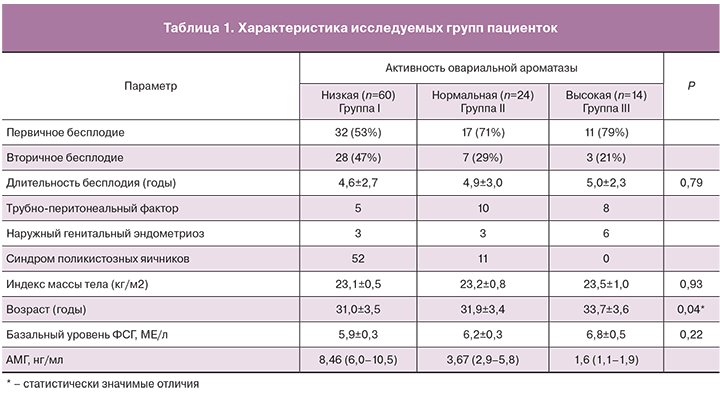
Стартовая доза гонадотропинов в III группе была достоверно выше, чем в I и II группах. Курсовая доза гонадотропинов увеличивалась с повышением активности овариальной ароматазы и была наибольшей в III группе. Число полученных ооцит-кумулюсных комплексов было максимальным в группе с низкой активностью овариальной ароматазы и достоверно превышало этот показатель во II и III группах. ХГЧ в качестве триггера финального созревания ооцитов был использован в I группе в 18% протоколов, во II группе – в 42% и в III группе – в подавляющем большинстве случаев. Гиперэргический ответ на КОС был зафиксирован в 55% случаев в I группе, в 25% – во II группе, а в группе с высокой активностью овариальной ароматазы отсутствовал (табл. 2).
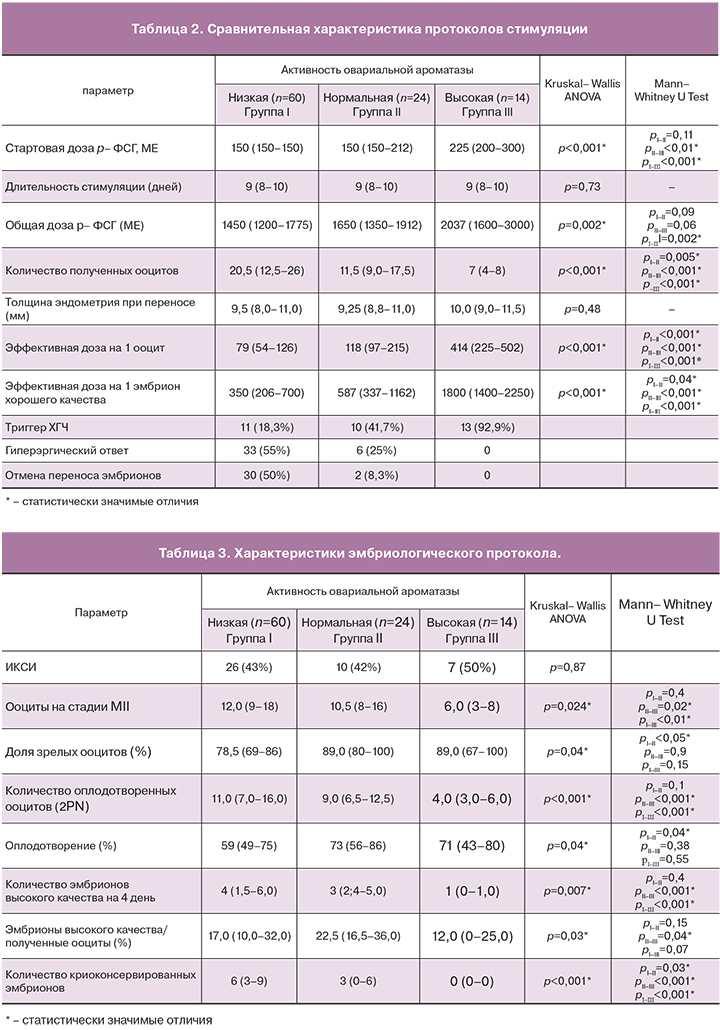
Оплодотворение с применением ИКСИ было проведено у 43 пациенток, частота ИКСИ не отличалась среди исследуемых групп. Количество зрелых ооцитов в группе с низкой и нормальной активностью овариальной ароматазы достоверно превышало число яйцеклеток в группе с высокой активностью. При этом доля зрелых ооцитов от общего числа полученных ооцит-кумулюсных комплксов была максимальной в группе с нормальной и высокой активностью овариальной ароматазы. Во II группе доля зрелых ооцитов достоверно превышала их количество у больных I группы. Аналогичная картина наблюдалась при оценке числа оплодотворенных ооцитов (2PN) и частоты оплодотворения. Так, число диплоидных зигот в группе с низкой и нормальной активностью овариальной ароматазы достоверно превышало данный показатель в III группе. Однако, частота оплодотворения была максимальной во II и III группах, при этом частота оплодотворения во II группе достоверно превышала показатели I группы. Количество эмбрионов высокого качества, так же, как и число криоконсервированных эмбрионов было максимальным в I группе и минимальным в III группе. Доля эмбрионов высокого качества по отношению к числу полученных ооцитов была наибольшей во II группе и достоверно превышала их число у пациентов III группы (табл. 3).
Обсуждение
При изучении частоты отмены переноса эмбрионов в начатых циклах установлено, что отмена переноса преобладала в группе с низкой активностью овариальной ароматазы (50% протоколов). В подавляющем большинстве случаев отмена переноса эмбриона в данной группе была связана с высоким риском развития синдрома гиперстимуляции яичников. Всего перенос эмбриона был осуществлен в 67,3% случаев. Оценка клинических результатов протоколов ЭКО по показателям частоты наступления беременности на перенос эмбриона в свежих циклах показала, что общая частота наступления беременности на перенос составила 28,1%, а частота родов – 21,2%. При подсчете частоты наступления беременности в зависимости от активности овариальной ароматазы были получены значимые различия. Так, частота биохимической, клинической беременностей и родов в группе с низкой активностью овариальной ароматазы была минимальной среди исследуемых групп и составила 10%. Данные показатели были наибольшими в группе с нормальной активностью овариальной ароматазы и составили 45,5%, 40,9% и 31,8% соответственно. Клинические исходы в данной группе достоверно превышали группу с низкой активностью овариальной ароматазы. В III группе данные показатели статистически значимо не отличались от II группы и составили 35,7%; 35,7% и 28,6% соответственно.
У пациенток II группы была зафиксирована одна внематочная беременность и 1 прерывание беременности до 12 недель. В III группе одна беременность завершилась самопроизвольным абортом до 12 недель.
Доля пациенток со сниженной активностью овариальной ароматазы преобладала среди женщин с ановуляторным бесплодием (61,2%). Учитывая высокую частоту снижения активности овариальной ароматазы среди пациенток с нормогонадотропной ановуляцией, можно предположить возможное участие снижения активности данного фермента в патогенезе ановуляции. Причинами снижения активности ароматазы Р450 могут служить как генетические факторы, к которым относят полиморфизм гена CYP19, так и эндокринные. Так, повышенный уровень АМГ, наблюдаемый в группе со сниженной активностью овариальной ароматазы, обладает способностью ингибировать каталитическую активность ФСГ зависимой ароматазы через репрессию гена CYP19 в гранулезных клетках [12].
Возраст пациенток в группе с высокой активностью овариальной ароматазы был достоверно выше, чем в группах с низкой и нормальной активностью овариальной ароматазы, что согласуются с результатами зарубежных авторов [13]. Можно предположить, что возрастное повышение активности ароматазы Р450 компенсирует физиологическое снижение овариального резерва и позволяет поддерживать достаточный уровень Э2. В то же время, более высокая стартовая и суммарная дозы гонадотропинов в группе с высокой активностью овариальной ароматазы свидетельствует о меньшей чувствительности яичников к стимулирующему действию гонадотропинов.
Доля эмбрионов высокого класса была максимальной в группе с нормальной активностью овариальной ароматазы, что возможно, обусловлено как большим числом зрелых ооцитов, большей частотой оплодотворения, так и непосредственным влиянием активности ароматазы Р450 на качество эмбрионов. Это подтверждается исследованием Carpintero N.L. et al. в 2014 году, где изучалась связь между интрафолликулярным уровнем Э2 и качеством эмбрионов [14].
Доза гонадотропинов, затраченная на получение ооцита/эмбриона хорошего качества, была наименьшей в группе с низкой активностью овариальной ароматазы, что объясняется высокой частотой гиперэргического ответа и как следствие, высоким риском развития синдрома гиперстимуляции яичников. В этой группе в 81,3% случаев использовалась замена триггера на агонист ГнРГ с последующей усиленной поддержкой лютеиновой фазы. Число криоконсервированных эмбрионов в данной группе было достоверно больше, чем в группах с нормальной и высокой активностью овариальной ароматазы. Различия в числе криоконсервированных эмбрионов между I и II группами можно объяснить не только более высоким овариальным резервом в I группе, но и большей частотой отмены переноса эмбриона, которое достигало 50% по сравнению с 8% во II группе. Высокий риск синдрома гиперстимуляции яичников в группе с низкой активностью ароматазы Р450 может быть обусловлен тем, что низкая активность фермента приводит к интрафолликулярному повышению андрогенов, способных усиливать влияние ФСГ на клетки гранулезы посредством повышения экспрессии ФСГ рецептора [15].
У пациенток с нормальной активностью овариальной ароматазы наблюдалась большая доля зрелых ооцитов и максимальная частота оплодотворения. Это можно объяснить тем, что интрафолликулярная концентрация Э2 определяет дифференцировку и созревание ооцитов [16]. Работа Lamb J.D. et al. 2010 года также демонстрирует наличие положительной корреляции между интрафолликулярным уровнем Э2 с числом зрелых ооцитов и частотой оплодотворения [17]. В более ранних исследованиях Mendoza C. et al. показал, что более высокий уровень Э2 в фолликулярной жидкости ассоциирован со степенью зрелости ооцитов [18].
Лучшие показатели наступления беременности достигнуты в группе с нормальной и высокой активностями овариальной ароматазы. Аналогичные результаты были получены Neal M.S. et al. в 2004. Данные авторы показали, что ароматазная активность клеток гранулезы, полученных в протоколе ЭКО у забеременевших пациенток, была значительно выше, чем у незабеременевших после переноса одинакового числа эмбрионов [19]. Кроме того, более высокий уровень Э2 в фолликулярной жидкости, высокий показатель соотношения Э2 к тестостерону и максимальный объем фолликулов при пункции связан с наступлением беременности в протоколах ЭКО [14, 20, 21].
Заключение
Учитывая снижение эффективности протоколов ЭКО, высокий риск синдрома гиперстимуляции яичников у пациенток с низкой активностью овариальной ароматазы, целесообразно использование сегментации циклов у этих пациентов с последующим переносом криоконсервированных эмбрионов. Для внедрения такого подхода в широкую клиническую практику необходимо проведение дополнительных проспективных, контролируемых, рандомизированных исследований.



