Считается, что к росту частоты врастания плаценты привело увеличение количества оперативных абдоминальных родоразрешений [1]. Частота врастания плаценты с 1970-х гг. увеличилась почти в 3 раза: с 0,12% до 0,31% [2]. Патологическая плацентация является на сегодняшний день основной причиной массивных кровотечений, органоуносящих операций, материнской заболеваемости и смертности. По данным Росстата Российской Федерации 2016 г., кровотечение в связи с отслойкой и предлежанием плаценты занимает 4-е место в структуре материнской смертности [3].
Так, Akker T. et al. проанализировали результаты 128 исследований, включавших 7858 женщин, которым во время беременности, родов или в течение 6 недель после родоразрешения была выполнена экстренная гистерэктомия в связи с массивным кровотечением. Основными причинами кровотечения послужили: аномальная плацентация (38%), атония (27%) и разрыв матки (26%). Средний объем кровопотери составлял 3700 мл. Следует особо подчеркнуть, что материнская смертность зарегистрирована в 5,2 случая на 100 гистерэктомий (95% CI 0–59,1) [4]. Awan N. et al. (2011 г.) при анализе всех случаев массивных кровотечений с последующей гистерэктомией в период с 1999 по 2008 гг. выявили, что основной причиной экстренной гистерэктомии послужило массивное кровотечение при врастании (54,8%) и предлежании (19,4%) плаценты [5].
На сегодняшний день существуют два основных подхода хирургической тактики при родоразрешении пациенток с врастанием плаценты. Первый – выполнение экстренной или отсроченной гистерэктомии (оставление плаценты в матке с выполнением эмболизации магистральных сосудов и/или использование метотрексата); второй – выполнение органосохраняющего лечения. В ведущих мировых клиниках с накоплением опыта ведения больных с врастанием плаценты прослеживается увеличение частоты применения органосохраняющих методик [6–10].
В ФГБУ «НМИЦ АГП им. В.И. Кулакова» с 2015 по 2017 гг. при врастании плаценты для остановки кровотечения проводилась перевязка внутренних подвздошных артерий или временная окклюзия общей подвздошной артерии. С 2017 г. разработан, запатентован и внедрен новый хирургический метод остановки кровотечения при всех степенях врастания плаценты – комплексный компрессионный гемостаз, который характеризуется простотой выполнения, эффективным и достоверным снижением объема кровопотери и невысокими материальными затратами [9, 11]. В настоящем исследовании проведена оценка эффективности комплексного компрессионного гемостаза в зависимости от степени врастания плаценты в миометрий и соседние органы.
Цель – оценить эффективность применения комплексного компрессионного гемостаза при различных степенях врастания плаценты.
Материалы и методы
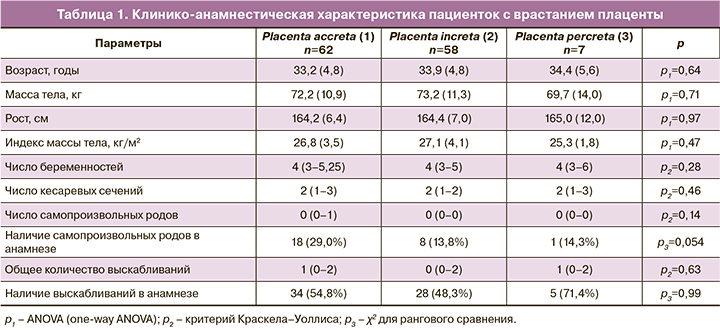
Проведен проспективный анализ данных 127 беременных с диагнозом «врастание плаценты», пролеченных с января 2017 г. по октябрь 2019 г. в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Всех больных разделили на 3 группы в зависимости от степени врастания плаценты. Первую группу составили 62 пациентки с диагнозом placenta accreta, вторую – 58 пациенток с диагнозом placenta increta, третью – 7 пациенток с диагнозом placenta percreta. Степень инвазии плаценты во время беременности определяли по результатам ультразвукового исследования (УЗИ) и магнитно-резонансной томографии (МРТ) с последующей интраоперационной визуальной и морфологической верификацией диагноза.
В 100% случаев операция начиналась и проводилась в условиях комбинированной спинально-эпидуральной анестезии. В 4% наблюдений во время операции проводился переход на общую анестезию в связи с массивным кровотечением и нестабильностью гемодинамики. Всем пациенткам производилось донное кесарево сечение, после чего осуществлялась перевязка пуповины без тракции, погружение ее в полость матки и зашивание матки.
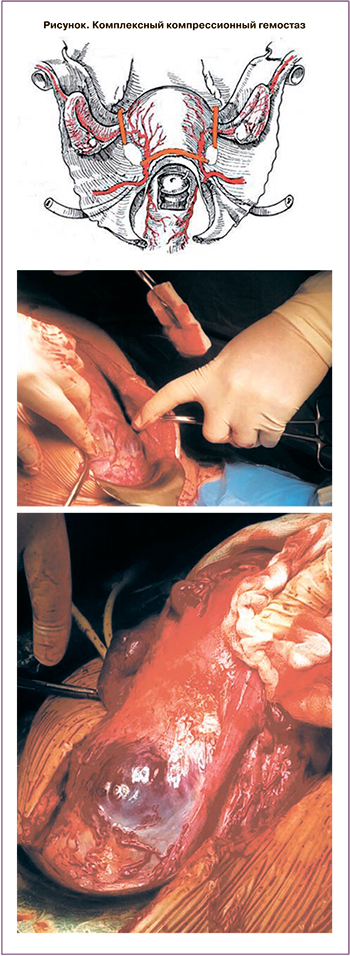 Следующим этапом было осуществление комплексного компрессионного гемостаза (рассечение брюшины пузырно-маточной складки, низведение мочевого пузыря в ряде случаев с его частичной резекцией, с прицельной коагуляцией сосудов, формирование искусственных «окон» в широких связках матки и наложение через них турникетных жгутов билатерально и на шеечно-перешеечную область) (рисунок) [11]. Проводились отведение яичников латеральнее турникетов и создание петли из турникета, в которую попадали маточная труба, мезосальпинкс и собственная связка яичника. В результате пережимались трубные и коммуникантные ветви яичниковой и маточной артерий. Далее проводилось иссечение участка передней стенки матки с вросшей плацентой с последующей метропластикой с использованием управляемой внутриматочной баллонной тампонады. Данный этап длился в среднем 24 минуты. После чего снимались турникеты с одновременным началом введения утеротоников [9].
Следующим этапом было осуществление комплексного компрессионного гемостаза (рассечение брюшины пузырно-маточной складки, низведение мочевого пузыря в ряде случаев с его частичной резекцией, с прицельной коагуляцией сосудов, формирование искусственных «окон» в широких связках матки и наложение через них турникетных жгутов билатерально и на шеечно-перешеечную область) (рисунок) [11]. Проводились отведение яичников латеральнее турникетов и создание петли из турникета, в которую попадали маточная труба, мезосальпинкс и собственная связка яичника. В результате пережимались трубные и коммуникантные ветви яичниковой и маточной артерий. Далее проводилось иссечение участка передней стенки матки с вросшей плацентой с последующей метропластикой с использованием управляемой внутриматочной баллонной тампонады. Данный этап длился в среднем 24 минуты. После чего снимались турникеты с одновременным началом введения утеротоников [9].
Статистический анализ
Для статистического анализа и построения графиков использовали пакет статистических программ GraphPad Prism (GraphPad Software, США). Для определения нормальности распределения использовали обобщенный тест Д᾽Агостино–Пирсона. Данные с нормальным распределением представлены как среднее значение (стандартное отклонение), для их сравнения использовали ANOVA (one-way ANOVA). Для сравнений со статистически значимыми результатами о различии групп по результатам ANOVA проводили апостериорные множественные сравнения с помощью критерия Тьюки (Tukey’s multiple comparisons test). Данные с распределением, отличным от нормального, представлены как медиана (интерквартильный размах), для их сравнения использовали критерий Краскела–Уоллиса. Качественные данные представлены как абсолютное значение (n) и %, для их сравнения использовали χ2 для рангового сравнения. Различия считали статистически значимыми при p<0,05. Чувствительность и специфичность УЗИ и МРТ определяли методом построения таблиц сопряжения. Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России.
Результаты
Средний возраст пациенток составил 33,8 (5,1) года и статистически не отличался по группам. Срок беременности на момент родоразрешения во всех группах не имел статистически значимых различий и составил в 1-й группе 34,4 (1,6) года, во 2-й – 34,4 (1,3) лет и в 3-й – 34,5 (1,2) года соответственно. Число беременностей, операций кесарева сечения, количество выскабливаний матки в анамнезе также не имели статистически значимых отличий. Диагноз врастания плаценты был установлен в 1-й группе на сроке беременности 28 недель (20–30); во 2-й группе – 28 недель (22–30); в 3-й группе – 27 недель (20–34).
Таким образом, беременные в группах статистически не различались по основным анамнестическим, антропометрическим и клиническим данным (табл. 1).
Для диагностики степени и площади врастания плаценты проводили ультразвуковое исследование (УЗИ) и магнитно-резонансную томографию (МРТ). Чувствительность и специфичность МРТ и УЗИ для предварительной постановки диагноза пациенткам всех групп составили 96,9% и 99,9%, 95,4% и 75,5% соответственно.
При измерении объема кровопотери (табл. 2) выявлен статистически значимо больший объем в группе пациенток с placenta percreta (2943 (2032)) мл, по сравнению с пациентками из групп placenta increta (1437 (694,5) мл; p<0,001) и placenta accreta (1187 (632,6) мл; p<0,001). Объем кровопотери между группами пациенток с placenta acсreta и placenta increta статистически значимо не различался (p=0,19).

Во всех случаях оперативного родоразрешения использовалась аппаратная интраоперационная реинфузия аутоэритроцитов, что позволило минимизировать, а в некоторых случаях – исключить применение донорских компонентов крови. При измерении объема реинфузии выявлен статистически значимо больший объем в группе пациенток с placenta percreta (532,9 (391,1) мл), по сравнению с пациентками из групп placenta increta (393,0 (194,3) мл; p=0,04) и placenta acсreta (333,5 (160,9) мл; p=0,02). Объем кровопотери между группами пациенток с placenta acсreta и placenta increta статистически значимо не различался (p=0,22).
Трансфузия свежезамороженной плазмы производилась: в 1-й группе – 13 случаев (20,9%), во 2-й группе – 22 (75,8%), в 3-й группе – 6 (85,7%). Чем тяжелее степень тяжести врастания, тем чаще пациентки нуждались в трансфузии свежезамороженной плазмы (p=0,001). Трансфузия эритроцитарной массы проводилась: в 1-й группе – в 4 случаях (6,4%), во 2-й группе – в 3 (5,1%), в 3-й группе – в 2 (28,5%).
В 10,2% (13 случаев) пациенткам из всех групп было произведено родоразрешение в экстренном порядке при сроке беременности 35,3 недели. В 10 случаях это было обусловлено возникшим кровотечением, а в 3 случаях – началом родовой деятельности. В 4 случаях (6,5%) в группе пациенток с placenta accretа, в 2 (3,4%) – placenta increta и в 2 (28,5%) – placenta percreta произведена резекция мочевого пузыря в связи с невозможностью его низведения из-за выраженного спаечного процесса или инвазии ворсин плаценты в заднюю стенку. Стоит отметить, что срок беременности на момент родоразрешения у данных пациенток составлял 34,6 (1,4) недели и статистически не различался.
Немедленная гистерэктомия в связи с невозможностью остановки массивного кровотечения осуществлена 2 пациенткам из группы placenta accreta и 2 – из группы placenta increta. Отсроченная гистерэктомия в связи с ранним послеродовым кровотечением (средний объем кровопотери 880 (506,1) мл) была произведена 2 пациенткам из группы placenta increta. Отсутствие гистерэктомий в наиболее сложной группе с врастанием по типу placenta percreta объясняется, вероятно, небольшим количеством случаев. Другим возможным объяснением отсутствия взаимосвязи гистерэктомии с типом врастания является тот факт, что не степень инвазии, а именно топография врастания (шейка матки, нижний отдел мочевого пузыря, параметральная клетчатка) определяет возможность сохранения или удаления матки.
Длительность операции в среднем составила 110±32,2 минуты. Пациентки были выписаны на 7-е (2) сутки.
Обсуждение
Описаны три общепринятые формы нарушения плацентации: placenta accreta – приращение ворсин хориона к миометрию, placenta increta – прорастание миометрия, placenta percreta – прорастание серозного слоя миометрия и соседних органов. Последняя форма врастания встречается относительно редко и является наиболее тяжелой в плане возникновения акушерских осложнений [12]. Важным моментом при врастании плаценты, характеризующим исходы для матери, массивность кровопотери во время операции, возможность органосохраняющих операций, является топография врастания в матку и мочевой пузырь. Palacios J.M. впервые предложил, в зависимости от топографии врастания, разделить матку и мочевой пузырь на 2 сектора: S1 (тело матки, верхушка мочевого пузыря) и S2 (шейка матки, верхняя порция влагалища, задняя стенка мочевого пузыря, параметрий). В систематическом обзоре, включающем 34 исследования случаев near miss, в зависимости от топографии врастания плаценты в матку, было выявлено, что все случаи near miss были зафиксированы исключительно при инвазии плаценты в сектор S2. Необходимо подчеркнуть, что во всех случаях near miss массивное кровотечение возникло во время беременности до родоразрешения, а плацента прорастала заднюю стенку мочевого пузыря и параметрий. Авторы отмечают, что тяжелая степень врастания плаценты характеризуется не только наличием разветвленной системы сосудистых анастомозов между мочевым пузырем, маткой и влагалищем, но и, возможно, неососудами, возникающими в результате формирования маточной грыжи [6, 13].
В настоящее время рядом исследователей подвергается сомнению постулат о возможности прорастания плаценты в соседние органы, в частности, в мочевой пузырь в связи с отсутствием у плацентарной ткани потенциала злокачественного роста [14, 15]. Однако данный тезис не всегда находит подтверждение в трудах других авторов [16, 17]. В нашем исследовании при проведении цистоскопии перед операцией у женщин с placenta percreta по данным МРТ и УЗИ не было обнаружено прорастания ворсин хориона в слизистую мочевого пузыря. Это подтверждалось гистологическим исследованием стенки мочевого пузыря при ее резекции.
В 2016 г. в университете Nottingham (Великобритания) прошел конгресс, посвященный сравнению особенностей развития плаценты и раковой опухоли. Плацента человека рассмотрена как единственная «злокачественная» ткань, которая распространяется, вторгаясь в миометрий, и развивается без контроля материнской иммунной системы, и трофобласт определяют как «физиологический метастаз» [16]. Несмотря на то что эмбриогенез является физиологическим и регулируемым процессом, а канцерогенез – патологическим и нерегулируемым, у них существует множество общих черт: автономный пролиферативный потенциал, низкий уровень дифференцировки, относительная устойчивость к апоптозу, активный ангиогенез, инвазивный рост, адгезивные свойства [17].
Основной проблемой, возникающей при родоразрешении беременных с врастанием плаценты, является риск массивной кровопотери и, соответственно, невозможности проведения органосохраняющей операции. Причем, чем глубже степень инвазии плаценты, тем выше риск обозначенных проблем. На сегодняшний день не представляется возможным определить степень врастания плаценты лишь по клинико-анамнестическим данным. Мы не получили статистически значимой разницы при различной степени врастания плаценты по основным анамнестическим, антропометрическим данным, по числу родоразрешений и манипуляций на матке в анамнезе. Важно подчеркнуть, что количество кесаревых сечений в анамнезе значительно увеличивает частоту врастания плаценты, однако в данном исследовании было показано отсутствие влияния этого на глубину инвазии.
Результаты исследования в очередной раз подтвердили высокую эффективность использования УЗИ и МРТ для диагностики степени и глубины врастания плаценты, при условии, что исследования выполняются врачом-экспертом.
Основными методами интраоперационного гемостаза при врастании плаценты являются: комплексный компрессионный гемостаз, перевязка и/или временная окклюзия подвздошных сосудов или аорты [7–10, 18]. По данным ряда авторов, баллонная окклюзия внутренних и общих подвздошных артерий не приводит к уменьшению объема кровопотери, и только баллонирование аорты приводит к достоверному снижению кровопотери [19, 20]. Стоит отметить, что использование данных методов требует дополнительного оборудования и наличия ангиохирурга. Кроме того, существует риск развития артериальных тромбозов [18, 21, 22].
Опыт, накопленный в ФГБУ «НМИЦ АГП им. В.И. Кулакова», также свидетельствует о том, что средний объем кровопотери при использовании дистальных турникетов был статистически меньше на 713 мл по сравнению с временной окклюзией общей подвздошной артерии и на 1121 мл – по сравнению перевязкой внутренних подвздошных артерий [9].
Заключение
В данном исследовании было показано, что существует статистическая значимость между объемом интраоперационной кровопотери при использовании комплексного турникетного гемостаза, объемом проведения трансфузионной терапии и глубиной инвазии плаценты. Особое внимание следует уделять топографии врастания с целью определения техники операции, а также возможности проведения органосохраняющей операции.
Результаты данного исследования показали возможность эффективного использования комплексного компрессионного гемостаза для остановки кровотечения при врастании плаценты любой степени тяжести. Метод является эффективным, выполнимым при наличии опыта проведения подобных операций в учреждении 3-го уровня, требующим меньше финансовых затрат, чем другие существующие методы.



