Обязательным этапом онтогенеза и неотъемлемой частью старения у млекопитающих, в том числе и у человека, является снижение способности контролировать энергетический метаболизм. Митохондриальная дисфункция является одним из патогенетических звеньев формирования болезней старости, которые сопровождаются эндотелиальной дисфункцией (ЭД) [1]. Старение обусловлено генетически детерминированным и нарастающим с возрастом образованием активных форм кислорода (АФК) внутри митохондрий [2]. Глобальным результатом воздействия избыточного количества АФК, превышающего возможности антиоксидантных защитных систем, является повреждение митохондрий и падение их активности (митохондриальная дисфункция), приводящее к снижению энергообеспеченности клетки. В этих условиях снижается возможность репарации окислительных повреждений ядерной ДНК, что и является непосредственным сигналом для индукции апоптотической гибели клеток с последующим снижением клеточности и потери органом его функциональной активности [3].
Отправной точкой для объяснения взаимосвязи между возрастным снижением уровней половых гормонов и развитием митохондриальной дисфункции явилось обнаружение на поверхности митохондрий рецепторов к эстрогенам и андрогенам.
В последние годы наряду с изученными ранее пусковыми генетическими механизмами развития ПНЯ, активно обсуждается вопрос о ключевой роли митохондриальной дисфункции в генезе ускоренного апоптоза, затрагивающего тотальный овариальный резерв и приводящего к преждевременному выключению функции яичников. В обзоре Y. Qin (2015) [4] помимо генетических причин формирования ПНЯ изложены механизмы накопления повреждений митохондриальной ДНК в тканях яичника, приводящего к нарушениям в работе митохондриальной цепи переноса электронов и повышению уровня АФК. Приобретенные или унаследованные мутации и делеции митохондриальной и/или ядерной ДНК, способствующие развитию внутриклеточного и тканевого оксидативного стресса приводят, таким образом, к нарушению рекрутирования фолликулов и их гибели вследствие ускоренного апоптоза [5]. Эстрогены, повышая уровни митохондриальных белков, усиливают защитные механизмы против разрушительного действия АФК на клетку [6]. Снижение продукции эстрадиола с возрастом (после 38 лет) приводит к физиологическому снижению количества митохондрий в гранулезных клетках яичника. Возможно, аналогичные механизмы присущи больным с преждевременным дефицитом эстрогенов, что подтверждается исследованием Bonomi, проведенном в 2012 году, в котором соотношение числа копий митохондриальной и ядерной ДНК у больных с ПНЯ значимо ниже, чем у женщин того же возраста с сохраненным фолликулогенезом [4]. Таким образом, становится очевидным, что снижение овариального резерва коррелирует с уменьшением числа митохондрий и увеличением скорости продукции АФК. Кроме того, осуществление полноценного фолликулогенеза требует адекватной биоэнергетической поддержки, сниженной на фоне уменьшения количества и качества митохондрий при ПНЯ.
Полагают, что истинной причиной окислительного стресса является не продукция АФК как таковая, а нарушение баланса между их генерацией и удалением, то есть сдвиг стационарной концентрации АФК внутри клетки и в тканях. Проявлению негативного, повреждающего действия свободных радикалов и перекисных соединений препятствует многокомпонентная антиоксидантная система (АОС), обеспечивающая связывание и рекомбинацию радикалов, предупреждение образования или разрушения перекисей [7]. Повышение продукции АФК в митохондриях при сниженной емкости АОС приводит также к повреждению митохондриальной электрон-транспортной цепи, к снижению синтеза АТФ и связанному с этим понижению активности АТФ-зависимых ферментов, в результате чего, происходит деполяризация мембраны клеток и индукция каскада программированной клеточной гибели [8, 9].
С другой стороны, известно, что стойкий дефицит эстрогенов способствует развитию патологии эндотелия, характеризующейся систематическим расстройством функции сосудистого русла. Подобный процесс у молодых женщин с ПНЯ можно рассматривать с точки зрения универсальной модели преждевременного старения организма в целом. Данный процесс реализуется за счет нарушения баланса клеточной пролиферации и апоптоза в стенке сосуда, приводящего к уменьшению его просвета, нарушению антитромбогенной активности эндотелия и транскапиллярного обмена. Известно, что основной вазодилататор эндотелия NO∙ (оксид азота (II)), является ингибитором цитохром c оксидазы (COX) митохондрий. Блокирование активности COX приводит к увеличению продукции АФК. Нарастание уровня супероксидного радикала О2∙-, реагирующего с NO∙, способствует формированию пероксинитрита ONOO-, который оказывает выраженное повреждающее действие на белки клеток эндотелия, приводя, в конечном итоге, к накоплению окислительных повреждений и дисфункции эндотелия. Подобное явление имеет место при возрастных изменениях в эндотелии сосудов стареющего организма, индуцируемых контролируемым ростом АФК митохондриального происхождения и сопровождающихся как нарушением внутриклеточной передачи сигналов, опосредуемых уровнем NO∙, так и снижением адаптивного потенциала и барьерной функции эндотелия.
Подводя итоги выше изложенного, представляется интересным выявить взаимосвязь митохондриальной дисфункции с эстрогенным дефицитом и его последствиями в виде ЭД при ПНЯ, как модели преждевременного старения. Предполагается проанализировать возможность развития ПНЯ как малоизученной формы митохондриальной патологии.
Цель исследования: на основе сравнительной оценки показателей митохондриальной функции мононуклеаров периферической крови (МНК) и подкожных фибробластов у женщин с ПНЯ и с сохраненным ритмом менструаций (группе контроля) выявить маркеры, соответствующие развитию митохондриального окислительного стресса и нарушению функции митохондрий, сопровождающиеся ЭД при ПНЯ.
Материал и методы исследования
Исследование было проведено в отделении гинекологической эндокринологии и лаборатории митохондриальной медицины ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. На начальном этапе исследования в I группу (ПНЯ) были включены 32 пациентки в возрасте от 20 до 39 лет (средний возраст 33,1±5,47 года), соответствующие следующим критериям: отсутствие самостоятельных менструаций в течение 6 и более месяцев, уровень ФСГ ³25 МЕ/л (по двум определениям с интервалом в 1 месяц). II группу (контроля) составили 23 женщины в возрасте от 24 до 36 лет (средний возраст 29,39±4,54 года) с регулярным ритмом менструаций и уровнем ФСГ <12 МЕ/л. Критериями исключения для участия в исследовании явились: первичная гипергонадотропная аменорея, ятрогенные причины гипергонадотропной аменореи (операции на яичниках, химио-, лучевая терапия в анамнезе), наличие доброкачественных и злокачественных поражений кожи, тромбозов в анамнезе, тяжелых наследственных (галактоземия, блефарофимоз) или онкологических заболеваний, осложненное течение атеросклероза, нарушение функции печени и почек.
Однако сформированные по критериям включения группы оказались не сопоставимы по возрасту, в связи с чем дальнейшему статистическому анализу были подвергнуты результаты исследования образцов крови только 20 пациенток с ПНЯ и 12 женщин с регулярным менструальным циклом в возрастом диапазоне от 29 до 38 лет, а также 14 и 7 биоптатов кожи в соответствующих группах.
Всем участникам исследования было проведено общеклиническое обследование, включавшее сбор анамнеза, изучение жалоб, оценку репродуктивной функции, определение индекса массы тела (ИМТ).
Определение уровня фолликулостимулирующего гормона (ФСГ), а также эстрадиола (E2) проводилось электрохемилюминесцентным методом на автоматических анализаторах Elecsys 2010, Cobas е 411 («Ф. Хоффманн-Ла Рош», Швейцария), Immulite 2000, Immulite 1000 (Siemens, США) с использованием реагентов тех же фирм.
Оценку липидного состава крови проводили по основным показателям, характеризующим обмен и транспорт липидов: общий холестерин (ХС), триглицериды (ТГ), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), коэффициент атерогенности (КА), аполипопротеин А1 и В (АпоА1 и АпоВ). Всем участникам исследования также определяли уровень мочевой кислоты, глюкозы и высокочувствительного С-реактивного белка (вчСРБ). Исследование проводили с помощью фотометрического и турбидиметрического методов на автоматических анализаторах BA-400, A-25, с использованием реагентов производства Biosystems (Испания).
Функциональное состояние эндотелия оценивали с помощью определения эндотелий-зависимой вазодилатации (ЭЗВД) на фоне реактивной гиперемии (увеличения интенсивности кровоснабжения органа после временного прекращения кровотока в нем) и измерения толщины комплекса интима медиа (ТИМ) общих сонных артерий справа и слева. Исследование выполнялось с использованием метода триплексного ультразвукового сканирования линейным датчиком с фазированной решеткой с частотой 5—13 МГц системы VIVID 7 GE.
Величину ЭЗВД определяли путем измерения диаметра плечевой артерии справа до и после (через 60 секунд) 5-минутной компрессии сосуда манжетой сфигмоманометра с давлением, превышающим систолическое артериальное на 20—30 мм рт.ст. ЭЗВД рассчитывали как процент прироста диаметра плечевой артерии после декомпрессии по отношению к исходному. ТИМ измерялась при ультразвуковом сканировании на расстоянии 10 мм до бифуркации общей сонной артерии справа и слева.
Анализ параметров энергопреобразующей функции митохондрий проводили на МНК и подкожных фибробластах. Для выделения МНК использовали периферическую венозную кровь, взятую у пациенток натощак в пробирки с этилендиаминтетраацетатом (ЭДТА) (Sarstedt). Использовали стандартную методику выделения МНК методом центрифугирования в градиенте фиколла (Sigma) плотностью 1,077 г/мл.
В качестве клеточной модели, альтернативной МНК, использовали подкожные фибробласты, так как согласно проекту европейских рекомендаций по ведению женщин с ПНЯ от 2015 года биопсия яичников и их морфофункциональная оценка при ПНЯ с диагностической целью не показана. Однако МНК представляют собой терминально дифференцированные клетки с низким потенциалом деления и не могут быть использованы, как единственный объект клеток пациента, в связи с чем исследование было дополнено клеточной моделью, обладающей низкой степенью дифференцировки и относительно высоким потенциалом деления.
Выделение подкожных фибробластов осуществляли из биоптатов, полученных методом микробиопсии после получения информированного согласия у 14 пациентов группы ПНЯ и 7 пациентов группы контроля. Размер биоптатов не превышал 0,2×0,2 см, все образцы подвергались ферментативной обработке. Для этого биоптат кожи после выделения в стерильных условиях и механической дизагрегации, обрабатывали раствором DMEM (Sigma)/5% ЭБС/0,1 мг/мл коллагеназы I типа (Worthington Biochemical) и инкубировали кусочки кожи при температуре 37°С в условиях 5% СО2 в течении 15 часов. Полученную суспензию центрифугировали 5 мин при 200 g. Клеточный осадок ресуспендировали в новой порции стандартной среды для фибробластов (DMEM/10% ЭБС/100 ед/мл пенициллина (Gibco, США), 100 ед/мл стрептомицина (Gibco) и культивировали в пластиковых флаконах (Costar, USA) при 37˚С, 5%СО2 в инкубаторе Binder, USA до достижения стадии 70% конфлюэнтности. Для получения суспензии клеток, флаконы обрабатывали изотоническим раствором 0,05% трипсина, 0,53мМ ЭДТА (ПАНЭКО, РФ), реакцию останавливали добавлением избытка среды культивирования. Суспендированные клетки промывали и переосаждали центрифугированием при 100g на центрифуге ELMI, EU.
Для оценки трансмембранного потенциала митохондрий МНК или подкожных фибробластов, выделенные клетки окрашивали флуоресцентным красителем JC1 (Life technologies) по протоколу, рекомендованному производителем. Измерение интенсивности окрашивания проводили методом проточной цитометрии на цитофлюориметре BD FACS Calibur. Оценивали распределение клеток по интенсивности окраски в зеленом и красном канале. Для оценки жизнеспособности клеток использовали краситель пропидий йодид (Life technologies). Для каждой пробы измеряли два показателя: долю высокополяризованных МНК и величину, характеризующую трансмембранный потенциал митохондрий в МНК и подкожных фибробластах. В качестве величины, характеризующей потенциал митохондрий в клетках крови и кожи, использовали интегральный показатель митохондриальной энергопреобразующей функции (ИПМЭФ). ИПМЭФ рассчитывали как (М красный 1/М зеленый 1) — (М красный 2/ М зеленый 2), где М красный 1 и М зеленый 1 – медианы интенсивности свечения высокополяризованных МНК и кожи в интактной пробе на длинах волн 590 и 529 нм соответственно, а М красный 2 и М зеленый 2 - медианы интенсивности свечения высокополяризованных МНК в контрольной пробе, в которую был добавлен разобщитель дыхания митохондрий карбонилцианид-4-(трифторметил)-фенилгидразоном (Sigma) в конечной концентрации 7 µМ.
Для определения уровня оксидативного стресса в плазме крови определяли уровень малонового диальдегида (МДА), активность каталазы, уровень восстановленности глутатиона (GSH) и содержание глутатион-пероксидазы.
 Содержание МДА в плазме крови определяли с помощью 2-тиобарбитуровой кислоты (ТБК). При высокой температуре в кислой среде МДА реагирует с 2-тиобарбитуровой кислотой, образуя окрашенный розовый триметиновый комплекс, содержащий одну молекулу МДА и 2 молекулы ТБК, с максимумом поглощения при 535 нм.
Содержание МДА в плазме крови определяли с помощью 2-тиобарбитуровой кислоты (ТБК). При высокой температуре в кислой среде МДА реагирует с 2-тиобарбитуровой кислотой, образуя окрашенный розовый триметиновый комплекс, содержащий одну молекулу МДА и 2 молекулы ТБК, с максимумом поглощения при 535 нм.
Измерение ферментативной активности каталазы в плазме крови проводили путем регистрации выделения О2 в ходе реакции расщепления H2O2 (2H2O2=2H2O+O2) с помощью оксиграфа (Hansatech, UK). Активность каждого образца измерялась в двух повторностях. Исходя из полученных значений, активность каталазы в плазме крови рассчитывали в Единицах активности на мл (Е/мл), где одна единица соответствует активности фермента, катализирующего превращение одного микромоля субстрата (H2O2) в минуту. Данные для образцов плазмы, в которых произошел сильный гемолиз (степень гемолиза оценивали визуально), не были включены в финальный анализ.
Определение содержания глутатион-пероксидазы в плазме крови проводили методом оценки интенсивности окрашивания специфическими антителами соответствующей белковой полосы после электрофореза белков плазмы и последующего вестерн блот анализа.
Определение содержания общего глутатиона (tGSH) и соотношения концентраций восстановленного и окисленного глутатиона (GSH/GSSG) проводили при помощи 5,5’-дитиобис(2-нитробензойной) кислоты (DTNB) по методу, описанному ранее [10]. Концентрацию GSH определяли по образованию окрашенного продукта реакции 2-нитро-5-тиобензоата (TNB), количество которого пропорционально содержанию сульфгидрильных (–SH) групп в образце. Концентрацию TNB измеряли при 412 нм на спектрофотометре Cary 300 (Agilent, UK). Содержание GSH определяли при помощи калибровочной кривой, построенной в диапазоне 5–100 µM.
Статистическую обработку данных проводили с помощью программы Statistica 6. При нормальном виде распределения данных для оценки различий в группах применялся метод параметрической статистики – t-критерий Стьюдента. При отсутствии нормального распределения данных применяли метод непараметрической статистики – U-критерий Манна–Уитни, для сравнения активности каталазы в исследуемых группах использовали точный критерий Фишера.
Результаты и обсуждение
Клинико-лабораторная характеристика пациентов исследуемых групп
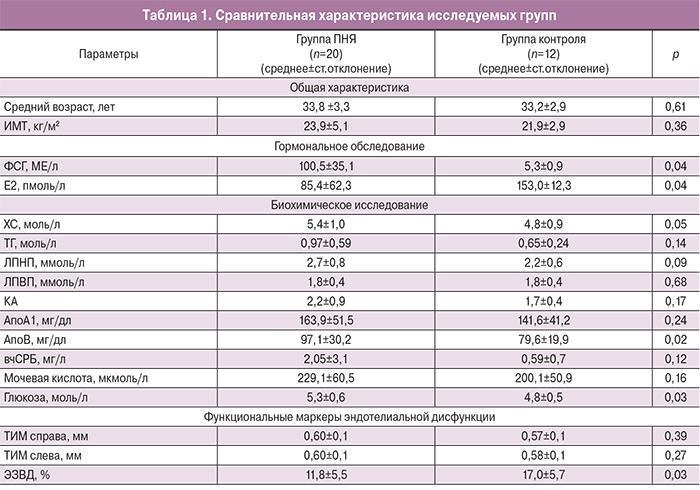
Пациентки исследуемых групп были сопоставимы по возрасту и ИМТ. Анализ встречаемости экстрагенитальных заболеваний не выявил статистически значимых различий между группами. Исследуемые параметры не коррелировали с возрастом пациенток, что позволило в данной работе рассматривать всю выборку как одну возрастную группу. Полученные результаты представлены в табл. 1, 2.
Как видно из табл. 1, уровни ФСГ и эстрадиола были достоверно различимы в обеих группах (p=0,04). Сравнительный анализ биохимических маркеров ЭД показал достоверные различия между уровнями ХС, АпоВ и глюкозы, других различий между группами выявлено не было.
При анализе функциональных маркеров ЭД выявлено достоверное снижение ЭЗВД у больных с ПНЯ (табл. 1), свидетельствующее о наличии ЭД у женщин с эстрогенным дефицитом в сравнении с женщинами с сохраненной функцией яичников.
Цитометрия МНК и фибробластов кожи
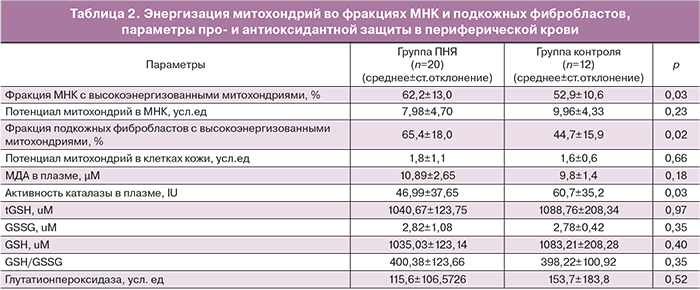
FACS-анализ распределения клеток по степени энергизации митохондрий выявил достоверное повышение процента клеток с высокоэнергизованными митохондриями у женщин с ПНЯ в сравнении с группой контроля (p<0,05) как для МНК периферической крови, так и для подкожных фибробластов (табл. 2).
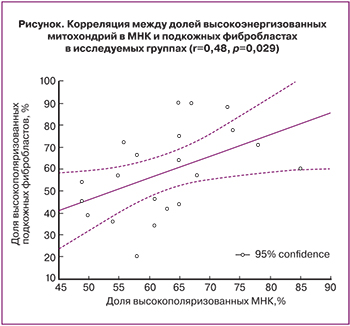
Кроме того, анализ, проведенный по методу ранговой корреляции Спирмена, выявил положительную корреляцию между долей МНК и подкожных фибробластов с высокоэнергизованными митохондриями для обеих групп (r=0,48, p=0,029) (рисунок). Таким образом, данная корреляция позволяет экстраполировать на локальный (тканевой) уровень результаты, полученные на системном уровне, а также опосредованно судить о процессах, происходящих в яичниковой ткани.
При этом анализ абсолютных величин трансмембранного потенциала (ИПМЭФ) митохондрий МНК и фибробластов кожи не выявил достоверных различий между группами ПНЯ и контроля.
Таким образом, показано, что процентные доли МНК и подкожных фибробластов с высокоэнергизованными митохондриями коррелируют между собой с высокой степенью, в связи с чем для получения достоверной информации о размере фракции клеток с высокоэнергизованными митохондриями в общем пуле клеток, можно проводить измерения данного показателя только для периферической крови. Высокие значения трансмембранного потенциала митохондрий МНК и/или большее число клеток с высокоэнергизованными митохондриями также могут свидетельствовать о вероятном развитии состояния хронического окислительного стресса и ассоциированного с ним системного воспаления у больных с ПНЯ, поскольку показана прямая корреляция между величиной трансмембранного потенциала и уровнем продукции АФК.
Окислительный стресс в периферической крови при ПНЯ
Известно, что внутриклеточный уровень продуктов перекисного окисления липидов (ПОЛ) при помощи антиоксидантных защитных систем поддерживается постоянным в достаточно узком диапазоне и служит маркером физиологического состояния биологических структур [6]. Являясь катаболическими интермедиатами, продукты ПОЛ при окислительном стрессе могут выступать в роли, как индукторов, так и первичных медиаторов состояния клетки.
Как видно из данных, приведенных в табл. 2, содержание МДА (маркера ПОЛ) в плазме крови статистически не различалось между группами, что свидетельствует об отсутствии значимого окислительного стресса, несмотря на достоверные различия в уровне эстрадиола в изучаемых группах.
Однако, несмотря на отсутствие прямых указаний на окислительный стресс у больных с ПНЯ на момент измерения уровня ПОЛ в периферической крови, в данной группе была выявлена прямая корреляция между содержанием МДА и величиной фракции МНК с высокоэнергизованными митохондриями (r=0,45, p=0,043). Наконец, в то время как в группе контроля была выявлена обратная корреляция между уровнем МДА и Апо А1 и В (r=-0,76, p=0,003 и r=-0,67, p=0,012 соответственно), оказалось, что в группе ПНЯ такая корреляция отсутствует.
Таким образом, можно предполагать, что, несмотря на отсутствие на момент измерения различий в уровне продуктов ПОЛ в крови пациентов при ПНЯ и в норме, окислительный стресс, возможно, имел место на стадии индукции патологии. При этом наблюдаемое явление компенсации и контроля уровня продуктов и эффекторов окислительного стресса имеет различную природу для группы ПНЯ и контроля.
Антиоксидантные защитные системы в норме и при ПНЯ.
Активность каталазы, фермента антиоксидантной защиты, располагающегося в матриксе митохондрий, в изучаемых группах достоверно ниже в группе ПНЯ в сравнении с женщинами с сохраненным ритмом менструаций (p=0,03) (табл. 2). В то же время, выявлена корреляция между ИМТ и уровнем общего GSH (r=0,57, p=0,042), восстановленного GSH (r=0,57, p=0,042) и отношения GSH/GSSG (r=0,66, p=0,014) у пациентов группы нормы, исчезающая в группе ПНЯ. Кроме того, выявленная у здоровых женщин корреляция между GSH/GSSG и долей МНК с высокоэнергизованными митохондриями (r=0,61, p=0,026) позволяет связать между собой антропометрические параметры и возможный уровень продукции АФК.
Таким образом, в группе женщин с регулярным ритмом менструаций в ответ на тканевой окислительный стресс (при росте значений доли клеток с высокоэнергизованными митохондриями) закономерно растет уровень продуктов ПОЛ (МДА), сопровождающийся синхронным ростом GSH/GSSG в плазме, что приводит к купированию последствий окислительного стресса на системном уровне. В то же время в группе женщин с ПНЯ в ответ на повышение уровня АФК наблюдается индукция высокого уровня МДА параллельно энергизации митохондрий МНК, а также увеличение количества глутатион-пероксидазы в ответ на повреждение фермента, что, вероятно, может свидетельствовать о системном характере ответа организма на состояние транзитного окислительного стресса.
Значительное падение уровня эстрогенов при ПНЯ (табл. 1), вероятно, приводит к снижению митохондриального биогенеза, контролируемого уровнем экспрессии митохондриальных генов, активируемых транскрипционным фактором PGC1a в ответ на связывание лиганда эстрогенового рецептора [11]. Подобное падение активности митохондрий неизбежно снижает уровень доступной свободной энергии в виде внутриклеточной АТФ, что приводит к падению активности шеперонов HSP70 и HSP90, контролирующих стабильность АпоВ в состоянии транслоцируемого комплекса в эндоплазамтическом ретикулуме [12].
Уменьшение числа насцентных полипептидных цепей, связанных с шеперонами в момент ареста транслокации в люмен эндоплазматического ретикулума, снижает скорость деградации АпоВ и увеличивает секрецию этого белка в печени. Увеличение концентрации AпoB во внеклеточном пространстве приводит к накоплению в цитоплазме свободных жирных кислот, выполняющих роль эндогенных разобщителей окислительного фосфорилирования, и вторичному снижению скорости синтеза АТФ митохондриями, формируя, таким образом, петлю положительной обратной связи в отношении уровня AпoB, АТФ и разобщающего действия жирных кислот. Кроме того, отсутствие изменения уровня AпoA1, не находящегося под транскрипционным контролем PGC1a и конкурирующего с AпoB, делает это процесс необратимым и приводит к нарастанию не только разобщения митохондрий, но и к повышению уровня внутриклеточного кальция при эндоплазматическом стрессе. Следствием перегрузки цитоплазмы по кальцию является индукция митохондриальной транзитной поры и выход в цитоплазму проапоптотических белковых факторов, запускающих каскад реакций, приводящих к реализации программы клеточной гибели. Результатом разрушения клеток является накопление в периферической крови и тканях, так называемых DAMP (damage associated molecular patterns) митохондриального происхождения, гомологичных бактериальным факторам воспаления PAMP (pathogen associated molecular patterns). Известно, что нарастание концентрации PAMP является ключевым фактором развития недостаточности яичника у млекопитающих [13].
Заключение
На основании проведенного исследования можно сделать выводы о том, что при манифестации ПНЯ имеет место дисбаланс защитных АОС. Выявленные различия в развитии компенсаторных процессов для группы нормы и ПНЯ, состоящие в выключении глутатион-зависимого звена защитной системы при патологии, позволяют предположить значимость поддержания адекватного уровня глутатиона и других свободных тиолов в плазме крови. В то время как транзитное падение уровня эстрадиола является триггером патологии, митохондриальная дисфункция выполняет роль эффектора патологического состояния и, вероятно, приводит к накоплению митохондриальных DAMP, обладающих повреждающим действием в отношении ткани яичника. Следствием первичной недостаточности яичника является снижение уровня продуцируемых эстрогенов и замыкание петли положительной обратной связи, приводящей к быстрому развитию ПНЯ.



