Несмотря на результаты многочисленных исследований, посвященных различным аспектам проблемы папилломавирусной инфекции (ПВИ), она по-прежнему остается далекой от своего решения [1–11]. Согласно статистическим данным, распространенность ПВИ гениталий в мире увеличилась в 10 раз, встречаясь у 13% населения, что составляет более 660 млн человек [1–3].
Установлено, что в течение жизни инфицированию вирусом папилломы человека (ВПЧ) подвержено от 50 до 80% сексуально активного населения, при этом максимальная распространенность наблюдается в возрасте от 18 до 30 лет [2, 9]. Обращает на себя внимание тот факт, что 82% женщин инфицированы уже через 2 года от начала половой жизни. Кроме того, опасность персистенции ПВИ повышается в 10 раз у женщин старше 30–35 лет [1, 2].
Доказанным является тот факт, что состояние иммунной системы организма определяет характер течения ПВИ, которое может быть транзиторным, латентным или персистирующим [1, 2, 12]. Так, в 70–80% случаев встречается транзиторное течение ПВИ, которое сопровождается спонтанной элиминацией ВПЧ. Данный вариант, как правило, встречается у молодых женщин, не имеющих патологических отклонений в функционировании Т-клеточных иммунных механизмов. Для латентного течения ПВИ характерно отсутствие как клинических, так и морфологических изменений при подтверждении наличия ДНК ВПЧ методами молекулярной диагностики. Известным является тот факт, что ВПЧ способен длительно персистировать в многослойном плоском эпителии. Установлено, что особенности иммунной защиты конкретного организма влияют не только на возможность реинфицирования, но и, главное, на исход длительной персистенции ВПЧ. Согласно многочисленным исследованиям, практически у каждой третьей пациентки при персистенции ПВИ отмечается прогрессирование заболевание [1, 2, 13].
Установлено, что ВПЧ обладает рядом специфических свойств, позволяющих ему «ускользать» от воздействия иммунной системы макроорганизма: ограничение репликационного цикла эпителием, отсутствие виремии и цитолиза, локальная иммуносупрессия за счет вирусных белков и др. [2, 14]. Доказанным является тот факт, что длительная персистенция ВПЧ в тканях органов нижнего отдела генитального тракта способствует активации развития предраковых и раковых процессов. При этом наличие высокоонкогенных типов ВПЧ и их персистенция в течение двух лет и более резко повышают риск развития плоскоклеточных интраэпителиальных поражений и рака шейки матки [1].
Учитывая тот факт, что с позиции клинической иммунологии реализация клеточной трансформации эпителия при ПВИ представляет собой вторичное иммунодефицитное состояние [15–19], основной целью ведения пациенток с латентными формами ВПЧ-инфекции является устранение условий, приводящих к манифестации ПВИ, в первую очередь путем коррекции системных и локальных иммунологических нарушений.
В этом аспекте особого внимания заслуживает препарат инозин пранобекс («Гроприносин–Рихтер», ОАО «Гедеон Рихтер»), обладающий выраженной иммуностимулирующей активностью в сочетании с неспецифическим противовирусным действием. Инозин пранобекс – синтетическое производное пурина, по своему химическому строению представляющее собой комплекс, содержащий инозин и N, N-диметиламино-2-пропанол в молярном соотношении 1:3. Эффективность комплекса определяется присутствием инозина, при этом второй компонент (пранобекс) повышает его доступность для лимфоцитов. Инозин пранобекс стимулирует биохимические процессы в макрофагах, восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитов, а также стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов. Кроме того, стимулирует активность Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, интерферона-гамма (IFN-γ), интерлейкинов IL-1 и IL-2, снижает образование противовоспалительных цитокинов IL-4 и IL-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Механизм противовирусного действия инозина пранобекса обусловлен ингибированием вирусной РНК и дигидроптероатсинтетазы, участвующей в репликации вирусов; усилением подавленной вирусами синтеза мРНК лимфоцитов, что влечет за собой уменьшение синтеза вирусной РНК и трансляции вирусных белков; а также повышение продукции лимфоцитов, обладающих противовирусными свойствами, и IFN-γ и -α [20].
Согласно данным многочисленных исследований, иммуностимулирующая и противовирусная терапия препаратом инозин пранобекс приводит к элиминации ПВИ и полной эпителизации шейки матки, значительно снижая частоту рецидивов и повышая эффективность деструктивных методов лечения ВПЧ-ассоциированных заболеваний [1, 2, 21–25].
Целью настоящего исследования явилось изучение влияния иммуностимулирующей терапии на динамику показателей локального цитокинового статуса и параметров аутоиммунитета у пациенток с латентными формами ПВИ.
Материалы и методы
Нами проведено обследование 96 пациенток в возрасте от 18 до 45 лет с диагностированной латентной формой ПВИ, обратившихся в клинико-диагностическую поликлинику ГБУЗ «Волгоградский областной клинический перинатальный центр №2», ГУЗ «Поликлиника №30» г. Волгограда на этапе планирования беременности за период с 10.2018 по 03.2020 гг. Проведение исследования было одобрено Региональным независимым этическим комитетом ГУ ВМНЦ. От каждой пациентки было получено письменное добровольное информированное согласие на участие в данном исследовании и обработку персональных данных.
Критериями включения в исследование явились: возраст пациенток от 18 до 45 лет, наличие верифицированной латентной формы ПВИ, наличие ВПЧ высокого канцерогенного риска (ВКР); информированное добровольное согласие пациенток на проведение необходимых лечебно-диагностических мероприятий
Критерии исключения: наличие инфекции мочеполовой системы в фазе активного воспаления; терапия иммуномодулирующими препаратами в течение последних 6 месяцев; положительные тесты RW или ВИЧ; тяжелые формы экстрагенитальной патологии; злокачественные новообразования любой локализации; индивидуальная непереносимость используемых лекарственных препаратов; беременность; период грудного вскармливания.
Все пациентки случайным образом были распределены на 2 группы. Основную группу составили 48 пациенток, которым наряду с динамическим наблюдением (через 3 и 12 месяцев), включающим цитологическое исследование, расширенную кольпоскопию и ВПЧ-тестирование, осуществлялся дифференцированный подход к назначению иммуностимулирующего препарата с противовирусной активностью «Гроприносин–Рихтер» (по 1000 мг 3 раза в сутки в течение 28 дней).
В группу сравнения вошли 48 женщин, для которых, согласно Клиническим рекомендациям (протоколам диагностики и ведения больных) «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» от 02.11.2017 г. [26], была выбрана тактика ведения пациенток с нормальными значениями цитологии и положительным ВПЧ-тестом, заключающаяся в динамическом ко-тестировании (цитологическое исследование и ВПЧ-тестирование) с последующей расширенной кольпоскопией (учитывая наличие ВПЧ-ВКР) через 12 месяцев.
Всем пациенткам проводили: общеклиническое обследование, цитологическое исследование мазков с экто- и эндоцервикса (жидкостная цитология с оценкой полученных препаратов согласно классификации Bethesda – The Bethesda System, TBS 2014); ВПЧ-тестирование (качественное и количественное (оценка вирусной нагрузки) генотипирование 12 типов ВПЧ-ВКР методом полимеразной цепной реакции в реальном времени с помощью набора реагентов «АмплиСенс ВПЧ ВКР скрин-титр-FL» в соответствии с рекомендациями производителя ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора (Москва)) и расширенную кольпоскопию.
Кроме общепринятых методов исследования, исходно, через 3 месяца и 12 месяцев от начала наблюдения нами проведено изучение параметров местного иммунитета и аутоиммунитета.
Концентрацию цитокинов (IL-1β, IL-4, IL-10, TNFα, IFNγ) в цервиковагинальной слизи (забор осуществлялся на 7–9-й день менструального цикла) определяли методом твердофазного иммуноферментного анализа (ИФА) с использованием набора реагентов ЗАО «Вектор-Бест» (Новосибирск) по инструкциям, приложенным к данным тест-системам. Анализ полученных данных проводился по стандартной калибровочной кривой с последующим определением концентрации изучаемых цитокинов в пг/мл.
Изучение параметров аутоиммунитета выполнялось методом твердофазного иммуноферментного анализа (ИФА) с использованием специальных наборов реагентов (ЭЛИ-П-Комплекс) в соответствии с рекомендациями производителя – московского медицинского иммунологического центра «Иммункулус». Проводилось полуколичественное определение регуляторных аутоантител (аутоАТ) класса IgG в сыворотке крови обследуемых больных [27]. Контрольную группу составили 30 здоровых женщин репродуктивного возраста, обратившихся в клинико-диагностическую поликлинику ГБУЗ «Волгоградский областной клинический перинатальный центр №2» с целью подбора метода контрацепции.
Длительность наблюдения за пациентками составила 12 месяцев. Критериями эффективности тактики ведения пациенток с латентными формами ПВИ явились: отсутствие реализации латентной формы ПВИ в цервикальную интраэпителиальную неоплазию; доля пациенток с полной элиминацией ВПЧ (негативация ДНК-ВПЧ); снижение клинически значимой вирусной нагрузки.
Статистическая обработка полученных данных выполнялась с помощью пакета Statgraphics Centurion18 (разработчик – Statgraphics Technologies Inc.), накопление и визуализация данных – в программе Microsoft Excel 2010 (разработчик – Microsoft Inc.). Для количественных параметров выполнялась проверка гипотезы о нормальности распределения с использованием критерия Шапиро–Уилка, с учетом принятой гипотезы далее были определены: среднее значение (М), стандартное отклонение (SD), данные представлены в виде М (SD). Значимость различий сопоставляемых средних величин определялась для независимых данных по t-критерию Стьюдента, для связанных групп использован парный t-критерий. Для качественных данных определялась частота встречаемости (%), для сравнения изучаемых независимых групп использовался критерий χ2 Пирсона, для связанных групп – критерий Мак-Немара. Статистически значимыми считались отличия при наименьшем уровне значимости p<0,05. Для номинальных переменных рассчитывался относительный риск с 95% доверительным интервалом (95% ДИ).
Результаты и их обсуждение
В ходе исследования установлено, что в возрасте от 18 до 25 лет было 26 (27,1%) пациенток, в то время как в большинстве случаев (57,3%) возраст больных колебался от 26 до 35 лет. В возрасте от 36 до 45 лет находились 15 (14,8%) женщин.
В ходе проведенного анализа распределения типов вируса ВПЧ у обследуемых пациенток установлено, что среди высококанцерогенных типов преобладали 16 (64,6%), 18 (53,1%), 31 (16,7%) и 51 типы (16,9%) (рис. 1).
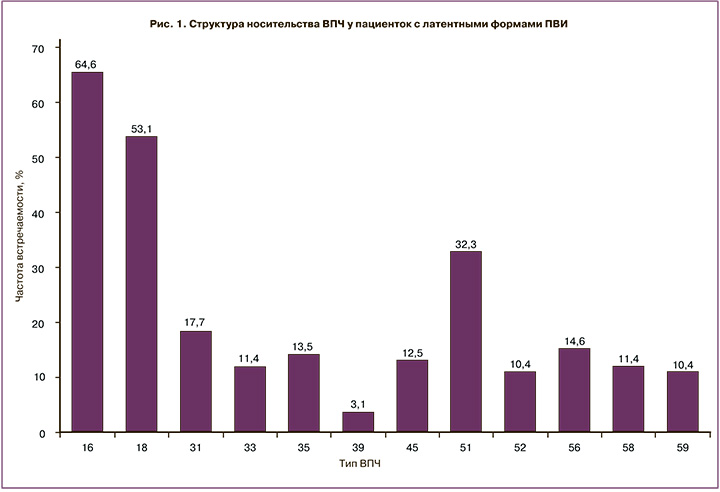
При оценке распределения пациенток с латентными формами ПВИ по количеству одновременно выявленных типов ВПЧ отмечено, что в 45,8% случаев диагностировали один тип ВПЧ, у каждой третьей пациентки (31,3%) обнаружено два типа ВПЧ. Максимальное количество одновременно выявленных типов ВПЧ (5 типов) диагностировано лишь у трех обследуемых.
Результаты количественного генотипирования показали, что в изучаемой когорте пациенток клинически значимая вирусная нагрузка (от 3 до 5 lg ВПЧ на 100 000 клеток) выявлена у 45 (46,8%) женщин, в то время как повышенная концентрация ДНК ВПЧ (более 5 lg ВПЧ на 100 000 клеток) диагностирована у 33 (34,4%) больных. Таким образом, «значимая» вирусная нагрузка (от 4,2 до 6,4 lg ВПЧ на 100 000 клеток) была выявлена у 78 (81,2%) пациенток.
В соответствии с критериями включения у всех пациенток отсутствовали патологические изменения в результатах цитологического исследования, а также в ходе проведения расширенной кольпоскопии.
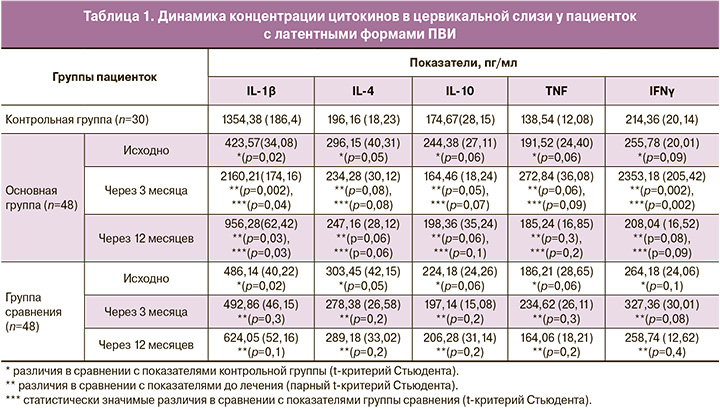
Проведенные иммунологические исследования выявили статистически значимое снижение (p<0,001) концентрации IL-1β у обследуемой когорты пациенток, на фоне незначимого (p>0,05) повышения концентраций цитокинов IL-4, IL-10, TNF и IFNγ (табл. 1), что свидетельствует о выраженных дисфункциональных изменениях Th-1-клеточного иммунного ответа, характеризующегося дисбалансом секреции цитокинов, который, как известно, повышает вероятность персистенции ВПЧ, способствуя развитию цервикальной интраэпителиальной неоплазии.
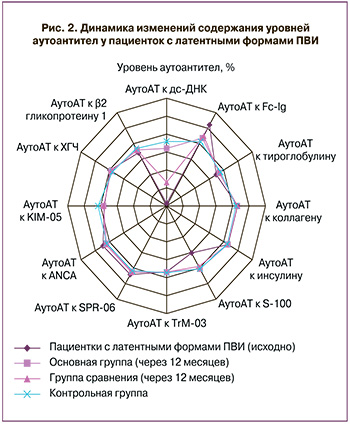 В ходе проведенного исследования установлено, что у 78 (81,2%) обследуемых с латентными формами ПВИ отмечался выраженный дисбаланс показателей аутоиммунитета. Обращает на себя внимание тот факт, что у данной когорты пациенток выявлена клинически значимая или повышенная вирусная нагрузка. Установлено статистически значимое снижение (p<0,001) уровней аутоантител к двуспиральной ДНК (-38,52 (2,12)%) в сравнении с женщинами контрольной группы (-4,04 (1,16)%), а также выраженный дисбаланс профилей аутоАТ к белку S-100, который играет важную роль в регуляции и упорядочении процессов апоптоза (рис. 2). Следует отметить, что у 16 (16,7%) пациенток, концентрация ДНК ВПЧ у которых была расценена как малозначимая, диагностировано пограничное (умеренное) отклонение уровней аутоАТ к двуспиральной ДНК (-27,94 (1,98)%) в сочетании с незначительным дисбалансом профилей аутоАТ к белку S-100.
В ходе проведенного исследования установлено, что у 78 (81,2%) обследуемых с латентными формами ПВИ отмечался выраженный дисбаланс показателей аутоиммунитета. Обращает на себя внимание тот факт, что у данной когорты пациенток выявлена клинически значимая или повышенная вирусная нагрузка. Установлено статистически значимое снижение (p<0,001) уровней аутоантител к двуспиральной ДНК (-38,52 (2,12)%) в сравнении с женщинами контрольной группы (-4,04 (1,16)%), а также выраженный дисбаланс профилей аутоАТ к белку S-100, который играет важную роль в регуляции и упорядочении процессов апоптоза (рис. 2). Следует отметить, что у 16 (16,7%) пациенток, концентрация ДНК ВПЧ у которых была расценена как малозначимая, диагностировано пограничное (умеренное) отклонение уровней аутоАТ к двуспиральной ДНК (-27,94 (1,98)%) в сочетании с незначительным дисбалансом профилей аутоАТ к белку S-100.
В соответствии с протоколом исследования все пациентки случайным образом были разделены на 2 группы: основная группа (n=48), в которой наряду с динамическим наблюдением дифференцированно (с учетом состояния аутоиммунитета и результатов концентрации ДНК ВПЧ) назначали (n=40) иммуностимулирующий препарат с противовирусной активностью «Гроприносин–Рихтер» (контроль осуществлялся через 3 и через 12 месяцев); ведение остальных пациенток (n=8) проводилось в соответствии с Клиническими рекомендациями (протоколами диагностики и ведения больных) «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» от 02.11.2017 г. [20] (контроль осуществлялся через 12 месяцев); группа сравнения (n=48), в которой на основании Клинических рекомендаций выполнялось динамическое ко-тестирование (цитологическое исследование и ВПЧ-тестирование) через 12 месяцев.
Через 3 месяца от начала лечения в ходе цитологического скрининга и расширенной кольпоскопии у пациенток основной группы, получавших иммуностимулирующую и противовирусную терапию препаратом «Гроприносин–Рихтер», аномальных результатов выявлено не было.
Установлено, что ПЦР негативация или клинически малозначимая вирусная нагрузка выявлена у 33 (82,5%) больных, в то время как клинически значимая концентрация ДНК ВПЧ (в среднем составила 3,92 (0,46) lg ВПЧ на 100 000 клеток) сохранялась лишь в 17,5% случаев, что свидетельствовало об эффективности проводимой иммунопротивовирусной терапии (χ2=11,8; p<0,001).
Через 2 месяца после окончания иммуностимулирующей терапии препаратом «Гроприносин–Рихтер» диагностировано статистически значимое (p<0,001) увеличение в цервикальной слизи концентрации цитокина INFγ на 1871 (1530;2120) пг/мл и повышение концентрации IL-1β на 1123 (824;1540) пг/мл на фоне незначительного увеличения (p>0,05) концентрации IL-4, IL-10, что свидетельствовало об устранении исходного дисбаланса цитокинов.
Спустя 3 месяца от начала лечения в группе пациенток, которым проводилась терапия препаратом «Гроприносин–Рихтер», нормализация уровней аутоантител диагностирована в 77,5% случаев (χ2=16,4; p<0,001), статистически значимое улучшение показателей аутоантител в сравнении с исходными значениями – у 9 (22,5%) пациенток (χ2=4,1; р=0,04). Полученные данные свидетельствуют об активации процессов апоптоза у данной когорты пациенток и снижении риска персистенции ПВИ.
Повторное цитологическое исследование, проведенное через 12 месяцев от начала наблюдения, показало отсутствие патологических изменений у пациенток основной группы, в то время как в 10,4% случаев больных группы сравнения выявлены признаки, характерные для LSIL (в последующем морфологически верифицированные как CIN I) (χ2=4,22; р=0,04; ОР 5,1; 95% ДИ 2,4–7,2).
Через 12 месяцев от начала наблюдения полная элиминация ВПЧ установлена у 42 (87,5%) пациенток основной группы, что было чаще, чем в группе сравнения (χ2=5,9; р=0,005; ОР 0,5; 95% ДИ 0,32–0,66) (табл. 2). Клинически малозначимая вирусная нагрузка выявлена у 4 (8,3%) больных (χ2=5,0; р=0,03). И лишь у двух пациенток (4,2%) с верифицированным сочетанием пяти типов ВПЧ сохранялась клинически значимая вирусная нагрузка (χ2=4,9; р=0,02; ОР 0,45; 95% ДИ 0,20–0,65).
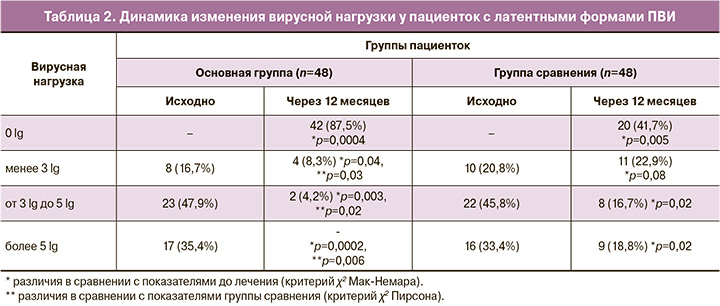
В группе сравнения ПЦР-негативация и клинически малозначимая вирусная нагрузка диагностированы у 31 (64,6%) пациенток, в то время как повышенная вирусная нагрузка установлена в 18,8% случаев, что свидетельствует о персистирующем течении ПВИ (χ2=4,8; р=0,02).
При проведении расширенной кольпоскопии патологических изменений у женщин основной группы выявлено не было, при этом у 5 (10,4%) пациенток группы сравнения диагностированы аномальные кольпоскопические картины, характеризующиеся наличием слабовыраженных изменений многослойного плоского эпителия шейки матки (тонкий, плоский или слегка приподнятый над поверхностью ацетобелый эпителий, с неровными, нечеткими краями; нежная, регулярная мозаика, расположенная плоско; нежная, регулярная пунктация, расположенная плоско; частичное, нерезко выраженное йоднегативное окрашивание).
Результаты иммунологического исследования, проведенного через 12 месяцев от начала лечения в основной группе, выявили статистически значимое (р<0,001) снижение концентрации цитокина IFNγ, сопоставимое с показателями контрольной группы (табл. 1), что, вероятно, можно объяснить подавлением репликации ВПЧ и устранением локальных воспалительных изменений в эпителии шейки матки. Данные иммунологического исследования пациенток группы сравнения в динамике свидетельствовали о сохраняющемся нарушении работы клеточных механизмов иммунитета, следствием чего является манифестация ПВИ с развитием неопластических процессов.
Спустя 1 год от начала лечения в основной группе нормализация содержания уровней аутоантител отмечена у 46 (95,8%) пациенток, что было чаще, чем в группе сравнения (64,6%) (χ2=7,4; р<0,001; ОР 0,21; 95% ДИ); а статистически значимое улучшение показателей аутоантител – в 4,2% случаев (χ2=3,97; р=0,04; ОР 0,82; 95% ДИ). Полученные данные свидетельствуют об устранении исходного дисбаланса показателей иммунореактивности до значений, сопоставимых с показателями контрольной группы (рис. 2). У 9 (18,8%) женщин из группы сравнения в динамике после окончания лечения не было выявлено значимых изменений иммунологических показателей, что обуславливает персистирующее течение ПВИ (χ2=9,0; р<0,001; ОР 3,8; 95% ДИ 1,6–5,4).
Обращает на себя внимание статистически значимое повышение среднего содержания профилей аутоАТ к двуспиральной ДНК (на 30,5 (21,8;39,6)%) и белку S-100 (на 9,2 (8,8;9,6)%) у пациенток основной группы (p<0,001) (рис. 2). Результаты лечения больных группы сравнения показывают сохраняющееся умеренное снижение профилей аутоАТ к двуспиральной ДНК на фоне статистически незначимого повышения профилей аутоАТ к белку S-100 (p>0,05) (рис. 2). Данный факт свидетельствует о недостаточной эффективности тактики динамического наблюдения и, как следствие этого, высоком риске персистенции ВПЧ с последующим развитием неопластических процессов в эпителии шейки матки.
Анализ исходов латентных форм ПВИ через 12 месяцев показал, что в основной группе полная элиминация ВПЧ наблюдалась у 42 (87,5%) пациенток (χ2=5,9; р=0,005; ОР 0,5; 95% ДИ 0,32–0,66), клинически малозначимая вирусная нагрузка – в 8,3% случаев (χ2=5,0; р=0,03; ОР 0,42; 95% ДИ 0,20–0,61), что способствовало статистически значимому снижению концентрации ВПЧ-ВКР на 2,7 (1,8;4,6) lg ВПЧ на 100 000 клеток (p<0,001). В ходе динамического наблюдения пациенток группы сравнения ПЦР-негативация отмечена в 41,7% случаев, клинически малозначимая концентрация ВПЧ-ВКР – у 8 (16,7%) женщин, при этом клинически значимая вирусная нагрузка сохранялась в 16,7% случаев, а повышенная вирусная нагрузка – у 9 (18,8%) женщин, что привело к незначительному снижению (p>0,05) концентрации ВПЧ-ВКР и реализации латентной формы ПВИ в CIN I в 10,4% случаев (χ2=4,22; р=0,04; ОР 5,1; 95% ДИ 2,4–7,2).
Заключение
Таким образом, проведение иммуностимулирующей и противовирусной терапии препаратом «Гроприносин–Рихтер» у пациенток с латентными формами ПВИ приводит к устранению исходного дисбаланса цитокинов и нормализации содержания уровней аутоантител, что свидетельствует о блокировании локальных воспалительных изменений в эпителии шейки матки.



