В конце прошлого века Barker D.J. (1990) ввел понятие «фетального программирования» [1], проиллюстрировав, как эпигенетические факторы окружающей среды, действующие на ранних этапах развития человека, влияют на риск развития поздних хронических, особенно неинфекционных, заболеваний. В описанном процессе программирования участвуют ткани материнского организма, рацион ее питания, маточно-плацентарный кровоток и плацентарная функция, патологические изменения в которых приводят к метаболическим и эндокринным изменениям у плода, являющимся первопричиной постнатального развития сердечнососудистых, нервных и эндокринных заболеваний в более позднем возрасте.
В течение последних десятилетий эта концепция получила дальнейшее развитие в связи с существованием потенциальной возможности предотвращения осложнений путем медицинского воздействия в преконцепционный и внутриутробный периоды у пациенток повышенного риска, что может стать механизмом улучшения показателей качества и продолжительности предстоящей жизни человека [2, 3].
Показано, что нормальная функция плаценты является фактором первостепенной важности в антенатальном периоде, имеющем долгосрочное влияние на подверженность человека хроническим заболеваниям во взрослом возрасте [3, 4]. В частности, была ярко показана связь между низким весом при рождении и риском развития диабета 2 типа, ожирения, неврологической и кардиальной патологии в более позднем возрасте [2, 4–6].
Для Российской Федерации проблема рождения маловесного ребенка является более чем актуальной, поскольку ежегодно замедленный рост и недостаточность питания диагностируются у более чем 98 тыс. новорожденных, составляя 5,7% от числа доношенных и 14,5% от числа недоношенных детей [7]. Данные официальной статистики свидетельствуют, что от рождения до 14-летнего возраста болезни эндокринной системы, расстройства питания и нарушения обмена веществ диагностируются у 4,2% детей, болезни нервной системы – у 9,1% детей, органов кровообращения – у 1,9% детей. В возрасте 15–17 лет частота данных патологий увеличивается до 10,2%, 12,4% и 5,2% соответственно [7]. Среди взрослого населения эти заболевания являются одними из ведущих причин временной потери трудоспособности, инвалидизации и смерти [8].
Учитывая потенциальную возможность снижения данных показателей за счет выявления беременных группы высокого риска, представляются крайне важными разработка и внедрение дополнительных диагностических инструментов для прогнозирования, дородового контроля за развитием и функциональным состоянием плода, а также профилактики и возможных вариантов лечения задержки его роста [9, 10].
Как известно, при задержке роста плода в функционировании его сердечно-сосудистой системы возникают изменения, направленные на снижение потребления кислорода и перераспределение сердечного выброса с преимущественной перфузией головного мозга (так называемый brain sparing) [11]. Однако, имея первоначально протективную функцию, длительно существующее внутриутробное перераспределение кровотока ассоциируется с развитием после рождения более серьезных нарушений нервной системы ребенка в сравнении со случаями задержки роста без допплеровских признаков централизации [12]. Исследования новорожденных демонстрируют сохранение антенатально возникшего усиления перфузии головного мозга, которое может привести к гипероксии и дальнейшему повреждению нервной ткани [13].
Для антенатальной оценки подобного перераспределения в последние годы в научных публикациях всего мира активно используется церебрально-плацентарное отношение (ЦПО) – показатель, совмещающий разнонаправленные изменения пульсационных индексов (ПИ) в средней мозговой артерии плода и артериях пуповины, внесенный международным консенсусом (2016) [14] и международной организацией ультразвука в акушерстве и гинекологии (ISUOG) (2019) [15] в обязательные критерии диагностики поздней задержки (замедления) роста плода.
Исследование Monteith et al. (2019) [16] продемонстрировало, что антенатальное снижение ЦПО у плодов с задержкой роста значительно увеличивает риск задержки неврологического развития в возрасте трех лет, что, по мнению авторов, делает данный критерий обязательным компонентом допплеровского исследования и консультирования родителей о потенциальных отдаленных осложнениях. Отнесение определения ЦПО к обязательным показателям диагностики состояния плода поддерживают и российские исследователи, например, Троханова О.В. и соавт. (2018) [16], выявившие 17-кратное повышение частоты задержки роста среди плодов со снижением ЦПО. Ряд зарубежных авторов [17, 18] относят снижение ЦПО к маркерам недостижения плодом потенциала своего роста, постулируя целесообразность определения данного отношения при ультразвуковом исследовании плодов, независимо от их предполагаемой массы. По результатам исследования Hernandez-Andrade et al. (2018) [19], снижение ЦПО в 20–24 недели беременности может быть использовано для прогнозирования задержки (замедления) роста плода, развивающейся в более поздние сроки беременности.
Однако противоположные результаты получены в ряде других исследований; к примеру, Akolekar et al. (2019) [20] и Leavitt et al. (2019) [21] не выявили достоверного повышения эффективности прогнозирования рождения маловесного для гестационного возраста ребенка и ассоциированных с маловесностью неблагоприятных перинатальных исходов за счет безвыборочного изучения ЦПО.
Еще один аспект и дополнительные сведения были опубликованы Zohav et al. (2019) [22], который в крупном ретроспективном анализе продемонстрировал значительные преимущества использования локальных, разработанных на собственной когорте беременных, нежели внешних референсных значений ЦПО.
Показатели кровотока в маточных артериях не вошли в критерии диагностики задержки роста плода после 32 недель беременности [14, 15] и не используются как критерии для выбора времени для родоразрешения [23]. Однако повышение ПИ в маточных артериях значимо ассоциируется с задержкой роста плода [24], в том числе у первобеременных исходно низкого риска [25], и с развитием перинатальных гипоксических осложнений, вне зависимости от веса плода [26].
Для включения этого важного показателя в комплексную систему допплеровской оценки кровотока в 2019 г. MacDonald et al. [27] был предложен новый комбинированный показатель: церебрально-плацентарно-маточное отношение (ЦПМО), включающий в одномоментный анализ ПИ средней мозговой артерии, артерий пуповины и маточных артерий. В своем проспективном когортном исследовании, проведенном в 36 недель гестации у 347 первобеременных, авторами была продемонстрирована большая эффективность прогнозирования задержки роста плода при использовании ЦПМО, нежели ЦПО.
В нашей стране исследования, посвященные анализу ЦМПО, до настоящего момента не опубликованы, в связи с чем представляется интересным исследование обоих комбинированных допплеровских показателей: ЦПО и ЦПМО с определением их процентильных значений для российской популяции, что и явилось целью настоящего исследования.
Материалы и методы
Нами был осуществлен ретроспективный безвыборочный анализ результатов обследования 1215 беременных, прошедших в амбулаторных условиях ООО «Центр Медицины Плода Медика» в 2016–2018 гг. ранний комбинированный скрининг в сроки 11–13 недель беременности и ультразвуковые исследования в 24–40 недель беременности.
Критериями включения были: одноплодная беременность, закончившаяся родами в сроке 24 недели беременности и более, живой плод в полости матки на момент выполнения исследования, отсутствие данных о генетической и структурной патологии плода и ребенка, запротоколированные результаты допплеровского исследования, информированное согласие пациентки на участие в исследовании с предоставлением данных об исходах беременности. Критерии исключения – многоплодная беременность, врожденные пороки развития и хромосомные аномалии плода/новорожденного, отсутствие результатов допплеровского исследования кровотока, несогласие пациентки с участием в исследовании.
Срок беременности устанавливался согласно рекомендациям международного проекта INTERGROWTH-21st по копчико-теменному размеру (КТР) плода в 11–13 недель беременности [28].
Ультразвуковое исследование после 24 недель беременности проводилось по назначению лечащих врачей на ультразвуковой системе Voluson E8 Expert (GE Healthcare, США) с использованием 4D мультичастотного датчика (2–8 МГц) с определением ПИ кровотока в маточных артериях, артериях пуповины и средней мозговой артерии в строгом соответствии с рекомендациями ISUOG [29]. ЦПО рассчитывалось как отношение ПИ в средней мозговой артерии к ПИ в артериях пуповины. Для определения соответствия процентильным значениям абсолютных показателей ЦПО использовались данные крупного исследования Фонда Медицины Плода (ЦПО-ФМФ), опубликованные Ciobanu et al. (2019) [30]. ЦПМО рассчитывалось как отношение ЦПО к ПИ в маточных артериях.
Данные об исходах беременностей были получены из амбулаторных карт и результатов телефонного интервьюирования пациенток.
Основным изучаемым исходом была масса новорожденного <10 процентиля значений для данного гестационного возраста [28]. Дополнительными изучаемыми исходами были преждевременные роды (до 37 недель беременности), оперативное родоразрешение, госпитализация новорожденного в отделение реанимации и интенсивной терапии, перинатальная гибель, включающая антенатальную гибель плода после 22 недель беременности и гибель новорожденного до 28-го дня жизни.
Статистический анализ
Для статистической обработки данных и построения графиков использовались пакеты программ MedCalc Statistical Software version 16.4.3 (MedCalc Software bv, Ostend, Belgium) и GraphPad Prism 6 (GraphPad Software, USA). Для оценки различий между группами по количественным переменным с нормальным распределением применялся t-критерий Стьюдента для независимых выборок, при отклонении от нормального распределения количественных переменных использовался U-тест Манна–Уитни. Тест Шапиро–Уилка применялся для проверки формы распределения. Точный критерий Фишера применялся для оценки различий между группами по качественным признакам. Отношение шансов (ОШ) было рассчитано для оценки вероятности рождения маловесного ребенка в случаях снижения ЦПО и ЦПМО <5 процентиля в сравнении со случаями нормальных показателей ЦПО и ЦПМО ≥5 процентиля. Критерием статистической значимости полученных результатов считали общепринятую в медицинской статистике величину р<0,05.
Результаты
В итоговый анализ было включено 1215 пациенток, прошедших комбинированный скрининг I триместра с установлением точного срока беременности и как минимум одно допплеровское исследование в 24–40 недель беременности.
Средние показатели массы новорожденных соответствовали 50 процентилю референсных интервалов проекта Intergrowth-21st [28]. 79 (6,5%) случаев с массой новорожденного <10 процентиля составили 1-ю (основную) группу исследования. 1136 (93,5%) беременностей закончились рождением ребенка массой ≥10 процентиля: данные случаи были отнесены ко 2-й (контрольной) группе исследования.
Всего было проведено 1780 допплеровских исследований в различные сроки беременности: 454 – в 24–29 недель, 905 – в 30–33 недели, 371 – в 34–37 недель и 50 – в 38–40 недель беременности. От общего числа 141 исследования 1-й группы в указанные сроки составили соответственно 11%, 6,5%, 8,1% и 4%.
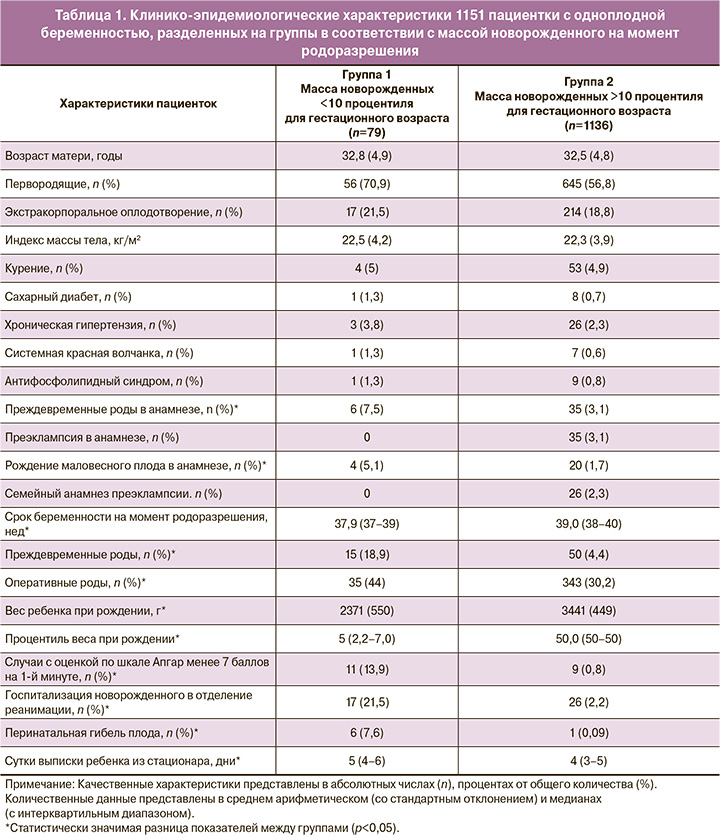
В таблице 1 приведены клинико-эпидемиологические характеристики обследованных, стратифицированные в зависимости от массы новорожденных. В сравнении со 2-й группой в случаях рождения маловесного ребенка анамнез большего количества пациенток был отягощен преждевременными родами и малым для гестационного возраста весом новорожденного (р<0,05). При данной беременности частота перинатальной гибели, преждевременных и оперативных родов, низких оценок по шкале Апгар, госпитализаций ребенка в отделение реанимации и интенсивной терапии и общая длительность госпитализации были значимо больше в основной, нежели в контрольной группе (р<0,001).
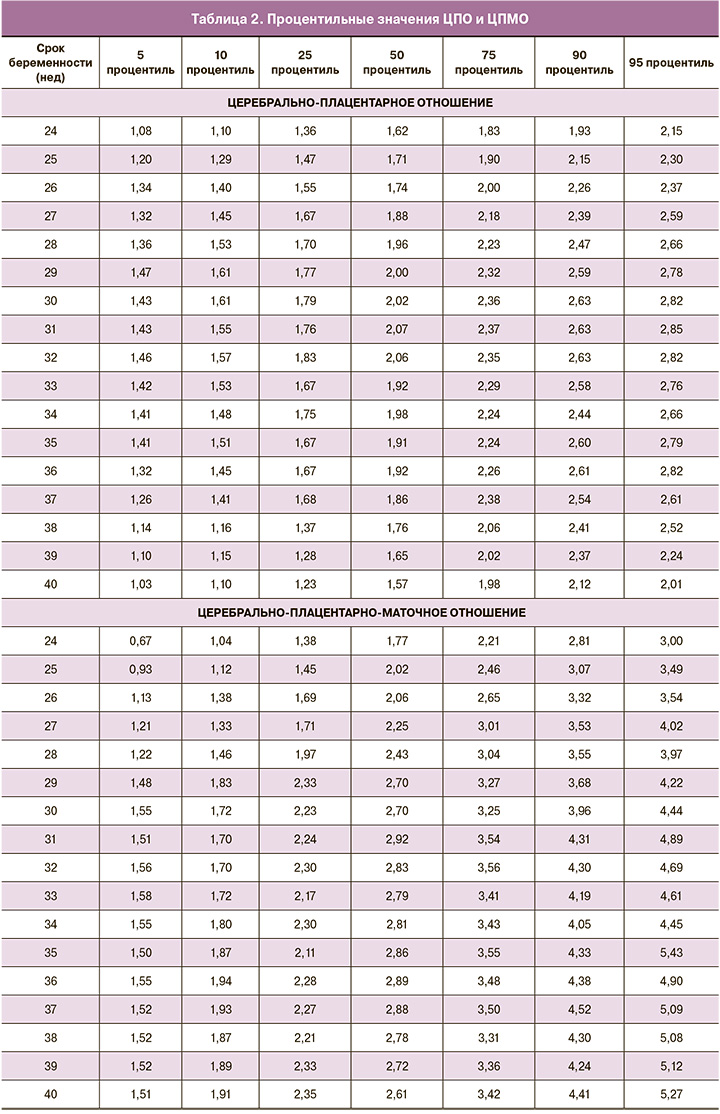
Для создания процентильных интервалов ЦПО и ЦПМО, приведенных в таблице 2, использованы результаты 1639 допплеровских исследований только пациенток 2-й (контрольной) группы, дети которых при рождении имели вес ≥10 процентиля. Сравнение полученных на собственной группе процентильных интервалов ЦПО с референсными интервалами ЦПО-ФМФ [30] выявило значительное совпадение: различия между показателями 5 процентиля в соответствующие гестационные сроки составляли от 0,03 до 0,14.
Показатели ЦПМО (табл. 2) менялись в зависимости от срока беременности: в период с 24-й по 31-ю неделю беременности 50 процентиль ЦПМО поступательно увеличивается с 1,77 до 2,92, а затем незначительно снижается до 2,61 к 40 неделям беременности. Обращает на себя внимание, что колебания важного для клинического применения 5 процентиля в сроки 30–40 недель являются несущественными (1,51–1,58), что может облегчить использование данного пограничного значения.
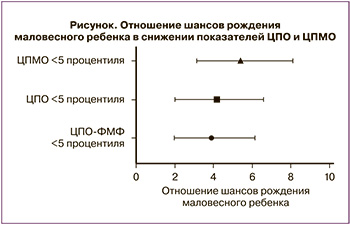
ОШ, рассчитанное для случаев снижения ЦПО <5 процентиля соответственно референсным значениям ЦПО-ФМФ [30], собственным процентильным значениям ЦПО и снижения ЦПМО <5 процентиля, выявило статистически значимое увеличение вероятности рождения маловесного ребенка в сравнении со случаями, при которых данные показатели имели значения ≥5 процентиля (р<0,0001 для каждого из показателей). При анализе ЦПО-ФМФ ОШ составило 3,56 (95% ДИ 1,95–6,61), для собственных значений ЦПО ОШ составило 3,9 (95% ДИ 2,0–6,6); для ЦПМО ОШ составило 5,0 (95% ДИ 3,1–8,1): снижение показателей определялось при 15, 22 и 27 из 141 исследований 1-й группы пациенток и 53, 74 и 74 из 1639 исследований 2-й группы пациенток соответственно (рисунок).
 Обсуждение
Обсуждение
Анализ исходов беременностей в когорте данного исследования выявил значимое повышение частоты осложнений, потребности в интенсивной и реанимационной терапии и длительности госпитализации маловесных новорожденных в сравнении с детьми, рожденными массой ≥10 процентиля. Важно помнить, что негативное влияние неблагоприятного течения перинатального периода на здоровье ребенка не заканчивается выпиской из родильного дома. Научные данные демонстрируют строгую ассоциацию задержки внутриутробного роста и перенесенной перинатальной гипоксии с замедлением физического и психомоторного развития у детей первых лет жизни [12, 13, 16]. Поскольку в нашей стране ежегодно диагноз внутриутробной гипоксии и асфиксии в родах устанавливается у 3,8% доношенных и 21,8% недоношенных новорожденных, что в общей сложности cоставляет более 77 тыс. детей [7], проблема дородовой диагностики и, что еще более важно, прогнозирования этих состояний является бесспорно актуальной. Многочисленные публикации об эффективности ЦПО в оценке риска задержки (замедления) роста плода и гипоксии у маловесных и нормовесных плодов до настоящего момента имеют противоречивые выводы [16–21]. Данное обстоятельство свидетельствует о необходимости продолжения исследований. Разработка новых комбинированных показателей [27] представляется интересной, поскольку унифицированный критерий, включающий одновременную оценку всех взаимосвязанных показателей кровотока в системе «мать-плацента-плод»: маточных артерий, артерий пуповины и церебрального кровотока плода потенциально позволяет в количественном представлении выявить наличие, степень выраженности и динамику нарушений функционирования данной системы в целом.
Важно отметить, что по результатам данного безвыборочного обследования когорты пациенток, проведенного при строгом соблюдении методологии определения срока беременности и допплерометрии, средний вес новорожденных соответствовал 50 процентилю референсных интервалов международного проекта INTERGROWTH-21st [28], общее число случаев замедленного роста (6,5%) значимо не отличалось от общероссийского уровня данного показателя (6,2%) [7], а рассчитанные процентильные показатели ЦПО были сопоставимыми с таковыми Ciobanu et al. [30] – одного из крупнейших исследований Фонда Медицины Плода. Указанное является сильными сторонами нашего исследования, подтверждающими справедливость полученных данных об увеличении шансов рождения маловесного ребенка при снижении ЦПМО и позволяющими представить полученные пилотные процентильные значения ЦПМО в качестве базовых для дальнейших проспективных исследований, направленных на поиск эффективных критериев высокого риска маловесности, связанных с ней грозных перинатальных и отдаленных осложнений.
Заключение
ЦПМО является комбинированным показателем оценки кровотока в системе «мать-плацента-плод», имеющим статистически значимую связь с увеличением вероятности рождения маловесного плода. Проспективные исследования необходимы для определения эффективности применения данного показателя.



