Колоссальный прогресс в изучении человеческого организма определяет непостоянность и изменяемость представлений о «норме». За последние десятилетия менялись нормативные показатели продолжительности жизни человека, длительности различных периодов его жизни, индекса массы тела, уровней артериального давления (АД), глюкозы и холестерина крови, продолжительности родов и перинатального периода; стала нормой возможность реализации детородной функции в позднем репродуктивном возрасте и др. [1]. Несомненным требованием к клиницисту является четкое ориентирование в параметрах, характеризующих «норму небеременных», знание закономерностей формирования и течения физиологической беременности, особенно динамики лабораторно-инструментальных показателей. Все это необходимо для своевременного разграничения физиологических компенсаторно-приспособительных изменений («норма беременности») и патологических отклонений, свидетельствующих о формировании осложнений беременности, что актуализируется в условиях все большей распространенности акушерской патологии с атипичным и стертым течением [2, 3]. Особенностью регуляции гомеостаза при беременности выступает способность материнского организма к длительной компенсации; при этом лабораторные показатели долгое время остаются на пограничном уровне референсных значений, что отражает категория «норма компенсированной патологии» [4].
Как известно, в организме женщины при беременности активируется альтернативный тип энергообеспечения, что вызывает характерные для физиологической гестации изменения метаболизма [5, 6]. Течение беременности сопровождается развитием инсулинорезистентности (ИР), особенно мышечной, степень которой активно нарастает со II триместра гестации [7]. В ответ на формирующуюся ИР у беременных возникают атерогенные изменения липидного профиля, способствующие энергообеспечению материнского организма взамен необходимой для растущего плода глюкозы. В печени ввиду нарушения передачи инсулинового сигнала растормаживаются процессы гликогенолиза и глюконеогенеза, снижается активность гликогеногенеза [5, 8]. В итоге изменения при беременности направлены на рост и развитие плода путем усиления поступления через плаценту глюкозы, аминокислот, свободных жирных кислот и в то же время на поддержание необходимого функционального состояния женщины [6, 7]. Применение системного подхода в изучении гестационных механизмов адаптации функциональной системы «мать-плод» позволит выявить общие закономерности формирования «нормы беременности», объективизировать разграничение с «нормой компенсированной патологии» и стратифицировать беременных по группам риска.
Цель исследования: на основе клинико-лабораторного мониторинга неосложненной беременности выявить направленность изменений параметров углеводного, липидного обменов, гормональных, ангиогенных, гематологических, про- и противовоспалительных показателей и обосновать «норму беременности» с позиции жизнеобеспечения плода.
Материалы и методы
Исследование проведено на базе Перинатального центра СОКБ им В.Д. Середавина и женских консультаций г. Самара в 2017–2019 гг. Для реализации поставленной цели было проведено динамическое клинико-лабораторное обследование 40 здоровых беременных с физиологическим течением гестации (I группа); в группу сравнения вошли 30 здоровых небеременных женщин (II группа). Критерии включения в исследуемые группы: здоровые небеременные и здоровые беременные женщины раннего репродуктивного возраста, родоразрешенные в срок через естественные родовые пути здоровым новорожденным, информированное добровольное согласие на участие в исследовании и публикацию полученных данных. Критерии исключения: отягощенный акушерско-гинекологический анамнез, избыточная масса тела или ожирение, наличие врожденных, соматических, гинекологических, инфекционных заболеваний, гестационных и перинатальных осложнений, врожденной патологии плода. Беременные I группы обследованы в 11–14, 18–21, 30–34 недели гестации. Женщины II группы обследованы однократно на 6–10-й день менструального цикла.
У женщин I и II групп проводилось определение метаболических (глюкоза венозной крови, мочевая кислота, общий холестерин (ОХ), триглицериды (ТГ), липопротеиды высокой плотности (ЛПВП) в сыворотке крови с расчетом коэффициента атерогенности (КА=(ОХ–ЛПВП)/ЛПВП) и отношения ТГ/ЛПВП, индекса инсулинорезистентности (HOMA-IR = глюкоза натощак (ммоль/л) х инсулин натощак (пмоль/л) × 0,138/22,5)) и гематологических (количество, фракция незрелых и средний объем тромбоцитов, их агрегация с коллагеном, количество лейкоцитов и нейтрофилов) показателей; гормонов (в крови – инсулин, лептин, плацентарный лактоген (ПЛ), кортизол; в моче – норадреналин); противовоспалительных (интерлейкин (ИЛ)-4, ИЛ-10) и провоспалительных маркеров (индекс активации лейкоцитов, фактор некроза опухоли альфа (ФНО-α), ИЛ-6, С-реактивный белок (СРБ); состояние сосудистого эндотелия (циркулирующие эндотелиальные клетки (ЦЭК), фибронектин (ФН)); плацентарный ангиогенез (фактор роста плаценты (ФРП)) и децидуализация стромальных клеток (плацентарный альфа-1-микроглобулин (ПАМГ-1)). Динамика накопления и локусы распределения жировой ткани определялись методом ультразвукового исследования: толщина подкожного (тПКЖ) и преперитонеального (тППЖ) жира с расчетом индекса жира брюшной стенки (ИЖБС=тППЖ/тПКЖ). Оценивались тип суточной вариабельности АД, субъективные характеристики сна (анкета Я.И. Левина (1995)), эпизоды ночного апноэ.
В исследовании использованы биохимический анализатор Architectc 4000 (Abbott, США), гематологический анализатор SysmexXN-1000 (SysmexCorporation, Япония), лазерный анализатор агрегации тромбоцитов АЛАТ-2 (ООО НПФ «Биола»), ультразвуковая система экспертного класса Voluson E6 (GEHealthcare, Австрия). Концентрации инсулина, лептина, ПЛ, кортизола, ФНО-α, ИЛ-6, ИЛ-4, ИЛ-10, СРБ, ФРП, ПАМГ-1 в сыворотке и ФН в плазме крови, норадреналина в суточной моче определялись методом ELISA. Подсчет количества ЦЭК в крови осуществлялся по Н.Н. Петрищеву (2001).
Статистический анализ
Статистическая обработка числового массива данных выполнена при помощи специализированного программного обеспечения IBMSPSS Statistics 25 HCIMAGO 5.0, лицензия №5725-А54. При статистической обработке нормальность распределений значений оценивалась по критериям Колмогорова–Смирнова с поправкой Лиллиефорса и Шапиро–Уилка. Для показателей с нормальным распределением вычислялись средняя арифметическая (М) и стандартное отклонение (SD), статистическая значимость различий определялась однофакторным дисперсионным анализом (ANOVA). При непараметрическом распределении вычислялись медианы (Me) с межквартильным интервалом [Q1(25%);Q3(75%)], рассчитывался критерий U Манна–Уитни с поправкой Бонферрони. При сравнении зависимых выборок (динамика показателей в течение беременности) использовался парный критерий Вилкоксона. Для выявления взаимосвязей применяли корреляционный анализ Спирмена. Критическое значение уровня статистической значимости (p) принимали менее 0,05.
Результаты и обсуждение
Средний возраст женщин составил 27,4 (3,7) и 26,5 (4,0) года в I и II группах соответственно (р=0,69). Индекс массы тела соответствовал референсным границам: 22,1 (0,8) кг/м2 в I группе, 22,4 (0,7) кг/м2 во II группе (р=0,77). У всех женщин имели место неосложненные гинекологический, соматический, аллергологический анамнезы. Среди женщин I группы 50% (20/40) были первобеременными, 50% (20/40) – повторнобеременными, повторнородящими, без отягощенного акушерского анамнеза. Все женщины I группы были родоразрешены в срок, через естественные родовые пути без осложнений. Все новорожденные родились без асфиксии, средняя масса тела составила 3390 (280) г, длина тела – 52,7 (3,6) см. Выписка осуществлялась на 3–4-е сутки, лактогенез – без нарушений.
Средние уровни систолического (118 (5) мм рт.ст.), диастолического (76 (4) мм рт.ст.) и среднего (91 (5) мм рт.ст.) АД в конце I триместра статистически значимо уменьшились к 18–21-й неделе гестации: 106 (4) мм рт.ст., 69 (4) мм рт.ст. и 82 (5) мм рт.ст. соответственно (рсист<0,001; рдиаст=0,004; рср=0,003), а в 30–34 недели беременности вновь были приближены к исходным значениям (рсист=0,81; рдиаст=0,89; рср=0,93). У всех беременных выявлен физиологический тип суточной вариабельности АД – dipper, при котором происходит снижение АД в ночное время на 10–20% по сравнению с дневным уровнем [9, 10]. Физиологические изменения дыхательной системы при беременности могут выступать в качестве причин затрудненного дыхания и, что особенно важно, нарушений дыхания во сне [11] с возможным формированием синдрома гестационного сонного апноэ, эпизоды которого ведут к гипоксии и окислительному стрессу [12]. У беременных I группы не было отмечено реализации гестационного сонного апноэ, что отражает умеренный характер изменений и достаточный резерв адаптации. Проведенный анализ субъективной оценки характеристик сна показал, что все женщины I группы набрали >22 баллов, что соответствует норме и отражает сбалансированное функционирование центральных регуляторных механизмов. Уровни и тип суточной вариабельности АД, характеристики сна у здоровых небеременных соответствовали норме и не имели каких-либо особенностей.
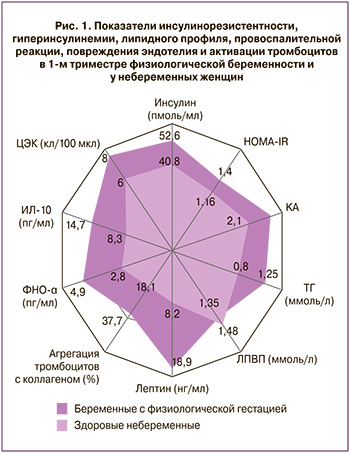 Прибавка массы тела в течение гестации соответствовала нормативным показателям и к концу I триместра составила в среднем 1,5 [1,3;1,8] кг, в 18–21 недель – 4,9 [4,5;5,3] кг, за всю беременность – 11,8 [10,9;12,9] кг. У небеременных тПКЖ составляла 9,4 [5,5;12,8] мм, тППЖ – 9,2 [5,3;12,2] мм, ИЖБС 0,9 [0,8–1,0]. ИЖБС у женщин I группы увеличился на 24% к III триместру гестации по сравнению с исходным значением в 11–14 недель (р=0,02). Следует отметить, что увеличение жировой массы в I, II и III триместрах гестации у женщин I группы происходило не только за счет тПКЖ (9,5 [5,5;13,6] мм, 11,7 [7,3;15,3] мм, 13,5 [9,6;17,3] мм соответственно), но и за счет тППЖ (9,8 [6,0;13,1] мм, 10,3 [8,1;13,8] мм, 11,2 [8,8;14;6] мм соответственно), имеющего высокую метаболическую активность. В этой связи интересным представляется формирование атерогенного липидного профиля у беременных I группы (табл. 1). При этом средние значения ОХ, ТГ, КА и отношения ТГ/ЛПВП у беременных с физиологической гестацией статистически значимо увеличивались по мере прогрессирования гестации (р<0,001 по каждому из показателей) и уже с конца I триместра значимо превышали показатели у небеременных женщин (рох=0,02, ртг<0,001, рка=0,01, ртг/лпвп=0,01) (рис. 1). Представленные изменения, с одной стороны, несут в себе адаптивный характер, обеспечивая организм матери наиболее энергетически емкими субстратами в условиях перенаправления глюкозы к плоду вследствие ИР тканей беременной, а с другой стороны, выступают альтерирующим фактором, поддерживая состояние ИР, повреждая клетки эндотелия и активируя тромбоциты, вызывая провоспалительные изменения. Однако в данной ситуации накопление липидов в ПКЖ и ППЖ ткани компенсирует избыточное повреждающее действие. Данное положение подтверждает выявленная сильная положительная корреляционная связь между тППЖ и уровнем инсулина, ФНО-α, HOMA-IR, агрегацией тромбоцитов (r от 0,81 до 0,94, при р<0,001) и положительная связь средней силы между тППЖ и средним объемом тромбоцита, уровнем ЦЭК (r от 0,62 до 0,73, при р<0,05).
Прибавка массы тела в течение гестации соответствовала нормативным показателям и к концу I триместра составила в среднем 1,5 [1,3;1,8] кг, в 18–21 недель – 4,9 [4,5;5,3] кг, за всю беременность – 11,8 [10,9;12,9] кг. У небеременных тПКЖ составляла 9,4 [5,5;12,8] мм, тППЖ – 9,2 [5,3;12,2] мм, ИЖБС 0,9 [0,8–1,0]. ИЖБС у женщин I группы увеличился на 24% к III триместру гестации по сравнению с исходным значением в 11–14 недель (р=0,02). Следует отметить, что увеличение жировой массы в I, II и III триместрах гестации у женщин I группы происходило не только за счет тПКЖ (9,5 [5,5;13,6] мм, 11,7 [7,3;15,3] мм, 13,5 [9,6;17,3] мм соответственно), но и за счет тППЖ (9,8 [6,0;13,1] мм, 10,3 [8,1;13,8] мм, 11,2 [8,8;14;6] мм соответственно), имеющего высокую метаболическую активность. В этой связи интересным представляется формирование атерогенного липидного профиля у беременных I группы (табл. 1). При этом средние значения ОХ, ТГ, КА и отношения ТГ/ЛПВП у беременных с физиологической гестацией статистически значимо увеличивались по мере прогрессирования гестации (р<0,001 по каждому из показателей) и уже с конца I триместра значимо превышали показатели у небеременных женщин (рох=0,02, ртг<0,001, рка=0,01, ртг/лпвп=0,01) (рис. 1). Представленные изменения, с одной стороны, несут в себе адаптивный характер, обеспечивая организм матери наиболее энергетически емкими субстратами в условиях перенаправления глюкозы к плоду вследствие ИР тканей беременной, а с другой стороны, выступают альтерирующим фактором, поддерживая состояние ИР, повреждая клетки эндотелия и активируя тромбоциты, вызывая провоспалительные изменения. Однако в данной ситуации накопление липидов в ПКЖ и ППЖ ткани компенсирует избыточное повреждающее действие. Данное положение подтверждает выявленная сильная положительная корреляционная связь между тППЖ и уровнем инсулина, ФНО-α, HOMA-IR, агрегацией тромбоцитов (r от 0,81 до 0,94, при р<0,001) и положительная связь средней силы между тППЖ и средним объемом тромбоцита, уровнем ЦЭК (r от 0,62 до 0,73, при р<0,05).
Общеизвестно, что физиологическое течение гестации сопровождается развитием ИР [6, 7]. Анализ HOMA-IR показал статистически значимое превышение при втором (р=0,02) и третьем (р=0,01) лабораторных тестированиях у беременных c физиологической гестацией по сравнению с небеременными. Несмотря на это, уровень глюкозы венозной крови в динамике беременности был значимо ниже по сравнению с показателем во II группе (р=0,02 в 18–21 неделю; р=0,02 в 30–34 недели), что вполне объяснимо поступлением глюкозы к плоду вследствие разницы градиентов плотности. Физиологическая ИР способствует адекватному энергетическому обеспечению развивающегося эмбрио(фето)плацентарного комплекса, анаболическая активность которого на 2–3 порядка выше, чем материнского организма [7]. Вклад в развитие физиологической ИР вносит и ПАМГ-1, синтезируемый дифференцированными децидуальными клетками и относящийся к классу низкомолекулярных белков (IGFBP-1), специфически связывающих инсулиноподобные факторы роста (ИФР). ПАМГ-1 модулирует как митогенную, так и инсулиноподобную активность ИФР. Через связывание ИФР в системном кровотоке ПАМГ-1 реализует свой вклад в развитие ИР, необходимой для энергообеспечения плода. Регуляция митогенных функций заключается в ограничении опухолеподобного продвижения цитотрофобласта и обеспечении сбалансированного течения волн инвазии. ПАМГ-1 в этом случае выступает естественным «материнским» регулятором инвазивности трофобласта. Данные по уровню ПАМГ-1 показали его плавное нарастание (в 2 раза) в динамике беременности (табл. 2). Следовательно, ИР при физиологической гестации выступает фактором альтерации материнского организма, нарушая привычное обеспечение клеток глюкозой для обеспечения необходимого роста и развития плода, вызывая диабетогенную направленность метаболизма и некоторым образом ограничивая материнский организм в нутриентах. Данный процесс напоминает изменения, характерные для метаболического синдрома, когда возникающая при «бережливом генотипе» ИР ограничивает поступление питательных веществ в органы и ткани организма и перенаправляет их на «рост и развитие» жировой ткани, своеобразным аналогом которой во время беременности является фетоплацентарный комплекс. ИР реализует свое действие на клеточном и молекулярном уровнях, вызывая активацию эндотелиально-тромбоцитарного звена, «диабетогенную» перестройку метаболизма с повышением уровня свободных жирных кислот, формирование умеренного провоспалительного и гиперкоагуляционного состояний. Выявленное повышение уровня инсулина у беременных отражает формирование компенсаторной гиперинсулинемии в рамках физиологической адаптации к вышеописанным изменениям. При этом средние значения показателя уже с конца I триместра статистически значимо превышали значение у небеременных (р=0,02) (рис. 1). Компенсаторная гиперинсулинемия обеспечивает необходимый уровень энергообеспечения глюкозой, аминокислотами материнского организма, отложение избытка свободных жирных кислот в жировых депо, реализует свои вазодилатирующую и вазопротекторную функции. Гиперсекреция инсулина связана с активацией β-клеток поджелудочной железы – адаптивная реакция в ответ на физиологическую ИР, развивающуюся под действием широкого спектра плацентарных контринсулярных гормонов, являющихся в данном аспекте факторами «физиологической альтерации» при беременности [5, 13].
Одним из важных гормонов беременности является ПЛ, обладающий наибольшим контринсулярным эффектом, средний уровень которого значимо возрастал при каждом последующем лабораторном обследовании: 11–14 недель – 2,1 мг/л, 18–21 неделя – 4,2 мг/л (р1-2<0,001), 30–34 недель – 7,4 мг/л (р2-3<0,001). В дополнение отмечены достоверно более высокие уровни лептина и кортизола у беременных в I (рл<0,001; рк=0,01), II (рл<0,001; рк<0,001) и III (рл<0,001; рк<0,001) триместрах по сравнению со II группой. Схожая закономерность отмечена при определении уровня норадреналина в суточном количестве мочи, статистическая значимость выявлена в 18–21 неделю (р=0,01) и 30–34 недели (р<0,001) гестации по сравнению с небеременными (табл. 1). Как известно, повышенные уровни указанных гормонов имеют место и при метаболическом синдроме, причем гиперлептинемии и лептинорезистентности отведена особо значимая роль в патогенезе данного синдрома, в частности, в прогрессировании ИР, эндотелиальной дисфункции, провоспалительного состояния, дисбаланса вегетативного статуса с преобладанием симпатикотонии [13, 14].
Анализ результатов лабораторного мониторинга показал статистически значимое межгрупповое различие по содержанию провоспалительных маркеров (табл. 2). У беременных с физиологической гестацией уже с конца I триместра средний уровень ФНО-α в 1,25 раза выше, чем у здоровых небеременных (р=0,01), ИЛ-6 – в 2,4 раза (р<0,001), СРБ – в 3,2 раза (р<0,001); причем оценка динамики нарастания показателей во II и III триместрах имела достоверные отличия по сравнению с предыдущим лабораторным тестированием (ФНО-α и ИЛ-6 – р1-2<0,001, СРБ – р1-2=0,02; р2-3<0,001 для всех показателей). Данной закономерности соответствует и повышение количества лейкоцитов, фракции нейтрофилов у женщин I группы, в отличие от II группы (р<0,001). С целью оценки функциональной активности лейкоцитов у беременных женщин был рассчитан индекс активации лейкоцитов, определяемый после 20 недель гестации. Среднее значение показателя в 18–21 неделю. беременности составило минус 18 (10)%, в 30–34 недели – 0 (9)%, что укладывается в критерии нормы и соответствует сбалансированной работе иммунной системы. Однако между значениями II и III триместров имелись статистические различия, что отражает умеренное повышение функциональной активности лейкоцитов в динамике физиологической гестации в границах нормы (р<0,001). Выявленные изменения свидетельствуют об активации иммунного ответа при физиологической гестации в ответ на умеренное воспаление децидуальной оболочки при имплантации плодного яйца, инвазии трофобласта, альтерации спиральных артерий при формировании гемохориального типа строения плаценты, фетализацию, миграцию и последующее старение плаценты [15–17]. Указанные провоспалительные сдвиги гомеостаза компенсируются адаптивным нарастанием противовоспалительных цитокинов вследствие трансформации Th1- в Th2-зависимый тип иммунного ответа, отсутствием на поверхности трофобласта классических антигенов системы HLA, формированием на его поверхности фибринового слоя, скрывающего специфические антигены, индуцированной цито- и синцитиотрофобластом программируемой гибелью активированных иммунокомпетентных клеток через индукцию экспрессии на мембране Fas/APO-1/CD95-рецептора готовности к апоптозу [15, 17]. Нами отмечено, что уровни противовоспалительных цитокинов ИЛ-4 и ИЛ-10 уже в конце I триместра физиологической гестации соответственно в 1,7 и 1,8 раза выше по сравнению с небеременными (рис. 1). При этом в 18–21 неделю показатели достоверно увеличились в 2,2 и 1,8 раза, к 30–34-й неделе гестации – еще в 1,3 и 1,4 раза. Свой вклад в сдерживание реализации системного воспалительного ответа вносит повышенный уровень мочевой кислоты, являющейся, с одной стороны, одним из мощных растворимых низкомолекулярных антиоксидантов, с другой – активатором эндотелиально-тромбоцитарного звена. Во II и III триместрах уровни мочевой кислоты в сыворотке крови в 1,2 (р=0,01) и 1,4 раза (р<0,001) соответственно превышали показатели у небеременных. Срыв баланса цитокинов, активация лейкоцитарного звена, нарастающая гиперурикемия ведут к прогрессированию провоспалительного статуса, иммунометаболическим нарушениям, дестабилизации функции эндотелия с последующей реализацией в гестационные и перинатальные осложнения, что демонстрирует тонкую грань между «нормой беременности» и «нормой компенсированной патологии». Характерной особенностью представленных изменений у небеременных является их непосредственное участие в механизмах формирования метаболического синдрома.
Первым барьером на пути у альтеративного воздействия формирующейся ИР, атерогенных фракций липидного профиля, активированного состояния иммунной системы, повышенного уровня провоспалительных цитокинов и свободных радикалов выступает эндотелий сосудистой стенки. Перечисленные факторы вызывают гиперактивацию и повреждение эндотелиоцитов с повышением коагуляционного потенциала [8, 18–20]. Для объективизации указанного процесса нами определено количество ЦЭК в крови. Выявлено нарастание ЦЭК у женщин I группы (8 кл/100 мкл, 14 кл/100 мкл и 22 кл/100 мкл соответственно срокам обследования), значимое отличие значений во II (р=0,02) и III (р<0,001) триместрах по сравнению со II группой. Показано, что уровень выделяемого в результате активации эндотелия ФН, участвующего в тромбообразовании, в 18–21 неделю гестации у беременных I группы начинает значимо превышать показатель здоровых небеременных (р<0,001). Полученные результаты количественной и функциональной оценки тромбоцитов укладываются в выявленную гиперкоагуляционную направленность изменений. Количество и агрегация тромбоцитов у беременных статистически значимо повышаются уже с конца I триместра по сравнению со II группой (ртр=0,01; рагр<0,001), значимо нарастая к концу гестации (ртр=0,02; рагр<0,001). Увеличение у здоровых беременных среднего объема тромбоцита, отражающего его агрегационную активность, и фракции незрелых тромбоцитов, связанной с повышенным потреблением зрелых форм, указывает на активацию тромбоцитарного звена. Следует отметить, что в литературе широко освещены схожие эндотелиально-гемостазиологические изменения в функциональную фазу метаболического синдрома, но имеющие более выраженный и злокачественный характер при прогрессировании синдрома [18, 21]. Однако при физиологической беременности срабатывают механизмы, сдерживающие избыточное повреждение эндотелия и гиперкоагуляционный потенциал: вазопротекторное действие компенсаторной гиперинсулинемии, проангиогенное состояние (повышение синтеза сосудистого эндотелиального фактора роста (VEGF), ФРП), активация в плаценте противосвертывающих факторов (простациклин, аннексин V и др.), экспрессия гепарина, протеинов C и S на поверхности трофобласта для сохранения ламинарного тока в межворсинчатом пространстве [15, 22]. Так, согласно полученным данным, содержание ФРП, одного из белков семейства VEGF, синтезируемого только при беременности, у женщин I группы в динамике беременности нарастало в 2 раза (от 237 до 582 пг/мл; р<0,001). Привлекает внимание то, что при метаболическом синдроме также отмечено высокое содержание VEGF; при этом, чем выше его уровень, тем ниже риск метаболических осложнений, что отражает защитную роль проангиогенного фактора [23]. На рис. 2 представлена обобщенная схема, отражающая схожесть изменений гомеостаза при беременности и метаболическом синдроме.
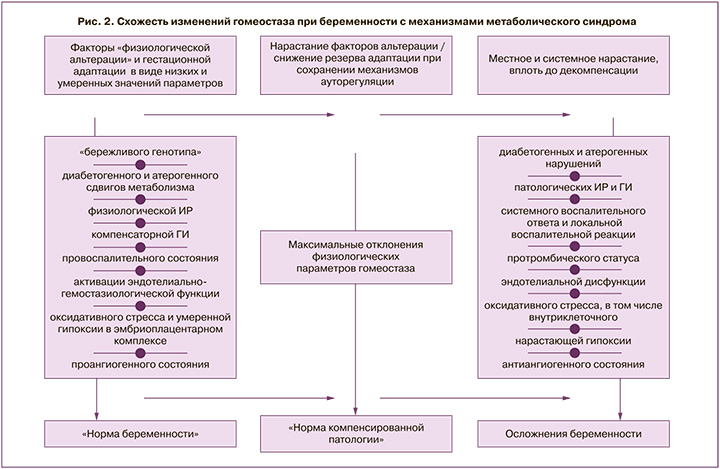
Необходимо отметить, что баланс физиологической ИР и компенсаторной гиперинсулинемии способствует неосложненному течению беременности с благоприятными исходами. Срыв адаптации, характерной для «нормы беременности», ведет к формированию патологических ИР и гиперинсулинемии, участвующих в механизмах реализации больших акушерских синдромов.
Заключение
Результаты исследования показали, что перманентный характер компенсаторно-приспособительных механизмов у беременных в ответ на формирование эмбрио(фето)плацентарного комплекса определяется балансом существующих в рамках «нормы беременности» факторов «физиологического повреждения» (нидация, инвазия цитотрофобласта и гестационная перестройка спиральных артерий с деструкцией мышечных элементов сосудистой стенки, плацентация, умеренное воспаление децидуальной оболочки, физиологическая ИР, диабетогенный и атерогенный сдвиги метаболизма, повреждение эндотелия, повышение уровня провоспалительных цитокинов и белков острой фазы воспаления) и «механизмов гестационной адаптации» (гормональная перестройка, компенсаторная гиперинсулинемия, вазопротективное действие ангиогенных факторов, переход на Th2-зависимый тип иммунного ответа с повышением синтеза противовоспалительных цитокинов, активация антиоксидантной системы).
Возникающие в рамках «нормы беременности» изменения в организме женщины направлены на реализацию эволюционно выработанной функции вынашивания беременности, заключающейся в первостепенном энергетическом и пластическом жизнеобеспечении развивающегося плода, с неблагоприятным атерогенным и диабетогенным сдвигом метаболизма материнского организма.
Формирование при физиологической беременности ИР и гиперинсулинемии вследствие филогенетически закрепленного действия контринсулярных плацентарных гормонов и белков, гиперлептинемия, повышение атерогенных фракций липидов, провоспалительное и гиперкоагуляционное состояния, активация эндотелиально-тромбоцитарного звена, симпатикотония, гиперурикемия, висцеральный тип жироотложения имеют выраженную схожесть с патогенетическими механизмами функциональной фазы метаболического синдрома. Это позволяет сделать вывод о том, что беременность – это естественная модель метаболического синдрома.
Указанные закономерности развития физиологической беременности с акцентом на метаболические изменения направляют внимание исследователей на углубленное изучение патогенетической роли ассоциированных с ИР изменений в развитии акушерской патологии.



