По данным ВОЗ, в структуре материнской смертности доля гипертензивного синдрома составляет 20–30%; ежегодно во всем мире более 50 000 женщин погибает в период беременности из-за
осложнений, связанных с артериальной гипертензией (АГ) [1]. Преэклампсия и эклампсия наблюдаются в 2,3–28,5% случаев, и этот показатель не имеет тенденции к снижению [2]. По данным литературы, преэклампсия при гестационном сахарном диабете (ГСД) развивается в 13,3% случаев, причем у половины пациенток формируется преэклампсия средней и тяжелой степени [3]. Необходимо отметить, что за последние 10 лет частота случаев ГСД увеличилась в 1,5 раза. К традиционным факторам риска ГСД добавились высокая частота многоплодия, применение препаратов эстрогенов и индукция овуляции в программах ЭКО [4]. Возможной причиной сочетания гестационной гипертензии (ГГ) и ГСД называют предшествующее ожирение, инсулинорезистентность, нарушение регуляции иммунного ответа, сосудистую дисфункцию, гиперпродукцию антител к рецепторам инсулина [5].
Роль генетических факторов в развитии как ГСД, так и ГГ при ГСД сложна и малоизучена [6].
Описаны несколько специфичных аллелей, ассоциированных с преэклампсией, исследовались
различные сочетания полиморфизмов генов, связанных с АГ, тромбофилией, эндотелиальной дисфункцией, вазоактивными гормонами. Результаты этого поиска нельзя признать однозначными и
окончательными [7].
На сегодняшний день описаны несколько групп генов, ассоциированных с развитием АГ: гены ренинангиотензиновой (РАС) и брадикининовой систем, гены эндотелия сосудов, гены метаболизма гомоцистеина и др. Значимую роль в развитии АГ играет состояние РАС. Поэтому полиморфные варианты нескольких генов РАС и их определенная комбинация в генотипе в сочетании с воздействием факторов внешней среды могут рассматриваться в качестве возможных причин, определяющих степень выраженности гипертензивных расстройств на фоне ГСД. Своевременное выявление неблагоприятных аллелей генов, патологический эффект которых реализуется при неблагоприятных факторах окружающей среды, позволит по-новому взглянуть на патофизиологические механизмы возникновения гипертензии, ассоциированной с беременностью.
Цель исследования: изучить взаимосвязь полиморфных вариантов генов-регуляторов артериального давления (АД) с развитием гипертензивных расстройств у пациенток с ГСД.
Материал и методы исследования
Проведено проспективное сравнительное когортное исследование. Обследованы 108 беременных с ГСД, наблюдавшихся в 2010–2011 гг. в ФГБУ НИИ ОММ Минздрава Росси (Екатеринбург),
составивших две группы:
1-я группа – 63 женщины с ГСД и ГГ (диагностирована после 20 нед беременности, изолированная или в рамках преэклампсии);
2-я группа – 45 женщин с ГСД без ГГ. Критерии исключения: прегестационный сахарный диабет, хроническая АГ, тяжелая экстрагенитальная патология, многоплодная беременность.
Между сравниваемыми группами не было статистически значимой разницы по возрасту, социальному положению, характеру и степени тяжести экстрагенитальной патологии. Все пациентки
были консультированы эндокринологом и терапевтом. Диагноз ГСД был верифицирован в соответствие с рекомендациями ВОЗ 1999 г. [8].
Все женщины 1-й и 2-й групп были обследованы методом молекулярно-генетических исследований: полимеразная цепная реакция в режиме реального времени. Источником ДНК послужил буккальный соскоб, взятый у обследованных женщин. Выделение ДНК осуществляли сорбентным методом с использованием набора реагентов и протокола для выделения ДНК фирмы НПО «ДНК-Технология» (Россия). В работе были исследованы 7 полиморфных вариантов 5 генов-регуляторов АД: 704Т>С и 521 С>Т в гене AGT (ангиотензиногена); 1166 А>С в гене AGTR1 (рецептора 1-го типа к ангиотензинуII); 1675G>A в гене AGTR2 (рецептора 2-го типа к ангиотензину II); 825C>Т в гене GNB3 (GNB3-β3-субъединицы G-белка); 786Т>С и 894G>Т в гене NOS3 (эндотелиальной NO-синтазы). В работе использованы тест-системы, разработанные в НПО «ДНК-Технология». Детекция и анализ полиморфизмов проводились с помощью программного обеспечения прибора ДТ-96 (НПО «ДНК-
Технология»).
Выбор полиморфных вариантов выполнен на основании того, что:
1) согласно данным литературы, они являются функционально значимыми; 2) ассоциация с риском развития АГ была установлена ранее в других популяциях [9].
Статистическая обработка полученных данных проводилась с помощью программы Statistica 6.0.
Тест на соответствие распределения генотипов закону Харди–Вайнберга в обеих выборках проводили с помощью критерия χ2 (р>0,05). Соотношение аллелей и генотипов в сравниваемых группах определялось методом χ2 для таблиц 2×2 с использованием поправки Йетса в случаях наличия в таблице малых численностей (менее 10). Силу ассоциации оценивали в значениях показателя соотношения шансов (oddratio, OR) [10]. Значение OR и 95% доверительный интервал (95% CI) вычисляли с помощью программы Calculator for confidence intervals for odds ratio [11]. Статистически значимыми считались различия при р<0,05.
Результаты исследования и обсуждение
Была изучена распространенность в исследуемых группах 7 полиморфных вариантов 5 генов,
ответственных за регуляцию компонентов РАС и развитие эндотелиальной дисфункции. Согласно
полученным данным, частоты аллелей и генотипов по всем исследуемым генам соответствовали распределению Харди–Вайнберга. Изучение распределения частот аллелей выявило статистически значимые различия по полиморфному варианту 704Т>С в гене AGT (ангиотензиногена). В основной группе достоверно чаще встречался аллель 704С (80,84% против 63,35%; p<0,05). Других значимых различий в частоте встречаемости полиморфных аллелей исследуемых генов у пациенток с ГГ и ГСД и группой сравнения выявить не удалось (см. рисунок).
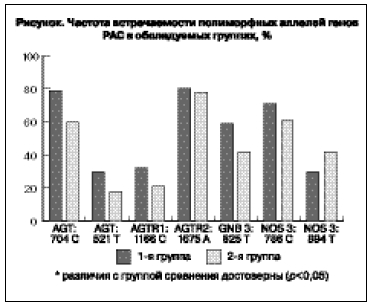
Результаты сравнительного анализа распределения генотипов полиморфных маркеров генов
AGT; AGTR1; AGTR2; GNB3 и NOS3 представлены в таблице. Проведенные исследования показали достоверные различия в распределении частот генотипов полиморфного локуса 704Т>С в гене
AGT (ангиотензиногена). В 1-й группе (женщин с ГГ и ГСД) было отмечено увеличение частот
генотипов 704ТС+704СС (84 против 57%; χ2=9,28, p=0,002; OR=3,87; 95% CI: 1,60–9,35, p=0,002)
и генотипа 704ТС (57 против 29%; χ2 =11,44; p=0,003; OR=3,28; 95%CI: 1,64–6,59; p=0,003).
При этом во 2-й группе (женщины с ГСД без ГГ), наоборот, отмечалось статистически значимое увеличение частоты генотипа 704ТТ (42 и 16% соответственно; χ2=9,28; p=0,002; OR=0,26;
95%CI: 0,62–0,11; p=0,002).
Таблица. Распределение частот генотипов полиморфных маркеров генов-регуляторов АД у женщин,
имеющих ГСД и ГГ (1-я группа) и с ГСД без ГГ (2-я группа).
Других статистически значимых различий частот генотипов у женщин с ГГ и ГСД и контрольной выборкой по полиморфным маркерам исследуемых генов в проведенном исследовании выявить не удалось.
Таким образом, полученные результаты свидетельствуют об ассоциации генотипов 704ТС и 704СС гена AGT с риском развития гипертензивных расстройств при беременности (OR=3,87;
95% CI=1,60–9,35, р=0,002) при сочетании с ГСД.
Данные литературы о связи полиморфизма М235Т гена AGT с нарушением физиологического течения беременности весьма противоречивы [9]. Так, по мнению ряда авторов, аллель 704С может приводить к повышению количества циркулирующего ангиотензинав крови примерно на 20% (у гомозиготных носителей), что ведет к повышению АД [12]. Есть сообщения о том, что данный полиморфизм влияет преимущественно на диастолическое, а не систолическое АД [13]. В работах других авторов было выявлено, что женщины со «слабым генотипом» 704СС достоверно реже заболевают АГ, чем мужчины с таким же генотипом [13]. Работ по изучению ассоциаций этого полиморфизма с развитием преэклампсии немного. В последних сообщениях не было обнаружено связи аллелей М235Т гена AGT
с преэклампсией у первородящих женщин [14]. Аналогичные результаты получены при изучении
наследственной предрасположенности к данной патологии у бурятских женщин и у якутов [15].
Проведенные нами исследования показали, что наличие аллеля 704С гена AGT в генотипе увеличивает риск развития ГГ в 3,87 раза (OR=3,87; 95% CI=1,60–9,35, p=0,002). Аналогичные результаты
о связи аллеля Т235 с гипертензивными нарушениями во время беременности были получены в
голландской популяции [16]. В других работах связь полиморфизма М235Т с возникновение АГ у
беременных не была подтверждена [17–19].
Обнаруженные нами тенденции при сравнительном анализе исследуемых групп дают надежду на выявление статистически значимых закономерностей при увеличении размера выборки.
По-видимому, следует рассмотреть ассоциации определенных генов с более частыми осложнениями ГГ и провести оценку взаимодействий «генген» и «ген-фактор внешней среды».
Выводы
1. Проведенные исследования позволили выявить ассоциацию генотипа 704ТС гена AGT
с риском развития гипертензивных расстройств у женщин с ГСД (OR=3,28; 95% CI: 1,64–6,59;
p=0,003).
2. Наличие аллеля 704С гена AGT в генотипе (704ТС+СС) в 3,87 раза увеличивает риск развития гипертензивных расстройств при беременности на фоне ГСД (OR=3,87; 95% CI=1,60–9,35;
p=0,002).
3. Генотип 704ТТ, напротив, обладает протекторным эффектом в отношении развития данной
патологии (OR=0,26; 95% CI=0,62–0,11; p=0,002).



