Макросомией называют такое состояние плода, которое характеризуется массой тела при рождении или предполагаемой массой тела ≥4000 г либо более 90-го перцентиля по таблице INTERGROWTH-21. Сопряженный с данной патологией рост заболеваемости и высокая частота акушерской и перинатальной патологии делают макросомию плода одной из наиболее значимых проблем современного акушерства [1, 2].
Данное осложнение выступает как фактор риска таких акушерских состояний, как преждевременный разрыв плодных оболочек, первичная и вторичная слабость родовой деятельности, клинически узкий таз. Для матери беременность крупным плодом может завершиться оперативным влагалищным или абдоминальным родоразрешением, послеродовым кровотечением, родовым травматизмом. В ходе родов сам плод может пострадать от аспирации околоплодными водами, асфиксии, а также получить родовые травмы [3].
Макросомия негативно сказывается на дальнейшей жизни и здоровье новорожденного. Доказана связь с такими отдаленными последствиями для потомства, как ожирение, диабет, патология сердечно-сосудистой системы. У этих новорожденных в более старшем возрасте чаще развивается такая форма рака, как острый лимфобластный лейкоз [1, 4–6].
Зачастую макросомия сопряжена с нарушением углеводного обмена беременной. Согласно литературным данным, гестационный сахарный диабет (ГСД), частота встречаемости которого тоже имеет тенденцию к росту [7], является фактором риска развития макросомии плода [1, 8–10], ее частота встречаемости при ГСД достигает 48% [11, 12]. Сам же ГСД в 53,9% случаев осложняется угрозой прерывания беременности [13, 14]. В литературе нет данных, которые описывали бы влияние угрозы прерывания беременности на состояние матери и плода при ГСД.
Одним из элементов формирования инсулинорезистентности является синтаза жирных кислот (FAS). Ее функция в клетке заключается в «сборке» жирных кислот из простых предшественников, которыми являются ацил-КоА и малонил-КоА [15]. FAS участвует в обмене сложных насыщенных липидов, триглицеридов, липопротеинов низкой и очень низкой плотности [15–17].
В литературе описано увеличение содержания FAS у пациентов с ожирением, онкологическими заболеваниями и диабетом [15–18]. FAS широко используется в качестве маркера рака поджелудочной железы [19] и аденокарциномы предстательной железы [20].
Изучалось содержание FAS в плаценте беременных, страдающих ГСД. В ходе исследования установлена более выраженная экспрессия FAS у пациенток с ГСД [17, 21]. Существует исследование, свидетельствующее о более высоком уровне плацентарного и сывороточного FAS у женщин, беременных крупным плодом [22].
Однако в литературе нет данных, посвященных влиянию угрозы прерывания беременности на содержание FAS в сыворотке крови. Определение концентрации FAS в сыворотке крови у пациенток, страдающих ГСД и угрожающим выкидышем, диагностированными во II триместре беременности, с целью прогнозирования макросомии ранее не проводилось.
Цель исследования: сравнить концентрации FAS в сыворотке крови у женщин с ГСД и угрожающим выкидышем, диагностированными во II триместре беременности, и у женщин с угрожающим выкидышем, диагностированным во II триместре, без ГСД.
Материалы и методы
Было проведено проспективное обсервационное исследование на базе клиники ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России. Данное исследование получило одобрение локального этического комитета ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России (протокол № 3 от 20.11.2020 г.). Выбранный дизайн учитывал требования Хельсинкской декларации. Полное клиническое, лабораторное и инструментальное обследование проводилось согласно Приказу Министерства здравоохранения РФ от 20 октября 2020 г. № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология"». Диагноз ГСД установлен в соответствии с Письмом Минздрава России от 17.12.2013 № 15-4/10/2-9478 «О направлении клинических рекомендаций "Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение"» (вместе с Клиническими рекомендациями (протоколом лечения), утвержденными Российским обществом акушеров-гинекологов).
Исследование предусматривало выкопировку данных из истории болезни, забор крови из кубитальной вены до начала лечения для проведения анализа сывороточного FAS как дополнительного метода исследования, оценку тревоги и депрессии по шкале HADS (The hospital Anxiety and Depression Scale, Госпитальная Шкала Тревоги и Депрессии) до начала терапии, а также оценку исходов беременности.
Критериями включения явились возраст беременной 18–45 лет, одноплодная беременность, угрожающий выкидыш, диагностированный во II триместре беременности, письменное информированное согласие женщины на участие в предложенном исследовании.
Критериями невключения были: беременность, наступившая в результате применения вспомогательных репродуктивных технологий, многоплодная беременность, декомпенсированная экстрагенитальная патология, манифестные формы сахарного диабета. Все женщины принадлежали к европеоидной расе, имели нормальное значение индекса массы тела (ИМТ) до наступления данной беременности; до госпитализации все женщины принимали дидрогестерон 10 мг в сутки.
Соответствовали критериям включения и дали свое письменное согласие на участие в исследовании 57 пациенток. С двумя из них была утеряна связь, ввиду невозможности отслеживания течения беременности и исхода родов эти данные не были учтены при обработке полученных материалов. Таким образом, в исследование вошли 55 женщин. Все пациентки были разделены на 2 группы. В основную группу были включены 25 женщин с ГСД и угрожающим выкидышем, диагностированными во II триместре беременности. Диагноз ГСД впервые устанавливался при данной госпитализации. Группу сравнения составили 30 женщин с угрожающим выкидышем, диагностированным во II триместре беременности. Забор крови выполнялся до начала лечения в стационаре. Клинический диагноз пациенток не сообщался сотрудникам, выполнявшим иммуноферментный анализ.
Для определения концентрации FAS в сыворотке крови в сухую пробирку забирали 3 мл периферической венозной крови из кубитальной вены. Свертывание крови наступало в течение 10–15 минут, после чего полученный сгусток подвергался центрифугированию в течение 10 минут. Так получали сыворотку крови, которая далее была помещена в пробирки типа Эппендорф и отправлена на хранение при температуре -20°С. Концентрацию FAS в сыворотке крови определяли путем иммуноферментного анализа с использованием тест-системы (Multiscan FC Labsystems, China). Результаты были проанализированы согласно протоколу фирмы-изготовителя.
Пациентки основной группы и группы сравнения сравнивались по следующим критериям: возраст наступления данной беременности, рост, ИМТ на момент обследования, семейный анамнез пациенток. Кроме того, сравнению подвергался исход беременности. Были проанализированы абсолютные значения концентрации FAS в сыворотке крови. Оценивали возможную связь уровня FAS в сыворотке крови у женщин с ГСД и угрожающим выкидышем, диагностированными во II триместре, с вероятностью развития макросомии плода, которая была оценена по факту рождения.
Статистический анализ
Нормальность распределения признаков была оценена с помощью критерия Шапиро–Уилка и равенства дисперсий, определенного с помощью критерия Левина. При нормальном распределении количественных величин описание проводилось по результатам подсчета среднего арифметического (М) и стандартного отклонения (SD). Результаты исследования, не соответствующие нормальному распределению, были представлены как медиана, а также нижний и верхний квартили (Ме (Q1; Q3)). Был использован непараметрический критерий Манна–Уитни с целью сравнения средних рангов между двумя независимыми выборками. Описание качественных признаков проводилось в виде абсолютных чисел (n) и относительных величин (%), применялся критерий χ2 Пирсона. Проводился расчет относительного риска (ОР), доверительного интервала (ДИ). Различия при р<0,05 (95-й уровень значимости) считались статистически значимыми.
С целью оценки диагностических методов были вычислены и оценены следующие показатели: чувствительность, специфичность, прогностическая ценность положительного и отрицательного результатов теста, оцененные с помощью ROC-анализа с вычислением площади под ROC-кривой; диагностическая точность метода была рассчитана по общепринятой формуле и представляла долю истинных результатов из всех полученных, была выражена в процентах. Для статистической обработки были использованы следующие программы: Statistica for Windows 10.0, Microsoft Excel 2007, MedCalс и OpenEpi.
Результаты и обсуждение
Анамнестические и клинические данные, характеризующие исследуемые группы, представлены в таблице 1. Возраст женщин основной группы и группы сравнения был сопоставим (30 (28; 35) и 29 (26,25; 31,75) лет; р=0,062). При анализе связи ГСД и начавшегося выкидыша были выявлены следующие факторы риска развития ГСД: больший ИМТ в момент обследования (28,36 кг/м2 (22,77; 31,48); 21,93 кг/м2 (20,82; 27,62); р=0,001), ненормированный рабочий день (ОР 4,00; 95% ДИ 1,23–12,97; р=0,022), артериальная гипертензия (АГ) у родственников I линии родства (ОР 3,36; 95% ДИ 1,40–8,04; р=0,006), ишемическая болезнь сердца (ИБС) у родственников II линии родства (ОР 4,00; 95% ДИ 1,23–12,97; р=0,022).
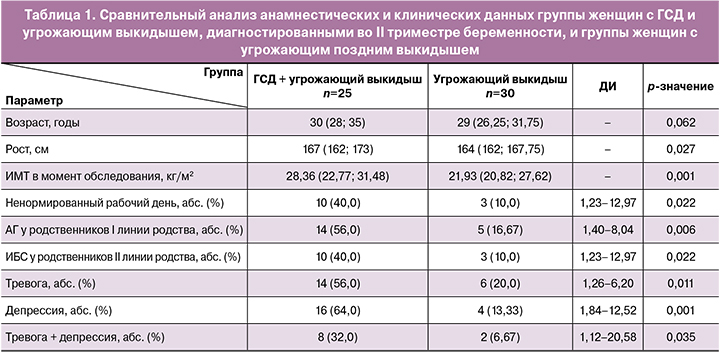
При оценке результатов по шкале HADS были получены следующие результаты. Женщин с ГСД отличала большая частота встречаемости диагностически значимого уровня тревоги (ОР 2,80; 95% ДИ 1,26–6,20; р=0,011) и депрессии (ОР 4,80; 95% ДИ 1,84–12,52; р=0,001), а также их сочетания (ОР 4,80; 95% ДИ 1,12–20,58; р=0,035).
Была проанализирована структура ГСД. Диагноз ГСД был впервые выявлен в сроке 19 недель (15; 20). Уровень гликемии у женщин, страдающих ГСД, составил 5,92 (0,85) ммоль/л. Компенсация эндокринных нарушений достигалась путем диетотерапии. Пациенток, получавших инсулинотерапию, не было.
Нами были проанализированы исходы данных беременностей. Поздний выкидыш у женщин основной группы произошел в сроке гестации 21–22 недели, в группе сравнения – в 18 недель. Преждевременные роды у женщин с ГСД и угрожающим поздним выкидышем произошли в 29,5 (5,92) недели гестации, у женщин с угрожающим поздним выкидышем – в 31,5 (2,65) недели. В обеих группах были случаи рождения детей с врожденными пороками развития (ВПР) (1/25 (4,0%), 2/30 (6,67%); р=0,67). У женщин основной группы фактором риска является ГСД [23], а у женщин группы сравнения причинами могли служить курение и прием алкоголя женщинами во время вынашивания данной беременности [24]. Число детей, страдающих макросомией, в основной группе было больше, чем в группе сравнения (15/25 (60,0%), 4/30 (13,33%); р=0,002) (табл. 2).
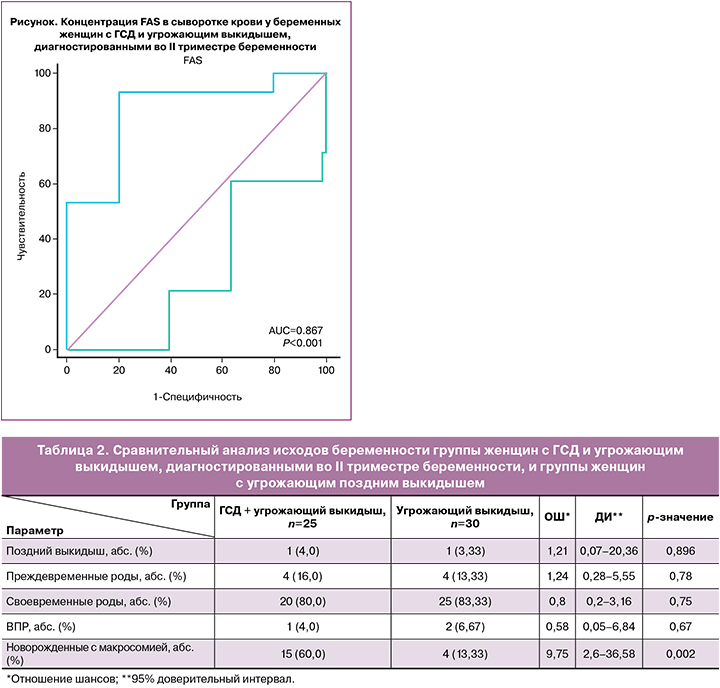
Для уточнения механизма развития макросомии у женщин с ГСД и угрожающим выкидышем, диагностированными во II триместре, нами была оценена концентрация FAS в сыворотке крови. Концентрация оценивалась в сопоставимых сроках (19 недель (15; 20); 18,5 недели (16; 20,75); р<0,744). При анализе полученных данных была установлена более высокая концентрация FAS в сыворотке крови женщин основной группы (1,64 нг/мл (1,13; 1,98)) в сравнении с женщинами без ГСД (0,8 нг/мл (0,3075; 1,55); р<0,001).
Был проведен анализ концентрации FAS в сыворотке крови у 25 женщин основной группы. У 16 пациенток концентрация FAS была ниже или равной 1,88 нг/мл; 14 новорожденных от женщин этой группы были с макросомией. У 9 женщин основной группы концентрация FAS была выше заявленного показателя. Только у одной из них плод страдал макросомией. При сравнении группы женщин, плоды которых страдали макросомией, и группы женщин, плоды которых не имели макросомии, ROC-анализ отразил высокую диагностическую ценность – AUC=0,867 (95% ДИ 0,67–0,96) (рисунок). Чувствительность предложенного способа составила 87,5% (95% ДИ 70,3–93,4), специфичность – 88,9% (95% ДИ 58,3–99,4), прогностическая ценность положительного результата – 93,3% (95% ДИ 75,0–99,6), прогностическая ценность отрицательного результата – 80,0% (95% ДИ 52,5–89,5).
Данный способ обладает следующими преимуществами: возможность уже с 13-й недели беременности предположить развитие макросомии плода, простота выполнения методики. Способ отличает персонифицированный подход к ведению пациенток с ГСД и угрожающим выкидышем, диагностированными во II триместре беременности. Применение данного метода обеспечивает возможность своевременного проведения профилактических мероприятий.
Приведенные ниже примеры демонстрируют применение данного способа на практике.
Пример 1
Пациентка А., 28 лет, беременность первая, запланированная. В сроке 17 недель гестации пациентка госпитализирована в гинекологический стационар с жалобами на тянущие боли в нижних отделах живота, мажущие кровянистые выделения из половых путей. На основании клинических и функциональных методов исследования поставлен диагноз: Беременность 17 недель. Угрожающий поздний выкидыш. ГСД.
Согласно предложенному способу, в периферической венозной крови определена концентрация FAS, которая составила 0,99 нг/мл.
Заключение: прогноз – развитие макросомии плода.
Назначена сохраняющая терапия, диетотерапия с положительным эффектом; через 14 дней женщина выписана под наблюдение женской консультации с диагнозом: Беременность 19 недель. ГСД.
При плановом обследовании в сроке гестации 30 недель на основании клинических и функциональных методов исследования женщине поставлен диагноз: Беременность 30 недель. Макросомия плода. ГСД.
В 38 недель 4 дня произошли первые своевременные роды в головном предлежании плода. Родился мальчик массой 4620 г, длиной 56 см с оценкой по шкале Апгар 8/9 баллов. Диагноз: Доношенный новорожденный, крупный для гестационного возраста.
Следует подчеркнуть, что концентрация FAS составила 0,99 нг/мл.
Пример 2
Пациентка М., 32 года, беременность третья, запланированная, в анамнезе 1 самопроизвольный выкидыш в сроке 6–7 недель беременности и 1 своевременные роды. В сроке 13 недель гестации пациентка госпитализирована в гинекологический стационар с жалобами на тянущие боли в нижних отделах живота, мажущие кровянистые выделения из половых путей. На основании клинических и функциональных методов исследования поставлен диагноз: Беременность 13 недель. Угрожающий поздний выкидыш. ГСД. Анемия легкой степени тяжести.
Согласно предложенному способу, в периферической венозной крови определена концентрация FAS, которая составила 1,94 нг/мл. По этому значению можно предположить отсутствие развития макросомии плода у женины с ГСД и угрожающим поздним выкидышем.
Назначены сохраняющая терапия, диетотерапия с положительным эффектом; через 10 дней женщина выписана под наблюдение женской консультации с диагнозом: Беременность 14 недель 3 дня. ГСД.
Женщина до родов регулярно наблюдалась в женской консультации, по результатам всех ультразвуковых исследований с фетометрией плода признаков макросомии не выявлено. В 39 недель 5 дней произошли вторые своевременные роды в головном предлежании плода. Родился мальчик массой 3450 г, длиной 51 см с оценкой по шкале Апгар 8/9 баллов.
Диагноз: Доношенный новорожденный, соответствующий гестационному возрасту.
Таким образом, при значении FAS, равном 1,94 нг/мл, родился ребенок с нормальной массой тела.
Пример 3
Пациентка У., 37 лет, беременность четвертая, запланированная. В анамнезе 1 медикаментозный аборт, 1 выкидыш в малом сроке, 1 своевременные роды. В сроке 20 недель пациентка госпитализирована в гинекологический стационар с жалобами на тянущие боли в нижних отделах живота, мажущие кровянистые выделения из половых путей. На основании клинических и функциональных методов исследования поставлен диагноз: Беременность 20 недель. Угрожающий поздний выкидыш. ГСД. Миопия легкой степени.
Согласно предложенному способу, в периферической венозной крови определена концентрация FAS, которая составила 1,88 нг/мл. По этому значению FAS можно предположить развитие макросомии плода.
Начаты сохраняющая терапия, диетотерапия с положительным эффектом; через 12 дней женщина выписана под наблюдение женской консультации с диагнозом: Беременность 21 неделя 5 дней. ГСД. Миопия легкой степени.
При плановом обследовании в сроке гестации 24 недели на основании клинических и функциональных методов исследования женщине поставлен диагноз: Беременность 24 недели. Макросомия плода. ГСД. Миопия легкой степени. В 40 недель 1 день произошли вторые своевременные оперативные роды в головном предлежании плода. Родилась девочка массой 4950 г, длиной 59 см с оценкой по шкале Апгар 8/9 баллов.
Диагноз: Доношенный новорожденный, крупный для гестационного возраста.
Следует отметить, что значение FAS составило 1,88 нг/мл.
Известно о большом поступлении глюкозы через маточно-плацентарный кровоток у беременных, страдающих ГСД. Причиной является относительная инсулинорезистентность, спровоцированная беременностью, что и приводит к формированию макросомии [14]. С другой стороны, угроза прерывания беременности провоцирует стресс, который в данном исследовании был оценен по шкале HADS. Он является причиной гиперреактивности гипоталамо-гипофизарно-надпочечниковой системы. Мощный выброс стрессовых гормонов, приводящий к гипергликемии, усугубляет уже имеющуюся инсулинорезистентность, способствуя развитию ГСД [25].
Доказано, что выведение FAS из клетки осуществляется с помощью аденозинмонофосфат активируемой протеинкиназы (АМРК). Чем активнее идет в клетке процесс синтеза жирных кислот, тем больше в клетке концентрация FAS, тем активнее АМРК выводит FAS во внеклеточное пространство [26–28]. Однако резко возросшая во время стресса инсулинорезистентность ведет к снижению энергетического субстрата в клетке ниже критического уровня. Так формируется энергетический стресс клетки, при котором АМРК фосфорилирует метаболические ферменты, предотвращая их работу и выход из клетки [29, 30]. Возможно, фосфорилированию со стороны АМРК подвергается и FAS. Это, в свою очередь, способствует нарастанию гипергликемии и развитию макросомии.
Гормональная терапия, которая была назначена пациенткам до госпитализации, была одинаковой – дидрогестерон 10 мг. Это исключает роль данной терапии в патогенезе ГСД. Кроме того, в литературе нет данных, свидетельствующих о влиянии дидрогестерона на концентрацию сывороточного FAS.
Таким образом, испытываемый женщиной стресс в условиях угрожающего позднего выкидыша приводит к повышенной активности гипоталамо-гипофизарно-надпочечниковой системы, которая сопровождается выбросом в кровь гормонов стресса, усугубляющих уже сформированную ГСД инсулинорезистентность. Обилие глюкозы поступает к плоду и провоцирует развитие макросомии. На клеточном уровне еще большее снижение чувствительности к инсулину провоцирует энергетический стресс клетки и фосфорилирование с помощью АМРК FAS, препятствуя выходу из клетки последней. Так, снижение FAS в сыворотке крови является отражением резко возросшей инсулинорезистентности и обильного поступления глюкозы к плоду.
Заключение
Таким образом, сравнение концентраций FAS в сыворотке крови у женщин с ГСД и угрожающим выкидышем, диагностированными во II триместре беременности, и у женщин с угрожающим выкидышем, диагностированным во II триместре, без ГСД, показало более высокую концентрацию FAS в сыворотке крови женщин основной группы (1,64 нг/мл (1,13; 1,98)) в сравнении с женщинами без ГСД (0,8 нг/мл (0,3075; 1,55); р<0,001). Определение концентрации FAS имеет высокую диагностическую ценность – AUC=0,867 (95% ДИ 0,67–0,96), чувствительность составила 87,5% (95% ДИ 70,3–93,4), специфичность – 88,9% (95% ДИ 58,3–99,4), прогностическая ценность положительного результата – 93,3% (95% ДИ 75,0–99,6), прогностическая ценность отрицательного результата – 80,0% (95% ДИ 52,5–89,5).
Определение концентрации FAS, вероятно, можно считать перспективным методом прогнозирования макросомии. Однако необходимы дальнейшие исследования в этом направлении.



