Под гиперплазией эндометрия понимают патологическую диффузную или очаговую пролиферацию (утолщение) железистого и стромального компонентов слизистой оболочки матки с преимущественным поражением железистых структур [1]. Согласно классификации ВОЗ (1994 г.), гиперпластические процессы эндометрия подразделяются на гиперплазию эндометрия без атипии, и гиперплазию эндометрия с атипией. В свою очередь, в зависимости от степени структурного изменения слизистой оболочки тела матки, каждая из них делится на две подгруппы, соответствующие простой и сложной гиперплазии [1].
На долю гиперпластических процессов эндометрия среди гинекологических заболеваний приходится от 10 до 50% [2]. Согласно литературным данным, в странах Западной Европы регистрируется около 200 000 новых случаев гиперплазии эндометрия в год [3]. Хирургическому лечению подвергаются около 40% женщин молодого возраста с гиперплазией эндометрия, что приводит к потере репродуктивной функции [4]. Вероятность перерождения гиперплазии эндометрия в рак эндометрия, по разным оценкам, составляет 10–40% [1, 5]. Следует отметить повышение распространенности патологии эндометрия у женщин старших возрастных групп [6].
Одним из основных этиопатогенетических механизмов развития гиперпластических процессов эндометрия является гиперэстрогения [7]. Гиперэстрогения служит главной причиной усиленной клеточной пролиферации в гормон-зависимых тканях и в т.ч. в эндометрии, приводя к изменению количества и формы желез, соотношения желез к строме, морфологии эпителиальных клеток и др. [3]. Важное значение в развитии гиперпластических процессов эндометрия имеет локальная гиперэстрогения, при которой наблюдается повышенная чувствительность рецепторов эндометрия к действию эстрогенов при их нормальной или пониженной секреции [1].
В данном исследовании изучены ассоциации полиморфизма генов рецепторов эстрогенов (ESR1 и ESR2) с развитием гиперплазии эндометрия. По данным GeneCards: The Human Gene Database (http://www.genecards.org/) гены рецепторов эстрогенов кодируют соответствующие рецепторы эстрогенов (ESR1 кодирует альфа-рецепторы эстрогенов, ESR2 кодирует бата-рецепторы эстрогенов), которые опосредуют биологические эффекты женских половых гормонов (клеточная пролиферация и др.) в эстроген-зависимых органах и тканях (в т.ч. эндометрии), что имеет важное значение в этиопатогенезе гиперплазии эндометрия [1, 3, 7].
Цель исследования – изучить ассоциации полиморфизма rs3020394 и rs1884051 гена ESR1, rs4986938 гена ESR2 с развитием гиперплазии эндометрия.
Материал и методы
В исследование включена 1501 женщина: 520 пациенток с гиперплазией эндометрия и 981 – контрольной группы. Формирование исследуемых выборок проведено на базе перинатального центра Белгородской областной клинической больницы Святителя Иоасафа с 2008 по 2013 гг. Диагностика гиперплазии эндометрия (гистероскопия с прицельным лечебно-диагностическим выскабливанием полости матки и последующим гистологическим исследованием полученного материала, n=520, 100%) осуществляли врачи гинекологического отделения перинатального центра Белгородской областной клинической больницы Святителя Иоасафа. В группу больных включены пациентки с простой гиперплазией эндометрия без атипии (железистая и железисто-кистозная гиперплазия эндометрия). В контрольную группу включены женщины, не имеющие клинических и эхографических признаков доброкачественных пролиферативных заболеваний женской репродуктивной системы. Формирование контрольной выборки осуществлялось при профилактических осмотрах (диспансеризации) женщин врачами перинатального центра Белгородской областной клинической больницы Святителя Иоасафа. При формировании групп больных и контроля учитывались национальность и место рождения женщин [8]: в них включались индивидуумы русской национальности, являющиеся уроженками Центрального Черноземья России и не состоящие в родстве между собой. Средний возраст больных (41,78±10,04 лет) и группы контроля (40,73±8,60 лет) был одинаков (по U критерию Манна-Уитни p>0,05). Индекс массы тела исследуемых групп больных (26,94±5,56 кг/м2) и контроля (26,66±4,61 кг/м2) также был сопоставим (p>0,05). Все женщины предварительно дали информированное согласие на проведение настоящего исследования. Работа проведена под контролем этического комитета медицинского института Белгородского государственного национального исследовательского университета.
Всем больным с гиперплазией эндометрия и женщинам контрольной группы проведено типирование трех полиморфных локусов генов рецепторов эстрогенов – rs3020394 и rs1884051 гена ESR1, rs4986938 гена ESR2. Выбор этих полиморфных локусов для исследования осуществлен с учетом критериев, изложенных в работе [9], и обусловлен их значимым регуляторным потенциалом (согласно базы данных HaploReg (v.4.1.) (http://compbio.mit.edu/HaploReg).
Материалом для исследования послужила ДНК, выделенная из венозной крови обследуемых, стандартным методом фенольно-хлороформной экстракции. Генотипирование изучаемых полиморфных локусов проводилось на амплификаторе CFX-96 Real-Time System (Bio-Rad) с помощью полимеразной цепной реакции методом TаqMаn зондов с использованием соответствующих олигонуклеотидных праймеров и зондов. Детекция результатов (дискриминация аллелей) осуществлялась с помощью программного обеспечения «Biо-Rаd СFХ ManagerTM».
Сравнительное изучение частот аллелей и генотипов между больными и контролем проводили в таблицах сопряженности 2х2 с использованием критерия χ2 с поправкой Йетса на непрерывность. Расчеты выполнялись в программе «STATISTICA for Windows 6.0». Исследование ассоциаций полиморфных локусов (рассмотрены аддитивная, доминантная и рецессивная генетические модели) с развитием гиперплазии эндометрия проведено с помощью логистического регрессионного анализа. Коррекция на множественные сравнения выполнена с помощью адаптивного пермутационного теста (pperm). Статистически значимым считали уровень pperm<0,05. Расчеты осуществляли в программе PLINK v. 2.050 (http://zzz.bwh.harvard.edu/plink/).
Регуляторный потенциал полиморфных локусов изучали с помощью онлайн программы HaploReg (v4.1) (http://archive.broadinstitute.org/mammals/haploreg/haploreg.php) [10]. Влияние полиморфизма (референсного и альтернативного аллелей) на аффинность мотива ДНК к факторам транскрипции оценивали по методике, изложенной ранее [11].
Связь полиморфизма с экспрессией генов (cis-eQTL) изучали с использованием данных проекта Genotype-Tissue Expression (GTEx) (http://www.gtexportal.org/). В работу включались данные с p<8×10-5, pFDR≤0,05. Оценку влияния аллельных вариантов полиморфизма на транскрипцию генов проводили по ранее представленной методике [12].
Результаты и обсуждение
В результате исследования особенностей клинических и клинико-анамнестических характеристик больных гиперплазией эндометрия в сравнении с контрольной группой (табл. 1) выявлено, что среди пациенток с гиперплазией эндометрия доля женщин, имеющих в анамнезе артифициальные аборты (62,12%) в 1,51 раза выше аналогичного показателя контрольной группы (41,08%, р<0,001). Следует отметить, что среди больных удельный вес женщин, имеющих в анамнезе 2 аборта, в 1,8 раза превышает данные контрольной группы (p<0,001), доля женщин, имеющих в анамнезе 3 аборта – в 1,6 раза (p<0,001), 4 и более абортов – в 6 раз выше аналогичных показателей контрольной группы (p<0,001).
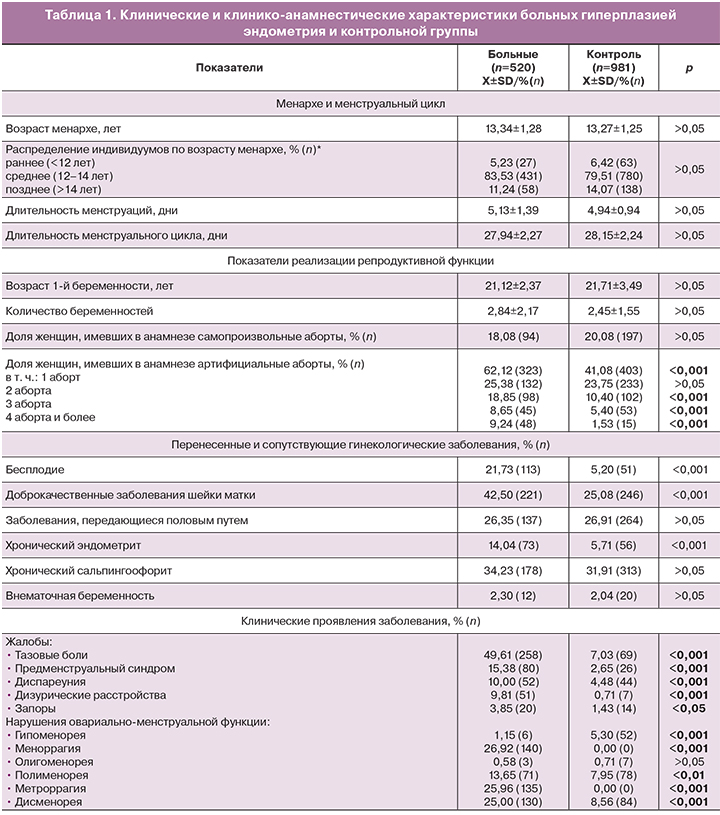
Анализ перенесенных и сопутствующих гинекологических заболеваний показал высокую встречаемость среди больных гиперплазией эндометрия хронического эндометрита (в 2,46 раза, p<0,001), доброкачественных заболеваний шейки матки (в 1,69 раза, p<0,001) и бесплодия (в 4,18 раза, p<0,001).
Практически половина пациенток с гиперплазией эндометрия предъявляла жалобы на боли внизу живота (49,61%), четвертая часть больных указывала на меноррагию (26,92%), метроррагию (25,96%) и дисменорею (25,00%). У каждой 6–7-й женщины были жалобы на предменструальный синдром (15,38%) и полименорею (13,65%). Среди женщин контрольной группы данные жалобы регистрировались существенно реже (р<0,001).
Распределение генотипов по полиморфным локусам rs3020394 и rs1884051 гена ESR1, rs4986938 гена ESR2 среди больных гиперплазией эндометрия и в контрольной группе соответствует теоретически ожидаемому, при равновесии Харди-Вайнберга (p>0,05). При сравнительном изучении частот аллелей и генотипов полиморфных локусов генов рецепторов эстрогенов у больных и в контроле (табл. 2) выявлены ассоциации полиморфизма rs4986938 гена ESR2 с развитием гиперплазии эндометрия. Установлено, что среди больных частота генотипа А/А полиморфизма rs4986938 достоверно выше (в 1,37 раза), чем в контрольной группе (p=0,04). Таким образом, генотип А/А полиморфизма rs4986938 является фактором риска развития гиперплазии эндометрия (OR=1,43 95%CI 1,02–2,02). Выявлена ассоциация аллеля A rs4986938 гена ESR2 с развитием гиперплазии эндометрия в рамках рецессивной модели (p=0,04, pperm=0,04). Данный аллель повышает риск развития заболевания (OR=1,42).
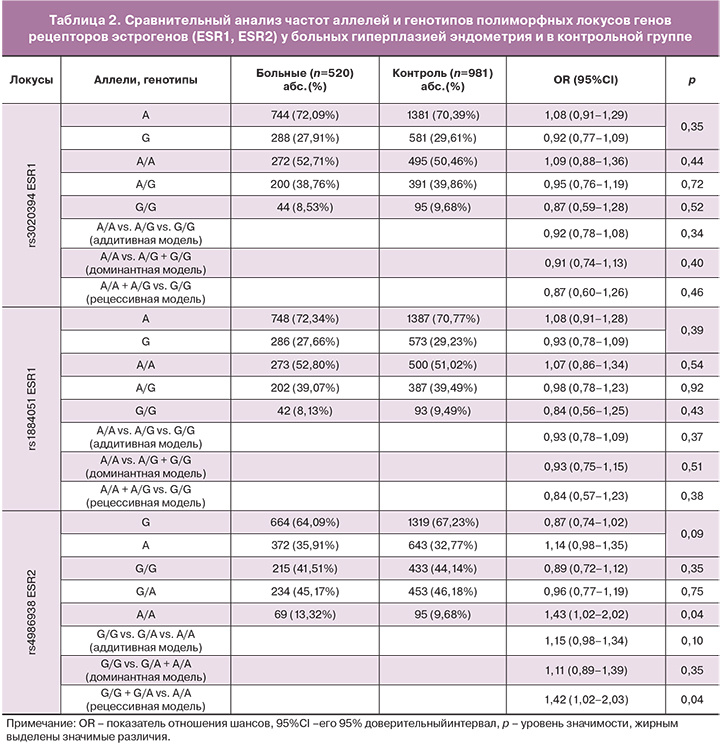
Данные, представленные в онлайн программе HaploReg (v4.1), свидетельствуют о существенном регуляторном потенциале полиморфизма rs4986938 гена ESR2. Установлено, что этот полиморфный локус расположен в регионе гистонов, маркирующих энхансеры в клетках 17 различных органов и тканей (в т.ч. в мезенхимных стволовых клетках, являющихся предшественниками адипоцитов, стволовых клетках костного мозга, клетках периферической крови, яичниках, жировой и мышечной ткани и др.), регионе гиперчувствительности к ДНКазе-1 в 6 тканях и регионе регуляторных мотивов ДНК, являющихся сайтами связывания с 5 факторами транскрипции – CTCF_known1, Nr2f2, Pax-6_1, Pax-8_1, RAR. При этом аллель А, являющийся «рисковым» для развития гиперплазии эндометрия, повышает аффинность к транскрипционным факторам CTCF_known1 (различие между LOD scores аллелей А (alt) и G (ref) составляет 0,6), Pax-6_1 (различие между LOD scores аллелей А (alt) и G (ref) составляет 11,1), RAR (различие между LOD scores аллелей А (alt) и G (ref) составляет 0,1) и снижает аффинность к факторам транскрипции Nr2f2 (различие между LOD scores аллелей А (alt) и G (ref) составляет -2,6) и Pax-8_1 (различие между LOD scores аллелей А (alt) и G (ref) составляет -1,6).
Согласно литературным данным, CTCF является многофункциональным транскрипционным фактором и играет важную роль в различных ДНК-зависимых процессах в организме: участвует в регуляции экспрессии генов за счет образования функциональных хроматиновых доменов, обеспечивает активность инсуляторов, участвует в инактивации X-хромосомы, импринтинге генетической информации, регулирует процесс сплайсинга РНК и др. [13, 14]. Следует отметить, что мезенхимные стволовые клетки, значимый регуляторный потенциал в которых имеет полиморфизм rs4986938 гена ESR2, вовлечены в процессы, происходящие в переходной зоне миометрия/эндометрия, и играют важную роль в этиопатогенезе доброкачественных пролиферативных заболеваний женской репродуктивной системы [15, 16].
С помощью он-лайн программы GTExportal (содержит данные об экспрессии генов в 48 различных органах и тканях) in silico выявлены ассоциации полиморфизма rs4986938 с уровнем транскрипции генов ESR2 в коже и большеберцовом нерве (коэффициент линейной регрессии для аллеля А равен β=-0,40, р=5,60×10-13 и β=-0,37, р=5,60×10-8 соответственно, pFDR<0,05), гена SYNE2 в сердце (коэффициент линейной регрессии для аллеля А равен β=0,22, р=5,60×10-8, pFDR<0,05) и гена MTHFD1 в большеберцовом нерве (коэффициент линейной регрессии для аллеля А равен β=-0,14, р=0,000049, pFDR<0,05). Следует отметить, что в рамках международного проекта Genotype-Tissue Expression (GTEx) [17] (http://www.gtexportal.org/) изучена связь полиморфных локусов с экспрессией генов в 48 различных органах и тканях, но при этом эндометрий не являлся объектом исследований, что не позволяет в полной мере рассмотреть связь исследуемого полиморфного локуса rs4986938 ESR2 с экспрессией генов в ткани-мишени (эндометрий) при развитии гиперплазии эндометрия.
Нами впервые показаны ассоциации полиморфизма rs4986938 гена ESR2 с развитием гиперплазии эндометрия. В ранее проведенных исследованиях установлены ассоциации полиморфного локуса rs4986938 гена ESR2 с возрастом менархе [18], развитием гинекомастии у подростков [19], формированием эндометриоза [20] и бесплодия, ассоциированного с эндометриозом [21]. Выявлен более высокий уровень экспрессии генов эстрогеновых рецепторов в очагах аденомиза и в миометрии больных миомой матки [22]. Ген ESR2 кодирует бета-рецепторы эстрогенов, которые опосредуют эффекты женских половых гормонов в тканях (http://www.genecards.org/) и в т.ч., процессы эстроген-зависимой клеточной пролиферации, что имеет важное значение в этиопатогенезе гиперплазии эндометрия [1, 3]. Согласно данным базы GeneCards: The Human Gene Database (http://www.genecards.org/) ген MTHFD1 (Methylenetetrahydrofolate Dehydrogenase, Cyclohydrolase And Formyltetrahydrofolate Synthetase 1) является белок-кодирующим, его продукт задействован в биохимических процессах с участием трех ферментов – 5,10-метилентетрагидрофолат дегидрогеназы, 5,10-метилентетрагидрофолат циклогидролазы и 10-формилтетрагидрофолат синтетазы. Данные ферменты катализируют три последовательные реакции превращения одноуглеродных производных тетрагидрофолата, являющихся субстратами для синтеза метионина, тимидилата и пурина. Следует отметить значимую роль метаболизма фолатов в процессах клеточной пролиферации, что важно для пролиферирующих тканей (к ним относится и эндометрий) и является одним из механизмов туморогенеза [23]. Белковый продукт гена SYNE2 (Spectrin Repeat Containing Nuclear Envelope Protein 2) является ядерным мембранным протеином, который взаимодействует с цитоплазматическим F-актином. Это взаимодействие «привязывает» ядро к цитоскелету и обеспечивает поддержание структурной целостности ядра. В ранее проведенном полногеномном исследовании (GWAS) Sapkota Y. et al. [24] выявлены ассоциации с развитием эндометриоза полиморфизма гена SYNE1. Следует отметить, что гены SYNE1 и SYNE2 являются паралогичными генами (образовались в результате дупликации предкового гена с последующей дивергенцией) (http://www.genecards.org/). Наши результаты дополняют полученные ранее данные о молекулярно-генетических детерминантах гиперплазии эндометрия, бесплодия при генитальном эндометриозе у женщин Центрального Черноземья России [25, 26].
Заключение
Получены данные об ассоциации полиморфизма rs4986938 гена ESR2 с развитием гиперплазии эндометрия. Генотип А/А является фактором риска развития заболевания (OR=1,43). Полиморфизм rs4986938 гена ESR2 имеет значимые регуляторные эффекты (находится в регионе гистонов, маркирующих энхансеры в 17 различных органах и тканях, регионе гиперчувствительности к ДНКазе-1 в 6 тканях и регионах регуляторных мотивов ДНК, являющихся сайтами связывания с 5 факторами транскрипции – CTCF_known1, Nr2f2, Pax-6_1, Pax-8_1, RAR) и влияет на экспрессию генов ESR2, SYNE2, MTHFD1.



