Улучшение здоровья населения, развитие медицинских технологий и другие положительные социальные сдвиги привели к тому, что взрослые лица в возрасте старше 50 лет представляют сейчас самый быстро растущий сегмент общества [1]. Но результатом увеличения продолжительности жизни стало появление новых социальных и медицинских проблем, обусловленных связанными со старением дегенеративными процессами [1, 2]. С увеличением возраста, как у женщин, так и мужчин, наблюдается постепенная потеря мышечного тонуса, костной массы, снижение энергетического уровня, ослабление иммунитета, когнитивных функций, повышение веса, вторично ведущее к росту риска метаболических и сердечно-сосудистых заболеваний. Значимым маркером старения у женщин становится прекращение овариальной функции, которое вносит дополнительный вклад в ухудшение сердечно-сосудистого, психического здоровья и развитие остеопороза [3].
Множество гипотез пытаются объяснить причину старения и биологическую основу постепенной утраты функций [4–6] – среди них управляемые генами клеточные сценарии, хромосомные повреждения, нарушения репарации ДНК и укорочение теломеры. Другие физиологические причины включают гормональный дисбаланс, избыточное потребление калорий, митохондриальную дисфункцию и окислительный стресс. В любом случае, старение рассматривается как мультифакторный и кумулятивный процесс, где множественные компоненты взаимодействуют друг с другом, создавая каскад нарушений [7] и вовлекаясь в патогенез разнообразных заболеваний, среди которых ярким представителем выступает менопаузальный остеопороз.
Остеопороз является самой частой патологией костей, заболеваемость им увеличивается с возрастом, и в постменопаузе распространенность остеопороза составляет от 13–18 до 30% [8]. Заболевание развивается в результате действия предотвратимых и непредотвратимых факторов, роль некоторых из них на сегодня точно подтверждена, других – признается с высокой степенью вероятности [9]. К доказанным факторам риска остеопороза относят принадлежность к расе белых или азиатских женщин, возраст старше 65 лет, раннюю менопаузу, хирургическую менопаузу, длительное лечение глюкокортикостероидами (более 6 месяцев), остеопороз у родственников, низкотравматичные переломы. Как вероятные факторы рассматриваются низкое весоростовое соотношение, длительная обездвиженность, злоупотребление алкоголем, низкое потребление кальция, курение, повышенное потребление белка/фосфатов, повышенное потребление кофеина, гиперпаратиреоз [10]. Ответственные за функционирование костной и других органных систем наследственные факторы детерминируют более 60% случаев остеопороза и являются непредотвратимыми. Остальные 40% риска обеспечены средовыми влияниями, среди которых факторы образа жизни относятся к преходящим, предотвратимым, которые можно и нужно преодолевать [11].
Коррекция привнесенного риска является мощным ресурсом в снижении частоты остеопоротических переломов. Факторы внешней среды и образа жизни имеют качественные характеристики и устанавливаются по опросу пациентов, за исключением витамина D, который можно считать количественным маркером риска остеопороза. Уровень содержания витамина D – 25(OH)D в крови менее 50 нмоль/л связан с повышением риска остеопороза и других патологических состояний и болезней, в том числе ухудшением мышечной функции, риском сердечно-сосудистых заболеваний и некоторых опухолей [12].
Одним из самых обсуждаемых в настоящее время является вопрос взаимосвязи остеопороза с избыточным или недостаточным весом. Ассоциация низкой массы тела и остеопороза в целом ясна, но постулат о том, что ожирение является фактором риска остеопороза, все еще вызывает недоумение. Между тем, патогенетическая взаимосвязь этих двух социально значимых заболеваний существует и опосредуется, по-видимому, лептином и гормоном D.
Лептин, как показали исследования in vitro, стимулирует костеобразование, действуя на стромальные клетки и повышая дифференциацию остеобластов с одновременным ингибированием дифференциации адипоцитов. Лептин ингибирует остеокластогенез, уменьшая экспрессию рецептора активатора ядерного фактора κВ (RANK) и его лиганда (RANKL) и повышая продукцию остеопротергина (OPG) [13]. Таким образом, недостаточный эффект лептина может приводить к редукции костеообразования и росту костной резорбции. Интересно, что факторы метаболического риска имеют большее значение в женской популяции по сравнению с мужчинами: в продольном когортном исследовании уровень лептина сыворотки крови был ассоциирован с минеральной плотностью кости (МПК) у пожилых лиц обоих полов (р<0,01), но после контроля ковариант, таких как возраст и индекс массы тела (ИМТ), существенная связь сохранялась только у женщин [14].
Роль низкого статуса питания, напротив, иногда преувеличивается. Наблюдательные исследования свидетельствуют, что много рожавшие и длительно кормившие грудью женщины развивающихся стран имеют риск постменопаузального остеопороза, эквивалентный таковому у женщин стран Запада с более высоким статусом питания и низким паритетом [15]. Данный факт заставляет сместить акценты в значимости тех или иных факторов риска.
Несомненный вклад в потерю МПК у женщин вносит прекращение овариальной функции. Менопауза и развитие остеопороза четко связаны по времени: костная ткань в постменопаузе теряется со скоростью 1–2% в год, и к 80 годам женщины утрачивают половину массы кости. Здесь очевидно прямое и опосредованное влияние на костную ткань эстрогенов [16]. Прямое воздействие осуществляется через специфические рецепторы на остеокластах, остеоцитах, трабекулярных активных и неактивных остеобластах, а также костных эндотелиальных клетках, и состоит в регуляции активности цитокинов, участвующих в процессах резорбции кости (интерлейкины 1 и 6, фактор некроза опухоли). Опосредованные механизмы включают синтез кальцитонина, регуляцию действия паратиреоидного гормона (ПТГ) и кальцитриола, всасывание кальция в кишечнике, реабсорбцию его почками. Вышеуказанные эффекты позволяют женским половым гормонам сохранять баланс формации и разрушения кости.
Профилактика остеопороза абсолютно необходима всем женщинам, вступающим в менопаузальный переход [8]. Среди профилактических мероприятий важны физические упражнения с нагрузкой на скелет, которые способствуют сохранению МПК и снижают риск падений: ходьба и бег обеспечивают нагрузку на позвоночник и проксимальные отделы бедренных костей, а подъем тяжестей – тренировку рук. Уменьшение потребления алкоголя или полный отказ от спиртных напитков, отказ от курения и, по возможности, применения лекарственных средств, отрицательно влияющих на МПК, также необходимы в коррекции образа жизни у пациентов группы риска остеопороза.
Коррекция питания и приема микронутриентов составляет вторую важную часть профилактики остеопороза. Универсального подхода здесь не существует: популяции с разным типом питания, уровнем дохода и характером физической активности нуждаются в разных нормах потребления. Например, в развивающихся юго-восточных странах для категорий лиц с низким уровнем дохода и социальным статусом традиционное питание оказывается достаточной мерой по защите от потери МПК [17]. В отношении европейской популяции устоявшейся точкой зрения является необходимость дотации с целью профилактики остеопороза, кальция и нативного витамина D.
Витамин D, кальциферол, относится к группе жирорастворимых витаминов, но, в отличие от большинства биологически активных веществ, объединяемых понятием «витамины», он не является коферментом биохимических реакций. Поступая в организм, кальциферол, главным образом холекальциферол – витамин D3, подвергается двухступенчатому метаболизму – сначала в печени с образованием неактивного, транспортного метаболита 25(ОН)D, и затем в почках с образованием активного метаболита кальцитриола, проявляющего эффекты истинного гормона и инициирующего значимые реакции более чем в сорока тканях-мишенях. Применение нативного витамина D рассчитано на восполнение недостающего поступления кальциферола в организм и последующую его трансформацию в кальцитриол. Характеристики этой трансформации будут зависеть от способности ферментных систем печени и почек обеспечить метаболизм кальциферола в кальцитриол и не контролируются извне. Следует также разделять понятия терапии D-дефицитных состояний и профилактики их последствий, где уместно восполнение уровня витамина D, с терапией состоявшихся заболеваний, в патогенезе которых участвует D-дефицит. Терапия состоявшегося остеопороза базируется не на восполнении уровня витамина D, а на непосредственном действии гормона D на костную ткань. И эти эффекты реализуются вне зависимости от содержания витамина D в плазме крови, в том числе и при его нормальной концентрации. Таким образом, дотация нативного витамина D относится к профилактическим мероприятиям [8], тогда как применение активных метаболитов витамина D заявлено как метод лечения остеопороза.
Диагноз остеопороза устанавливается как клинически, так и по результатам денситометрии – преимущественно, с использованием двуэнергетической рентгеновской абсорбциометрии костей [18] – в соответствии с рекомендациями рабочей группы ВОЗ по уровню Т-критерия. Для женщин белой расы остеопорозом считается снижение МПК на 2,5 и более стандартных отклонений ниже пика костной массы молодых лиц здоровой популяции, остеопения характеризуется показателем Т-критерия от –1 до –2,5 SD [8, 19]. Биохимические маркеры костного метаболизма используются в качестве предикторов переломов и при оценке эффективности терапии [20]. Женщинам, у которых Т-критерий ниже –2 или, при наличии других факторов риска остеопороза, ниже –1,5, рекомендуется лечение с целью предотвращения остеопоретических переломов. Именно предотвращение остеопоротеческих переломов является главной клинической задачей терапии, а количественный показатель МПК действительно отражает прочность кости и может использоваться для оценки потенциального риска.
Однако большое число не-скелетных факторов вносят свой вклад в риск переломов, и их влияние следует учитывать. С этой целью было разработано несколько программ, самой популярной из которых является FRAX [21]. При невозможности проведения денситометрии, а также при наличии остеопении программа FRAX, рассчитывающая 10-летнюю вероятность переломов по совокупности клинических факторов и данных денситометрии (если таковые имеются), помогает принять решение о постановке диагноза «Вероятный остеопороз. М 81.8» и о назначении фармакологической терапии.
Наконец, существует группа высокого риска по возникновению остеопоретических переломов, для представителей которой нет нужды выполнять денситометрию или рассчитывать риск переломов с использованием компьютерной поддержки. В эту группу попадают женщины в постменопаузе, уже имеющие в анамнезе остеопоретический перелом. Высокий риск определяется также возрастом старше 65 лет при наличии дополнительных клинических факторов.
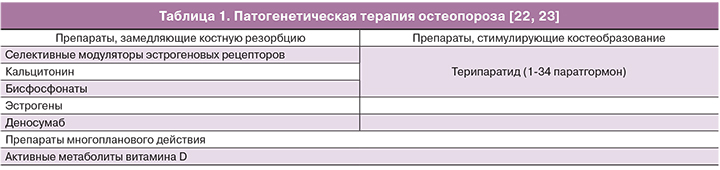
Патогенетическая терапия остеопороза включает в себя несколько групп препаратов (табл. 1) [8, 19].
В мире к часто назначаемым антирезорбтивным препаратам относятся селективные модуляторы эстрогеновых рецепторов (СМЭР), мало доступные в России. СМЭР представляют собой нестероидные агенты, которые взаимодействуют с эстрогеновым рецептором как агонисты или как антагонисты, в зависимости от типа ткани. Применение СМЭР (ралоксифен, базедоксифен) предохраняет от потери МПК и редуцирует риск вертебральных переломов на 30–50%. Снижение риска внепозвоночных переломов в большей степени свойственно базедоксифену. Эффективность ралоксифена не зависит от уровня вероятности переломов, рассчитанной с помощью модели FRAX, в отличие от базедоксифена [24].
Среди дополнительных полезных свойств указывается снижение риска рака молочной железы на 60% [25], положительное влияние на липидный профиль [21]. Осложнения СМЭР включают венозную тромбоэмболию (редко), приливы жара и судорожные сокращения мышц нижних конечностей [26]. В целом, соотношение пользы и риска использования СМЭР для терапии постменопаузального остеопороза признается благоприятным [8].
Бисфосфонаты – самый распространенный метод терапии остеопороза [8]. Эта группа стабильных аналогов пирофосфата имеет сильное сродство к апатитам кости, что обеспечивает их потенциал в ингибировании костной резорбции. Большое число бисфосфонатов (алендронат, ризедронат, ибандронат, золендроновая кислота) с разными режимами введения используются в клинической практике. С помощью бисфосфонатов достигается редукция частоты переломов позвонков и внепозвоночных переломов 40–70 и 30–34% соответственно. Эффект зависит от вида лекарственного средства [8, 22, 27]. Общий профиль безопасности бисфосфонатов благоприятен. Прием оральных бисфосфонатов ассоциирован с желудочно-кишечными расстройствами, и некоторые препараты (алендронат и памидронат) изредка вызывают эзофагит. Внутривенные аминобисфосфанаты вызывают транзиторную острофазную реакцию с лихорадкой и мышечной болью [28]. Остеонекроз челюсти описан только у онкологических больных, получающих высокие дозы памидроната или золедроната внутривенно. Обсуждается вероятная взаимосвязь применения бисфосфонатов и фибрилляции предсердий [29]. Требуют подтверждения данные о повышении риска рака пищевода при длительном, более 5 лет, оральном приеме бисфосфонатов [30], так же как и факты о снижении смертности и онкологической заболеваемости [31]. В целом, польза применение бисфосфонатов для профилактики переломов превышает возможные риски.
Интермиттирующее введение препарата паратгормона в виде ежедневных подкожных инъекций повышает число и активность остеобластов, что ведет к увеличению костной массы и улучшает архитектонику кости [8]. Положительный эффект терипартида в отношении риска переломов сохраняется в течение 30 месяцев после окончания годового курса терапии. Побочные реакции возникают в виде тошноты, болей в конечностях, головной боли и слабости. Терипартид противопоказан при любых нарушениях метаболизма кости, за исключением первичного остеопороза, при нарушениях функции почек.
Стронция ранелат зарегистрирован как средство терапии остеопороза, редуцирует риск переломов позвонков и бедренной кости, степень этой редукции не зависит от уровня риска, рассчитанного в программе FRAX [32]. Частота вертебральных и внепозвоночных переломов была ниже на 35 и 38% соответственно при отсроченном наблюдении по сравнению с плацебо [33]. Осложнения терапии включают повышенную частоту венозной тромбоэмболии (RR=1,42; 95% CI=1,02–1,98) [34], а также редкие, но тяжелые кожные реакции. Препарат противопоказан пациентам с почечной недостаточностью при клиренсе креатинина менее 30 мл/мин. Стронция ранелат значительно уступает другим средствам терапии остеопороза в соотношении «польза/риск», ввиду чего в последние годы используется редко.
Критически важными молекулами, определяющими дифференциацию, активацию и выживание остеокластов, являются RANK, его лиганд RANKL, член суперсемейства фактора некроза опухоли, и OPG, действующий как ложный рецептор RANKL. Антитело против RANKL – деносумаб – предотвращает связывание лиганда с рецептором и следующую за этим активацию остеокластов [35]. Применение 60 мг деносумаба подкожно каждые 6 месяцев снижает у женщин с менопаузальным остеопорозом частоту переломов позвонков на 69%, невертебральных переломов на 20% и переломов бедренной кости на 40% [36]. Среди редких побочных эффектов описан некроз челюсти.
Полипептидный гормон кальцитонин ингибирует костную резорбцию [37], но действие его в отношении снижения частоты переломов менее значимо по сравнению с другими антирезорбтивными средствами. К положительным свойствам кальцитонина следует отнести его обезболивающий эффект, который может быть полезен при острой боли после перелома.
Менопаузальная гормональная терапия применяется главным образом у женщин в ранней постменопаузе, особенно при наличии приливов жара и других симптомов климактерического синдрома. У данной категории пациенток гормональная терапия может рассматривается как средство первой линии профилактики и терапии менопаузального остеопороза [8].
К препаратам с многосторонним действием на костную ткань и мышцы относят активные метаболиты витамина D (альфакальцидол и кальцитриол). Альфакальцидол является синтетическим аналогом метаболита витамина D кальцитриола (1,25-дигидроксивитамин D3) и превращается в кальцитриол путем 25-гидроксилирования в печени. Эффективность альфакальцидола и кальцитриола в терапии остеопороза и профилактике переломов сравнима. Данные клинических исследований по применению активных метаболитов витамина D неоднократно обобщались в систематизированных обзорах и мета-анализах. Результаты этих обобщений достаточно однородны [38, 39]. Риск переломов позвонков при приеме кальцитриола в дозе 0,5 мкг в день в течение одного года снижается почти в два раза по сравнению с плацебо (RR=0,49; 95% CI=0,25–0,95). Кальцитриол в дозе 0,5 мкг в день при приеме в течение двух лет оказался вдвое эффективнее по сравнению с препаратами кальция (RR=0,47; 95% CI=0,26–0,87). Трехлетний прием кальцитриола оказал еще более выраженный эффект на снижение риска переломов позвонков (RR=0,28; 95% CI=0,15–0,52) в сравнении с приемом препаратов кальция; аналогичные наблюдения характеризовали снижение риска невертебральных переломов, кроме шейки бедра (RR=0,45; 95% CI=0,22–0,90).
При сравнении эффектов альфакальцидола и кальцитриола были получены противоречивые результаты. В некоторых мета-анализах принципиальных отличий в эффективности активных метаболитов витамина D не получено, в других указано на преимущества альфакальцидола [36]. Суммарная оценка влияния этих препаратов показала прирост МПК в позвоночнике по сравнению с контролем (p<0,0001) и не зависела от исходных значений МПК и от того, получали ли пациенты контрольной группы препараты кальция [37]. Аналогичные данные были получены при изучении влияния активных метаболитов витамина D на риск переломов: суммарная оценка эффективности этих препаратов показала снижение риска переломов любых локализаций по сравнению с контролем (RR=0,52; 95% CI=0,46–0,59). Однако существенная редукция частоты переломов позвонков (OR=0,50, 95% CI=0,25–0,98) отмечалась при использовании альфакальцидола, но не кальцитриола [39]. Редукция невертебральных переломов характеризовала оба препарата и была достоверной (OR=0,51, 95% CI=0,30–0,88). Снижение риска не зависело от показателей костной плотности до начала лечения и от того, получали ли пациенты контрольной группы препараты кальция.
Преимуществом альфакальцидола перед препаратами нативного витамина D является одноступенчатая метаболизация первого только в печени, что особенно важно у пациентов с возрастным снижением функции почек. Помимо этого, сравнительные исследования влияния активных метаболитов и нативного витамина D показали большую эффективность первых в отношении снижения риска переломов позвонков и периферических костей при первичном остеопорозе (delta RD=13,4%, 95% CI=7,7–19,8 для переломов позвонков и delta RD=6%, 95% CI=1–12 для внепозвоночных переломов, p<0,05). Аналогичные результаты были показаны в отношении накопления МПК: показатель МПК в целом – ES=0,36 для активных метаболитов против ES=0,17 для нативного витамина D, p<0,05; показатель МПК позвоночника 0,43 против 0,21, p<0,05. Сравнение эффективности комбинированной терапии деносумабом и активным метаболитом витамина D выявило существенные преимущества перед лечением деносумабом и нативным витамином D [38].
Интерес к применению активных метаболитов витамина D возрос в связи с их плейотропными эффектами у пожилых людей, в частности, способностью положительно влиять на функцию мышц и, таким образом, предупреждать падения у пациентов старшей возрастной группы. Известно, что низкий уровень D-гормона ассоциирован с миопатией, расстройствами координации движений, нарушениями походки. Существует зависимость между концентрацией активных метаболитов витамина D3 и мышечной силой у пожилых лиц. Клинические исследования продемонстрировали, что альфакальцидол снижает риск падений в сравнении с группой плацебо у пожилых лиц с остеопорозом при умеренном дефиците потребления кальция (OR=0,66, 95% CI=0,44–0,98) [39]. Причем уменьшалось не только число самих падений, но и количество лиц, подверженных падениям.
Эффективность активных метаболитов в отношении падений значительно превышает таковую у нативного витамина D. Помимо влияния на мышечную ткань, витамин D обладает множеством благоприятных воздействий, и число позитивных эффектов постоянно растет – среди органных систем, страдающих от дефицита витамина D, упоминаются сердечно-сосудистая, бронхолегочная, иммунная, репродуктивная, эндокринная системы, и др. Альфакальцидол, используемый для лечения остеопороза и профилактики возникающих на его фоне переломов, оказывает дополнительное позитивное влияние на течение болезней самого разного плана, ассоциированных с дефицитом витамина D [39, 40].
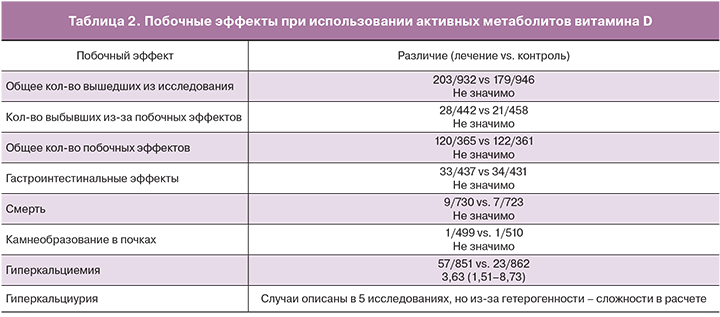
Побочные эффекты активных метаболитов витамина D встречаются нечасто и ограничиваются гиперкальциемией и гиперкальциурией (табл. 2) [36]. В связи с этим во время лечения необходим контроль уровня кальция в крови через 2, 6, 8 недель лечения, и затем 1 раз в 3 месяца [19].
В Российских клинических рекомендациях по остеопорозу сделаны следующие заключения в отношении активных метаболитов витамина D [19]: активные метаболиты витамина D способны замедлять скорость костных потерь при первичном остеопорозе (уровень доказательности В); активные метаболиты витамина D уменьшают частоту переломов позвонков и внепозвоночных переломов, кроме перелома шейки бедра, у лиц с первичным остеопорозом (А); активные метаболиты витамина D (альфакальцидол, кальцитриол) могут применяться для лечения первичного остеопороза, в том числе в составе комбинированной терапии с бисфосфонатами (А); длительное использование активных метаболитов витамина D требует контроля кальция в крови (В); активные метаболиты эффективны для снижения риска падений, особенно у лиц с клиренсом креатинина менее 60 мл/мин (А); при назначении активных метаболитов необходимо обеспечить поступление кальция не менее 500 мг/сут.
Препарат альфа Д3 Тева может применяться в соответствии современными клиническими рекомендациями как средство терапии остеопороза второй линии.
Обзор современных средств для лечения остеопороза демонстрирует, что каждая группа препаратов обладает положительными свойствами и имеет ряд ограничений. В то же время разнонаправленные эффекты различных лекарственных средств позволяют предположить усиление действия при их совместном применении.
Вопросы комбинированной терапии остеопороза препаратами с разным механизмом действия интенсивно изучаются. Режим комбинированной терапии предлагает как одновременное назначение разных по механизму действия препаратов, так и последовательные схемы лечения. Использование алендроната в сочетании с менопаузальной гормональной терапией оказывало более существенный положительный эффект на МПК и костные маркеры, чем каждый вид терапии в отдельности. Однако данных об уменьшении под их влиянием частоты переломов нет. Исследование совместного применения ралоксифена и алендроната на МПК и маркеры костного метаболизма показало усиление совместного положительного эффекта, но потенциальное действие в отношении риска переломов остается неизвестным.
Изучались также эффекты комбинированной терапии анаболическим (паратиреоидный гормон) и антирезорбтивным (алендронат) средствами. Но предположение о положительном одновременном эффекте по снижению костной резорбции (алендронат) и повышению костеообразования (терипартид) оказалось неверным: комбинированное лечение было менее эффективным, чем терапия только терипаратидом как у женщин, так и у мужчин старшей возрастной категории. В то же время назначение алендроната после завершения курса лечения терипаратидом позволило добиться прироста МПК.
Обнадеживающие результаты комбинированной терапии остеопороза были получены при совместном использовании бисфосфонатов и активного метаболита витамина D – альфакальцидола [41]. Теоретической предпосылкой такого применения стало представление о механизме действия бисфосфонатов и альфакальцидола. Терапия бисфосфанатами уменьшает содержание кальция в крови, ингибируя костный метаболизм, что приводит к росту концентрации ПТГ. Сигнал рецептора ПТГ в остеобластах и остеоцитах повышает соотношение RANKL/OPG, что приводит к повышению активности остеокластов и увеличению костной резорбции [42]. Прервать эту цепь негативных событий, снижающих эффективность бисфосфонатов, помогают активные метаболиты витамина D. Альфакальцидол повышает уровень кальция в сыворотке крови и снижает концентрацию ПТГ [43], что нормализует кальциево-фосфорный обмен и оптимизирует действие бисфосфонатов.
В клинических исследованиях прием алендроновой кислоты 70 мг внутрь один раз в неделю в сочетании с альфакальцидолом в дозе 1 мкг внутрь ежедневно и 500 мг кальция позволил добиться существенно большей прибавки МПК в поясничном отделе позвоночника и проксимальном отдела бедра по сравнению с традиционным назначением алендроната и нативного витамина D с кальцием [43]. Кроме того, в группе комбинированного лечения имелась отчетливая тенденция к снижению риска падений и переломов. Общее количество падений было сопоставимым у пациентов, получавших альфакальцидол с бисфосфонатами или только альфакальцидол, и ниже, чем число падений у пациентов, получавших бисфосфонаты с нативным витамином D. Суммарное число новых переломов за два года наблюдения в группе пациентов, принимавших альфакальцидол с бисфосфонатами, оказалось достоверно меньше числа показателей, наблюдавшихся среди пациентов, получавших только альфакальцидол или комбинацию бисфосфонатов с витамином. Похожие результаты по редукции риска переломов при комбинированном применении алендроната и альфакальцидола были получены в других работах [44].
В недавнем исследовании было проведено сравнение применения ибандроната (1,0 мг внутривенно один раз в месяц) как монотерапии или в сочетании с альфакальцидолом (1 мкг внутрь ежедневно) у женщин с менопаузальным остеопорозом [45]. По результатам исследования были получены существенные улучшения по биохимическим показателям костного метаболизма, более значимые в группе комбинированного лечения. Выраженный прирост МПК отмечался через 6 месяцев у пациенток, получавших комбинированную терапию, тогда как у пациенток, получавших только бисфосфонат, достичь данного уровня удавалось только через 18 месяцев. К концу 18-месячного исследования МПК поясничного отдела позвоночника повысилась на 6,6% в группе комбинированной терапии против 3,4% в группе монотерапии ибандронатом; МПК проксимального отдела бедренной кости – на 4,8% против 3,2% соответственно. Эти данные позволяют говорить о пользе применения альфакальцидола в составе комбинированной терапии с бисфосфонатами.
Таким образом, альфакальцидол (альфа Д3 Тева) – оптимальный препарат витамина D для лечения остеопороза у пациентов старше 45 лет. Альфа Д3 Тева демонстрирует большую клиническую эффективность по сравнению с нативными витаминами D, при этом обеспечивая сопоставимый профиль безопасности [46–48]. Альфакальцидол может применяться, в соответствии с современными клиническими рекомендациями, и как монотерапия менопаузального остеопороза (средство второй линии), и как компонент комбинированной терапии остеопороза с бисфосфонатами, улучшая ее исходы.



