Эндометриоз является мультисистемным хроническим воспалительным заболеванием, которое встречается в 10–15% случаев среди пациенток репродуктивного периода (190 млн женщин во всем мире) [1].
Актуальность эндометриоза в структуре гинекологической заболеваемости в настоящее время возрастает в связи с повышенным риском последующей диагностики злокачественных новообразований, аутоиммунных заболеваний, возникновения ранней естественной менопаузы, цереброваскулярных и сердечно-сосудистых заболеваний, а также сопутствующих хронических заболеваний (мигрень, ревматоидный артрит, фибромиалгия, псориатический артрит, остеоартрит) [2–9]. В ряде последних исследований выявлено почти двукратное увеличение относительного риска развития онкологических заболеваний яичников (светлоклеточная и эндометриоидная аденокарциномы) среди пациенток с эндометриозом – до 2,5%, что на 1,2% выше абсолютного риска для пациенток. Частота малигнизации данного заболевания составляет 1–13% [1, 10].
Почти 60% пациенток обращаются к трем и более специалистам, прежде чем будет выставлен окончательный диагноз и назначено лечение, что в среднем занимает около 7 лет. Поэтому в настоящее время возрастает актуальность поиска чувствительных специфичных диагностических маркеров эндометриоза яичников (ЭЯ) по причине их отсутствия на сегодняшний день [1, 11].
В последнее время особый интерес вызывает экспрессия длинных некодирующих РНК (днРНК) (большая группа некодирующих РНК длиной более 200 нуклеотидов) в связи с их решающей ролью в молекулярных функциях, включая процессинг РНК, транскрипционную и посттранскрипционную модуляцию экспрессии генов. днРНК участвуют во многих важных биологических процессах, таких как пролиферация клеток, выживание, дифференцировка, органогенез, дозовая компенсация, геномный импринтинг и ремоделирование хроматина [12]. Однако результаты исследований также показывают их существенную роль в канцерогенезе через сигнальные пути Wnt, Hedgehog, Notch и PI3K/AKT/mTOR [13]. Нарушение регуляции нескольких днРНК может оказывать влияние на основные характеристики онкологических клеток, в том числе на контроль экспрессии онкогенов, связанных с их супрессивными и онкогенными функциями. Следовательно, циркулирующие днРНК имеют ряд преимуществ по сравнению с традиционными биомаркерами (белки) и могут быть конкурентными биомаркерами при онкологических заболеваниях, в том числе и при эндометриоз-ассоциированном раке яичников, а также определять глубину инвазии патологического очага в здоровую ткань [14–17].
MALAT1 (Metastasis Associated Lung Adenocarcinoma Transcript 1) – многофункциональная РНК, которая формирует молекулярные каркасы для рибонуклеопротеидных комплексов, регулирующих пролиферацию и миграцию клеток [18, 19]. MALAT1 – один из первых идентифицированных днРНК, ассоциированных с канцерогенезом. В нескольких исследованиях рассматривался как биомаркер онкологических процессов [20–22]. Данная РНК может действовать как регулятор транскрипции для множества генов, участвующих в метастазировании рака и миграции клеток, а также оказывать влияние на регуляцию клеточного цикла. В ряде исследований выявлено, что MALAT1 – одна из первых идентифицированных днРНК, вовлеченных в регуляцию альтернативного сплайсинга, который при нарушении является ключевым фактором, способствующим развитию онкологических процессов. Это обусловливает новое понимание механизмов MALAT1 в регуляции экспрессии генов [23]. В ряде исследований отмечалась повышенная регуляция уровня MALAT1 при раке яичников, молочной железы, шейки матки и эндометрия [18, 19]. Было показано, что уровень экспрессии MALAT1 значительно повышен в эктопических тканях эндометрия по сравнению с эутопическими тканями. Данная днРНК способствует апоптозу клеток эндометрия и оказывает регулирующее действие на экспрессию матриксной металлопротеиназы-9 через путь NF-kB/iNOS, таким образом опосредуя патогенез эндометриоза [16, 24, 25].
Linc-ROR (Long Intergenic Non-Protein Coding RNA, Regulator of Reprogramming) – межгенная небелковая кодирующая РНК; считается ключевым регуляторным фактором, влияющим на возникновение и развитие опухолей человека, включая колоректальный рак, рак молочной железы, рак поджелудочной железы, гепатоцеллюлярную карциному и др. [26]. Последние исследования, касающиеся Linc-ROR и туморогенеза, показали, что сверхрегуляция данной днРНК положительно коррелирует с клинико-патологическими характеристиками и прогрессией опухолей. Их рост и метастазирование стимулируются Linc-ROR посредством активации эпителиально-мезенхимальной трансформации. В одном из исследований выявлена повышенная экспрессия Linc-ROR в эктопическом эндометрии, по сравнению с эутопическим и нормальным эндометрием, что может способствовать пролиферативной активности клеток эндометрия путем активации пути PI3K-Akt [27]. Выявлена связь между экспрессией Linc-ROR, типом и тяжестью дисменореи при аденомиозе [24, 27]. А поскольку Linc-ROR может регулировать пролиферацию, апоптоз, миграцию и инвазию клеток, то тем самым может использоваться в качестве потенциального биомаркера для пациентов с онкологическими заболеваниями и иметь потенциальное клиническое значение в качестве терапевтической мишени [28–30].
В связи с вышеизложенным, выявление не исследованных ранее молекулярно-генетических маркеров эндометриоидных поражений яичников и эндометриоз-ассоциированного рака яичников поможет улучшить понимание в этиологии, глубине инвазии и распространении неопластического процесса, возникновении рецидивов, а также сможет открыть потенциальные перспективы для разработки новых биомаркеров (с дальнейшим прогнозированием лечения и ведения пациентов).
Целью исследования являлось определение уровней экспрессии молекулярно-генетических маркеров MALAT1 и Linc-ROR для повышения диагностики ЭЯ и определения прогностических критериев рецидивирования и возможной неотрансформации.
Материалы и методы
В рамках проведения проспективного исследования были отобраны 80 пациенток с одно- или двусторонними объемными образованиями яичников для планового оперативного лечения. Сформировано 3 группы пациенток: с эндометриоидными кистами яичников (1-я группа, n=30), с аденокарциномами яичников (2-я группа, n=25) и группа пациенток с проведенной биопсией яичника по медицинским показаниям (3-я группа, группа контроля, n=25). 1-я группа пациенток была также подразделена на 2 подгруппы: с впервые выявленным ЭЯ (n=15) и с рецидивирующим ЭЯ (n=15).
Критерии включения для 1-й и 2-й групп: репродуктивный возраст от 18 до 49 лет; гистологически подтвержденный ЭЯ и аденокарцинома яичника соответственно; отсутствие острой гинекологической патологии и значимых патоморфологических нарушений со стороны репродуктивной системы.
Критерии включения для 3-й группы: репродуктивный возраст от 18 до 49 лет; строгие показания к биопсии яичника: наличие пограничных опухолей яичников, согласно проведенному гистологическому исследованию, при которых была произведена биопсия контралатерального яичника (серозные и муцинозные пограничные опухоли); отсутствие острой гинекологической патологии и значимых патоморфологических нарушений со стороны репродуктивной системы.
Критерии исключения: период беременности и лактации; наличие острых воспалительных заболеваний, тяжелой экстрагенитальной патологии в стадии декомпенсации; любые онкологические заболевания в анамнезе и на момент исследования (для 1-й и 3-й групп); наличие других онкологических заболеваний любой локализации в анамнезе или на момент исследования, кроме аденокарциномы яичника (для 2-й группы); наличие любой структурной патологии яичника для группы контроля.
После проведения оперативного лечения (энуклеация кист при эндометриоидных кистах, овариоэктомия при аденокарциноме и биопсия контралатерального яичника) отделяли небольшой участок от полученного материала (0,3–0,5 см) и погружали в стерильную пробирку. В каждый образец добавляли 1 мл раствора тризола с целью ингибирования работы РНКаз и помещали в морозильную камеру на 1 ч. Далее послеоперационный материал был транспортирован для дальнейшего изучения в Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. В лаборатории проводилось выделение тотальной мРНК реагентом ExtractRNA BC032 фирмы «Евроген» по методике производителя, синтез первой цепи кДНК – по протоколу набора MMLV RT SK021 фирмы «Евроген». Уровень экспрессии длинных некодирующих РНК Linc-ROR и MALAT1 определяли методом полимеразной цепной реакции (ПЦР) с обратной транскрипцией в реальном времени с помощью амплификатора LightCycler 96 Real-Time PCR System (Roche) с использованием праймеров, специфичных для 18S, Linc-ROR и MALAT1. ПЦР проводили при предварительной инкубации – 150 с при 95°C, 3-шаговой амплификации – 20 с при 95°C, 20 с при 60°C, 20 с при 72°C – 45 циклов, детекции температуры плавления продуктов реакции.
Нормирование образцов комплементарных ДНК проводилось по контрольному гену рибосомальной 18S РНК. Относительные уровни экспрессии генов Linc-ROR и MALAT1 рассчитывали методом 2-ΔΔCT. Отсутствие побочных продуктов ПЦР определяли по кривой плавления. Для каждой пары праймеров во всех образцах наблюдали одинаковые пики плавления ПЦР каждого образца в 3 повторах. Полученные значения Ct (cycle threshold) для каждого образца не превышали 35.
Статистический анализ
Статистическая обработка полученных данных проводилась с использованием программного обеспечения MS Excel 2016, Jamovi v.2.0, а также с использованием пакета статистических программ IBM SPSS Statistics 22.0. Данные количественных переменных представлялись в виде таблиц, в которых были указаны среднее значение, медиана (Ме), стандартное отклонение, интерквартильный размах (Q1; Q3), минимум (Min) и максимум (Max). Гипотезу о соответствии распределения непрерывных случайных величин нормальному проверяли с помощью критерия Шапиро–Уилка. Для анализа в n>2 независимых группах использовался непараметрический аналог однофакторного дисперсионного анализа – критерий Краскела–Уоллиса. Статистически значимыми считались результаты при р≤0,05. Визуализация количественных переменных проводилась с помощью графиков типа raincloud plot. Для оценки прогностической ценности днРНК использовался ROC-анализ, результаты были представлены в виде значений чувствительности, специфичности, PPV, NPV, индекса Юдена и AUC, визуализировались с помощью ROC-кривых, а также графиков cut-off. Отбор рубежных значений производился на основании индекса Юдена.
Результаты
По результатам анализа днРНК было показано, что сформированные группы статистически значимо отличались по показателям уровней MALAT1 и Linc-ROR. Однако обнаруженные тенденции не были единообразными (таблица). По показателю Linc-ROR выявлено, что по мере прогрессирования заболевания от нормы (группа контроля) до аденокарциномы происходило последовательное повышение и снижение данного маркера (рис. 1). Все исследовательские находки были статистически значимыми (p<0,001).
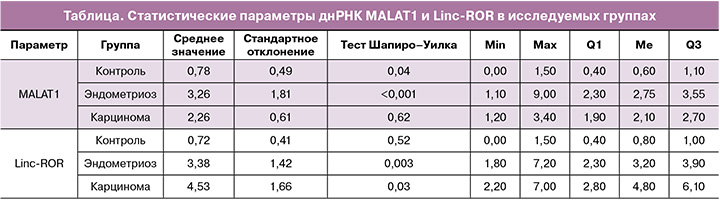
По показателю экспрессии днРНК MALAT1 обнаружено стойкое повышение по мере прогрессирования заболевания (рис. 2).
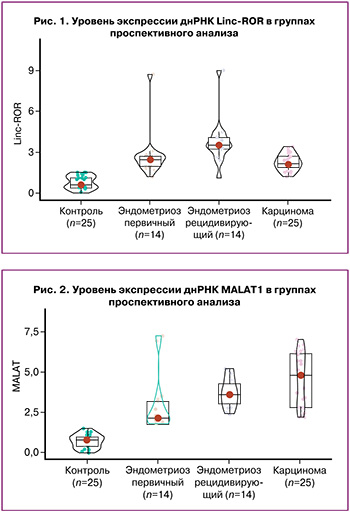
В целях дифференциальной диагностики нормы и ЭЯ, нормы и карциномы были построены ROC-кривые для уровней экспрессии днРНК исследуемых маркеров: для MALAT1 площадь под кривой 98%, для Linc-ROR – 100% (рис. 3, 4).
Также построены ROC-кривые для дифференциальной диагностики ЭЯ и карциномы: для MALAT1 площадь под кривой 27,9%, для Linc-ROR – 70,8% (рис. 5).
По полученным результатам построения ROC-кривых, а также по результатам комплексного статистического анализа в трех исследуемых группах были предложены следующие правила для определения гистологического статуса операционного материала на основе уровня экспрессии днРНК Linc-ROR и MALAT1.
Дифференциальная диагностика между ЭЯ и нормой согласно уровню экспрессии MALAT1: уровень экспрессии MALAT1 равен 1 или меньше – норма; уровень экспрессии равен 1,6 или больше – ЭЯ. Интервал 1,1–1,5 является «серой зоной» (попали 12 испытуемых: 10 из контрольной группы и 2 с эндометриозом – 15% от общего количества пациентов).
Дифференциальная диагностика между ЭЯ и карциномой яичника согласно уровню экспрессии MALAT1: уровень экспрессии MALAT1 равен 1,1 или меньше – норма; уровень экспрессии равен 1,6 или больше – карцинома. Интервал 1,2–1,5 – «серая зона» (попали 10 испытуемых: 6 из контрольной группы и 4 с карциномами – 12,5% от общего количества пациентов).
Дифференциальная диагностика между ЭЯ и нормой согласно уровню экспрессии Linc-ROR: уровень экспрессии Linc-ROR равен 1,5 или меньше – норма, если больше – ЭЯ.
Дифференциальная диагностика между ЭЯ и карциномой яичника согласно уровню экспрессии Linc-ROR: уровень экспрессии Linc-ROR равен 1,5 или меньше – норма, если 2,2 и больше – карцинома.
Таким образом, для показателей экспрессии Linc-ROR и MALAT1 достаточно любого из них, чтобы отличить норму от патологии, а для дифференциальной диагностики карциномы и ЭЯ необходимо строить многофакторную модель.
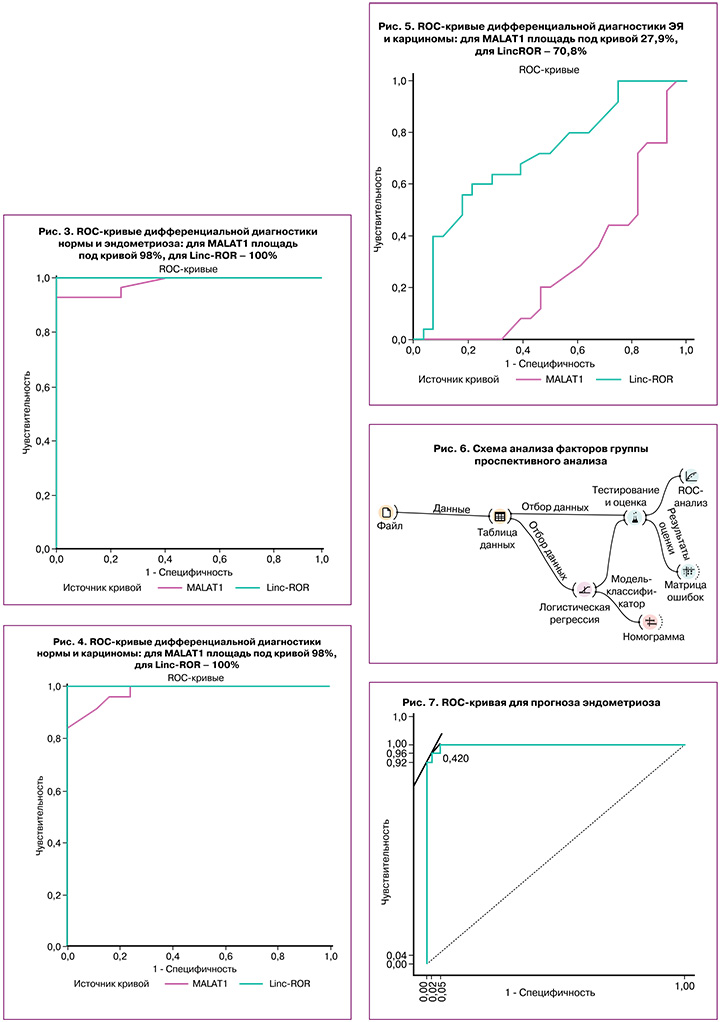
Анализ возможного использования факторов, характеризующих группу проспективного анализа и показавших значимые различия при сравнении подгрупп контроля, ЭЯ и аденокарциномы яичников, для прогностических целей был выполнен с помощью логистической регрессии (рис. 6).
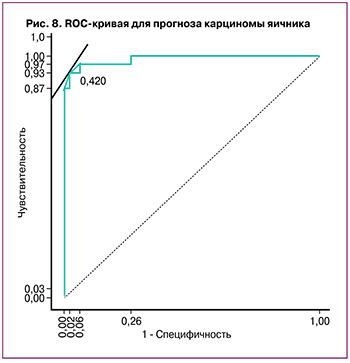
По результатам анализа также было показано, что предсказательная способность модели логистической регрессии высока и близка к абсолютной AUC=0,995 (рис. 7, 8).
Заключение
В рамках проведенного исследования, в ходе которого определялись уровни экспрессии маркеров днРНК MALAT1 и Linc-ROR в группах эндометриоза, аденокарциномы и группе контроля, предположена потенциальная возможность оценки их вклада в прогноз данных состояний. Выявлено, что уровень экспрессии данных днРНК статистически значимо отличался в указанных исследуемых группах. Определено, что экспрессия MALAT1 имеет тенденцию к постепенному повышению от группы контроля с условно интактной тканью яичника по сравнению с группой ЭЯ. Следует отметить, что выявленные изменения более выражены у пациенток при сочетании ЭЯ с внутренним эндометриозом и миомой матки, возникновение которых тесно коррелирует с эпителиально-мезенхимальным переходом. Наиболее высокий уровень наблюдался в группе с аденокарциномой яичника. Также выявлено последовательное повышение уровня экспрессии Linc-ROR в исследуемых группах пациентов от группы контроля до группы с рецидивирующими формами ЭЯ соответственно, где определялся наиболее высокий уровень экспрессии по сравнению с группой пациенток с аденокарциномами яичников, среди которых наблюдалось снижение данного показателя.
В дальнейшем требуется проведение прицельных научных исследований в данном направлении с целью разработки новых прогностических маркеров эндометрий-ассоциированного рака яичников и поиска дополнительных терапевтических мишеней.



