Эндометриоидные кисты яичников (ЭКЯ) – одно из распространенных доброкачественных новообразований у женщин репродуктивного возраста [1]. В рамках преодоления бесплодия ЭКЯ всегда представляли проблему выбора тактики ведения. Частота бесплодия у пациенток с ЭКЯ высока, и, по результатам ряда исследователей, женщины с данной патологией имеют на 24–45% меньшую вероятность живорождения по сравнению с женщинами с неустановленными причинами бесплодия в программах вспомогательных репродуктивных технологий (ВРТ) (отношение шансов (ОШ) 0,76 (95% доверительный интервал (ДИ) 0,59–0,98), р=0,035) [2, 3].
На сегодняшний день существует несколько взглядов на тактику ведения пациенток с бесплодием и ЭКЯ. Неоднозначность подходов к выбору тактики при лечении бесплодия у женщин с ЭКЯ определяется многими аспектами, среди которых наиболее важными являются сохранность и качество овариального резерва и состояние эндометрия, его готовность к полноценному формированию ранней плаценты и функциональной системы «мать-плацента-плод» [1, 3]. Один из подходов включает оперативное лечение лапароскопическим доступом, особенно в случаях, связанных с болевым синдромом и кистами большого диаметра, с последующим ожиданием наступления спонтанной беременности, а при отсутствии таковой –введением пациенток в циклы вспомогательных репродуктивных технологий (ВРТ) [4]. Однако вопрос о том, снижает ли хирургическое вмешательство на яичниках овариальный резерв и их чувствительность к стимуляции овуляции, все еще остается спорным. В ряде исследований показано, что ЭКЯ не повреждают овариальный резерв и редко ухудшают качество ооцитов [5, 6]. Другие исследования доказывают, что наличие ЭКЯ значимо влияет на метаболизм железа и активность ферментов в фолликулярной жидкости, увеличивает количество свободных радикалов кислорода и приводит к ухудшению качества яйцеклеток [7]. В работах [6, 8] отмечается связь между размерами эндометриом и состоянием овариального резерва, что практически не учитывается при подготовке к операциям на яичниках. При этом бережное удаление ЭКЯ может повысить эффективность программ ВРТ [4, 5]. Однако в других исследованиях подтверждена противоположная точка зрения; авторы обнаружили, что цистэктомия по поводу ЭКЯ может нарушить реакцию яичников на контролируемую гиперстимуляцию яичников в циклах ВРТ и значительно снизить овариальный резерв [9]. В настоящее время при ЭКЯ III–IV стадии оперативное лечение является необходимым этапом для восстановления анатомии органов, после которого в случае сохранения бесплодия рекомендуется решать вопрос о применении ВРТ [8]. В отдельных научных работах представлены убедительные данные о позитивном влиянии на овариальный резерв и рецептивность эндометрия адъювантной гормональной терапии после оперативного вмешательства, направленной на торможение прогрессирования эндометриоидного процесса и профилактику рецидивов [10, 11]. В доступной литературе отсутствует единый алгоритм ведения пациенток с ЭКЯ тяжелых стадий в плане рекомендованного ожидания спонтанной беременности и сроков введения в циклы ВРТ, а также отсутствует широкая доказательная база по методам сохранения овариального резерва и рецепторной чувствительности эутопического эндометрия на этапах подготовки к желанной беременности.
Для объективизации влияния хирургического лечения ЭКЯ на овариальный резерв, совершенствования подходов к овариопротекции и подготовке эндометрия к беременности, разработки программы ведения пациенток с эндометриозом яичников тяжелых стадий и бесплодием нами проведено проспективное исследование.
Цель исследования: на основе клинической картины, состояния эндометрия и показателей овариального резерва разработать персонифицированный подход к ведению пациенток с бесплодием и эндометриозом яичников III–IV стадии.
Материалы и методы
Проспективное исследование включало комплексное клинико-лабораторное обследование и лечение 147 женщин с бесплодием и эндометриозом яичников III–IV стадии. В I группу вошли 49 пациенток, которым для преодоления бесплодия на первом этапе проводилось оперативное лечение по поводу эндометриоза яичников III–IV cтадии. Оперативное лечение заключалось в лапароскопическом вылущивании кист яичников с сопутствующей каутеризацией видимых очагов эндометриоза и адгезиолизисом. После 6 месяцев выжидательной тактики в отношении спонтанной беременности пациентки, у которых беременность не наступала, направлялись на лечение бесплодия методами ВРТ, что соответствует действующему клиническому протоколу [1]. II группу составили 98 пациенток с бесплодием вследствие ЭКЯ III–IV cтадии. Все пациентки с целью уменьшения предоперационного размера ЭКЯ, выраженности болевого синдрома и максимального сохранения овариального резерва на первом этапе – предоперационной подготовки – получали лечение агонистом гонадотропин-рилизинг-гормона (аГнРГ) (бусерелин по 3,75 мг внутримышечно, однократно, каждые 4 недели, начиная в первые пять дней менструального цикла) в течение 3 месяцев или синтетическими прогестагенами (диеногест по 2 мг, ежедневно, перорально) – не менее 4–5 месяцев. До операции аГнРГ получили 43,9% (43/98) пациенток с выраженным болевым синдромом, диеногест – 56,1% (55/98) с умеренно и слабо выраженным болевым синдромом. После проведенного хирургического лечения пациентки II группы были разделены на три подгруппы в зависимости от овариального резерва и рецепторной активности эутопического эндометрия, что определяло персонифицированную тактику ведения. Подгруппу IIА составили 40 пациенток со сниженным овариальным резервом (уровни антимюллерова гормона (АМГ) не ниже 0,5 и фолликулостимулирующего гормона (ФСГ) не более 10 МЕ/мл) и сохранной рецепторной активностью эутопического эндометрия, у которых была выбрана выжидательная тактика в отношении спонтанной беременности. Данным пациенткам в послеоперационном периоде был назначен дидрогестерон в циклическом режиме с целью поддержки II фазы менструально-овариального цикла (в дозе 10 мг 3 раза в день с 11-го по 25-й дни цикла). При наступлении беременности назначение препарата пролонгировалось с целью снижения риска спонтанного выкидыша. При отсутствии беременности в течение 6 месяцев для лечения бесплодия применялись ВРТ. В группу IIB вошли 43 пациентки также с умеренно сниженным овариальным резервом, но нарушенной рецептивностью эндометрия. Пациентки этой группы после проведенного оперативного лечения получали комплексную терапию, включающую назначение диеногеста по 2 мг ежедневно, 3–4 месяца с целью повышения рецепторной чувствительности эндометрия и блокирования прогрессирования эндометриоза; нестероидные противовоспалительные средства (НПВС) – диклофенак 200 мг ежедневно, ректально, до 1 месяца приема с целью коррекции провоспалительного статуса; для улучшения лимфо- и микроциркуляции, проводимости нервных импульсов, купирования болевого синдрома, уменьшения стресса и выраженности психосоматических реакций с 5-го дня после операции ежедневно в количестве 10 процедур назначалось физиотерапевтическое лечение на аппарате «Андрогин» (удостоверение ФСР №2008/02913 от 05.06.2008, РФ), сочетающее полостную магнитотерапию, центральную цветоритмотерапию, короткоимпульсную электроаналгезию (чрескожную электронейростимуляцию) [12]. Пациентки, у которых в течение 6 месяцев после проведенного послеоперационного комплексного лечения отсутствовала спонтанная беременность, направлялись на лечение бесплодия методами ВРТ. Группу IIС составили 15 пациенток с критически сниженным овариальным резервом после проведенного оперативного лечения (АМГ ниже 0,5 нг/мл) и с нормальной/сниженной рецепторной функцией эутопического эндометрия, направленные на лечение бесплодия методом ВРТ с донацией ооцитов. В контрольную, III группу вошли 35 здоровых женщин с интактными яичниками и бесплодием вследствие мужского фактора, получавших лечение методами ВРТ. Стимуляция овуляции в циклах ЭКО проводилась по стандартной методике с помощью длинного протокола стимуляции аГнРГ.
Критерии включения в I и II группы: подтвержденный гистологически диагноз впервые выявленных ЭКЯ, репродуктивный возраст до 35 лет, впервые выполненное оперативное лечение эндометриоза яичников, согласие на участие в исследовании и обработку данных. Критерии исключения из исследования: наличие ожирения и сопутствующей тяжелой соматической патологии, аутоиммунные заболевания, инфекции, передающиеся половым путем (ИППП), хронический эндометрит, тяжелый мужской фактор бесплодия (азооспермия, требующая пункции яичка), а также выявленные при опросе пациенток нарушения назначенной схемы лечения.
Обследование пациенток проводилось на этапе постановки диагноза и уточнения причины бесплодия перед операцией (I группа) или предоперационным гормональным лечением (II группа), на 3-и сутки после хирургического этапа лечения и перед программой ВРТ. У всех женщин собирали анамнез с оценкой жалоб и менструальной функции; при наличии жалоб болевой синдром оценивали по визуально-аналоговой шкале оценки боли (ВАШ, где 0 – полное отсутствие болевого синдрома, 1–2 балла – слабая боль, 3–5 – умеренная, 6 и более – выраженная [1]). По результатам оперативного вмешательства проводился подсчет индекса фертильности в исследуемых группах [4]. В динамике наблюдения всем пациенткам выполнялось ультразвуковое исследование малого таза с допплерографией (Philips Affinity 70, США) и подсчетом количества антральных фолликулов (КАФ) с учетом рекомендаций С.Г. Хачкузова [13]. У каждой пациентки методами иммуноферментного анализа, хемилюминесцентного иммуноанализа на аппаратуре Architect (Abbott, Англия) до 7-го дня менструального цикла определялись: онкомаркеры – СА-125, НЕ-4 с расчетом индекса риска озлокачествления новообразований яичников (индекс ROMA) [1]; гормоны крови – лютеинизирующий гормон (ЛГ), ФСГ, тиреотропный гормон (ТТГ), пролактин, АМГ, эстрадиол; во вторую фазу цикла (19–23 дни): прогестерон, цитокины: интерлейкин (ИЛ)-1β, ИЛ-6 в венозной крови, альфа-2-микроглобулин фертильности (гликоделин) в менструальной крови, проводилась пайпель-биопсия эндометрия с целью гистологической и иммуногистохимической оценки его состояния, исключения хронического эндометрита. Экспрессия рецепторов эстрогена (РЭ) и прогестерона (РП) в образцах эндометрия (тест-система Biocare, Германия) определялась моноклональными антителами к эстрогенам (клон SP1, IgG изотип) и прогестерону (клон PGR 16, IgG1 изотип). Подсчет клеток, осуществляющих экспрессию РЭ и РП, проводился по Г.А. Франку и соавт. [14]. Анализ отделяемого влагалища и цервикального канала на ИППП и микрофлору проводился методом полимеразной цепной реакции с детекцией в режиме «реального времени».
Статистический анализ
Статистическая обработка осуществлялась при помощи программы IBM SPSS Statistics 25 PS, лицензия № 5725-А54. Проверку соответствия нормальному закону осуществляли по критериям Шапиро–Уилка и Колмогорова–Смирнова. Для показателей с распределением, близким к нормальному, вычислялись средняя арифметическая величина (М) и стандартное отклонение (SD), статистическая значимость различий определялась однофакторным дисперсионным анализом (ANOVA). Равенство дисперсий в сравниваемых группах выполняли по критерию Ливеня. В случае отклонения нулевой гипотезы об отсутствии различий в сравниваемых группах проводили апостериорные сравнения по критерию Тьюки. При отклонении от нормального распределения показателей вычислялась медиана (Ме) с межквартильным интервалом [25 квартиль (Q1)–75 квартиль (Q3)], для определения статистических различий применялся ранговый дисперсионный анализ Краскела–Уоллиса с последующими межгрупповыми сравнениями по критерию U Манна–Уитни с поправкой Бонферрони. Критическое значение уровня значимости (p) принимали с учетом метода применяемой статистики p<0,05. При использовании поправки Бонферрони для попарного сравнения 4 групп число пар сравнений равно 6, и новый критический уровень соответствовал р<0,008; для попарного сравнения 3 групп число пар сравнений равно 3, и новый критический уровень соответствовал р<0,017. Для сравнения зависимых групп (до и после лечения) применяли парный критерий Вилкоксона. Качественные показатели представлены как в абсолютных, так и относительных величинах. Для расчета статистической значимости различий качественных признаков применяли критерий χ² Пирсона, в случае четырехпольной таблицы – с поправкой Йейтса. Для исследования взаимосвязей применяли корреляционный анализ Спирмена. Обоснование размера выборки проводили по номограмме Альтмана, с учетом данных предварительного исследования. При заданных параметрах для обеспечения мощности исследования в 80%, считая клинически значимым увеличение частоты родов живым плодом на 30%, достаточная численность групп будет от 34 наблюдений. Эффективность персонифицированного лечения оценивалась показателями размера эффекта терапевтического вмешательства: ЧИЛ – частота исходов лечения с учетом наступления беременности и родов живым плодом; ЧИК – частота исходов лечения в I группе; ОР – относительный риск; ПОП – повышение относительной пользы; ПАП – повышение абсолютной пользы; ЧБНЛ – число больных, которым необходимо проводить лечение, чтобы предотвратить неблагоприятный исход у одного пациента. Рассчитывался 95% доверительный интервал (95% ДИ) [15, 16].
Результаты и обсуждение
Медико-социальная характеристика и интраоперационные данные женщин групп сравнения представлены в таблице 1. На этапе включения в проспективное исследование, которое с учетом продолжительности беременности длилось до 22 месяцев, пациентки групп сравнения не имели различий по возрасту, продолжительности бесплодия и паритету, социальному положению, индексу массы тела (ИМТ), функциональному статусу щитовидной железы и уровням пролактина. Пациентки I и II групп не отличались по клиническим данным, выраженности болевого синдрома, исходным размерам ЭКЯ, толщине эндометрия, концентрации гликоделина, интерлейкинов, характеристикам овариального резерва (КАФ, ФСГ, АМГ, эстрадиолу), уровням онкомаркеров и индексу ROMA. Указанные характеристики имели значимые отличия по сравнению с III группой контроля (р<0,001).
После проведенной пайпель-биопсии эндометрия не найдено статистически значимых различий в уровнях экспрессии РП и РЭ железами и стромой эутопического эндометрия пациенток сравниваемых групп с ЭКЯ (рI-II>0,05). При сопоставлении уровней экспрессии рецепторов в эндометрии женщин группы контроля отмечена статистически значимая большая экспрессия РЭ и РП как в строме, так и в железах по сравнению с аналогичными рецепторами в эндометрии пациенток, cтрадающих ЭКЯ тяжелых стадий и бесплодием (p<0,001) (табл. 1).
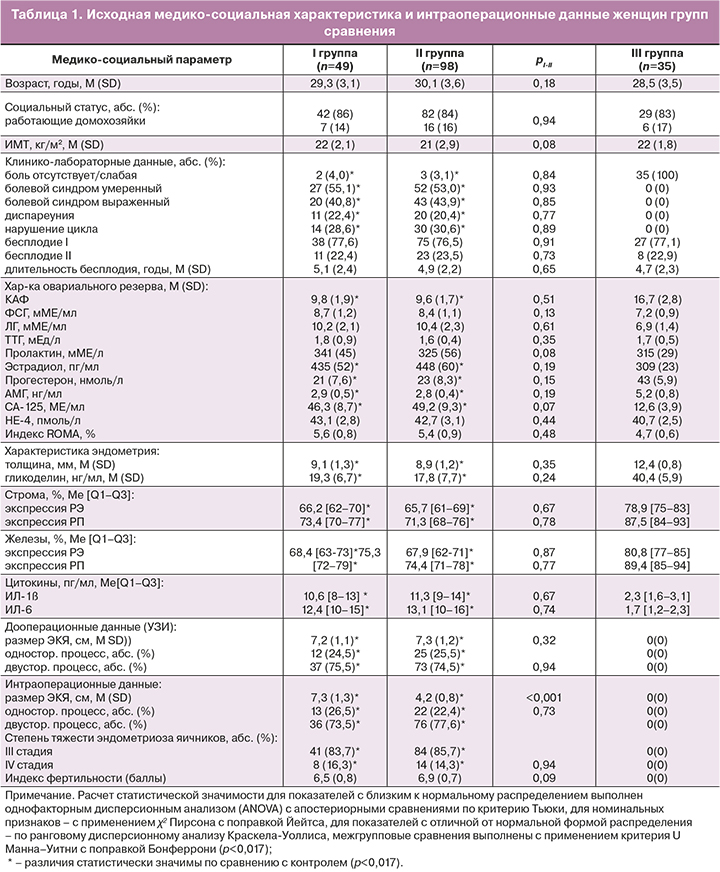
Согласно интраоперационным данным, во II группе исследования отмечено уменьшение среднего размера ЭКЯ по сравнению с исходными ультразвуковыми данными до начала гормонального лечения – с 7,3 (1,2) см до 4,2 (0,8) cм, что статистически значимо отличалось от полученных интраоперационных размеров кист в I группе без дооперационного гормонального лечения (4,2 (0,8) см против 7,3 (1,3) см, р<0,001). Степень тяжести эндометриоза, одно- либо двусторонняя локализация ЭКЯ не имели межгрупповых статистических различий (табл. 1), равно как и расчет индекса фертильности с учетом интраоперационных и анамнестических данных не показал статистически значимых отличий в I и II группах – 6,5 (0,8) балла и 6,9 (0,7) балла (р=0,09). Значения индекса фертильности свидетельствуют о возможности наступления спонтанной беременности у женщин групп сравнения с вероятностью 40% [1, 4].
Данные обследования пациенток I группы и IIА, IIВ, IIС подгрупп II группы сравнения после оперативного лечения представлены в таблице 2.
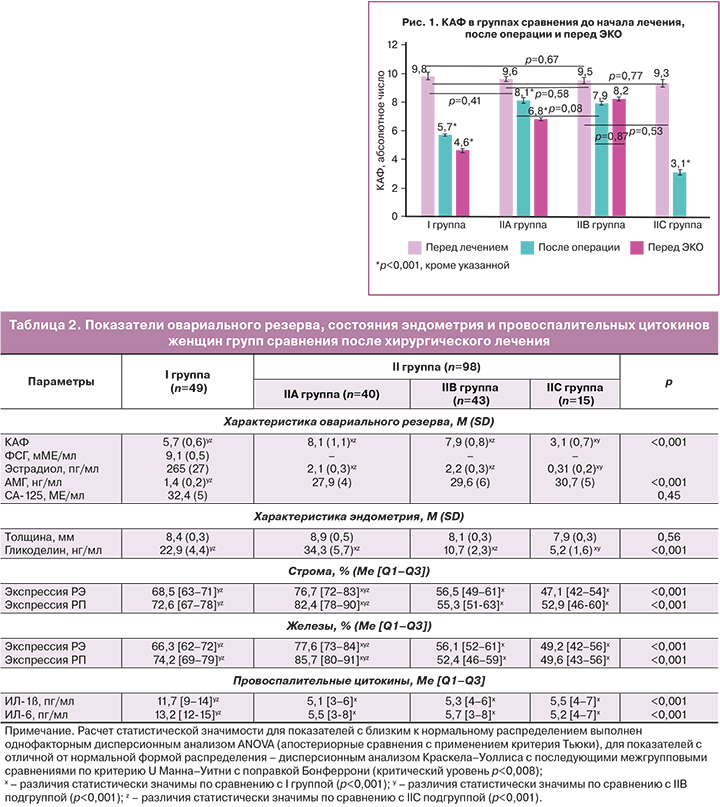
В I группе после проведенного оперативного лечения отмечено статистически значимое повышение уровня ФСГ и снижение содержания эстрадиола по сравнению с исходными параметрами (р=0,04 и р=0,03 соответственно), что обусловлено агрессивным влиянием оперативного вмешательства на яичниках на овариальный резерв (снижение КАФ с 9,8 (1,9) до 5,7 (0,6), p<0,001, и уровня АМГ с 2,9 (0,5) нг/мл до 1,4 (0,2) нг/мл, p<0,001). Внутригрупповая динамика и межгрупповые сравнения показателя КАФ представлены на рисунке 1.
Полученные данные о негативном влиянии на овариальный резерв оперативного лечения ЭКЯ III–IV стадии послужили основой для персонифицированного подхода к ведению пациенток II группы в плане достижения желанной беременности. Пациентки IIС подгруппы с резко сниженным овариальным резервом сразу были направлены на лечение методами ВРТ с применением донации ооцитов. Всего во II группе женщин с критическим овариальным резервом, потребовавшим лечения методом ВРТ с донацией ооцитов, несмотря на проведенное предоперационное гормональное лечение, было 15 из 98 пациенток, что составило 15,3%. Данная частота применения ургентных ВРТ во II группе была сопоставима с I группой, где донация ооцитов была выполнена 8 пациенткам из 49, что составило 16,3% (pI-IIС=0,79). Пациентки IIВ подгруппы (43/98 – 43,9%) с умеренно сниженным овариальным резервом и сниженной рецептивностью эндометрия (для РЭ стромы и желез pIIВ-III<0,001; для РП стромы и желез pIIВ-III<0,001; для толщины эндометрия pIIВ-III=0,01) получали комплексное послеоперационное лечение с последующей спонтанной беременностью, при отсутствии которой преодоление бесплодия осуществлялось методом ЭКО. Пациентки IIА подгруппы (40/98 – 40,8%), также с умеренно сниженным овариальным резервом, но с нормальной рецептивностью эндометрия (для РЭ стромы pIIА-III=0,86, желез pIIА-III=0,92; для РП стромы pIIА-III=0,79, желез pIIА-III=0,84) были отправлены для достижения спонтанной беременности, при ее отсутствии – направлены на лечение методом ЭКО. Характеристики пациенток I группы и подгрупп II группы перед попыткой ЭКО представлены в таблице 3.

Сопоставляя полученные данные об овариальном резерве при ЭКЯ тяжелых стадий с результатами исследований других авторов [16], становится очевидным, что актуальной и своевременной является постановка вопроса об эффективной овариопротекции. В ряде работ убедительно показано, что бесплодие у больных с ЭКЯ может быть обусловлено измененным фолликулогенезом, сниженным преовуляторным стероидогенезом гранулезных клеток, активацией иммунного ответа против фолликулов [17]. Следовательно, сохранение максимально возможного овариального резерва в ходе лечения бесплодия – залог достижения результата по наступлению и вынашиванию беременности.
Хорошо известно, что эутопический эндометрий у женщин с эндометриозом проявляет аберрантную экспрессию генов половых стероидов. Усиленная секреция прогестерона после овуляции необходима для снижения регуляции генов, связанных с репликацией ДНК, – механизма, благодаря которому пролиферация эндометрия быстро прекращается в ранней секреторной фазе [18]. Неполная секреция эндометрия и неспособность подавлять гены клеточного цикла, вероятно, являются ключевыми факторами нарушения имплантации, что все чаще признается при эндометриоз-ассоциированном бесплодии [17]. Предполагаемые характеристики окна имплантации включают повышенную регуляцию генов-мишеней прогестерона, которые облегчают прикрепление эмбриона и регулируют местный иммунный ответ. При этом широко известно, что гликоделин – иммуномодулятор, регулируемый прогестероном, понижается во время окна имплантации у пациентов с ЭКЯ [8]. Нарушение секреторной трансформации клеток эндометрия при ЭКЯ дополнительно подтверждается полученными в ходе исследования данными по уровню α-2 микроглобулина фертильности (р<0,001), снижением экспрессии РЭ и РП как в стромальном, так и железистом компоненте эутопического эндометрия у пациенток с тяжелыми формами ЭКЯ по сравнению с группой контроля (р<0,001).
Точный механизм резистентности к прогестерону при эндометриозе остается неясным. Однако доказано, что снижение уровня прогестерона приводит к увеличению местных провоспалительных цитокинов, хемокинов, которые препятствуют биологической беременности, активируют разрушение тканей и менструацию. Противовоспалительные свойства прогестерона в клетках матки хорошо изучены [11, 17]. Несомненно, сами цитокины также играют важную роль в формировании резистентности к прогестерону. Фактор некроза опухоли (ФНОα), ИЛ-6, ИЛ-1ß непосредственно снижают уровни обеих изоформ РП, возможно, через эпигенетические модификации [18]. Полученные данные по содержанию цитокинов в динамике проспективного наблюдения за пациентками I группы и подгрупп II группы с ЭКЯ тяжелых стадий представлены в таблицах 1–3 и на рисунке 2.

Корреляционный анализ между показателями овариального резерва (КАФ, АМГ, ФСГ), рецептивностью эндометрия (толщина, РЭ, РП, гликоделин) и концентрацией ИЛ-1ß, ИЛ-6 показал отрицательную сильную связь в I группе (r от 0,84 до 0,9, при p<0,001) и положительную связь средней силы во IIА и IIВ подгруппах (r от 0,72 до 0,79, при p<0,001), что подтверждает положение о тесной связи иммунологического и гормонального контуров в регуляции состояния репродуктивной системы [19, 20].
Женские репродуктивные органы иннервируются симпатическими, парасимпатическими и сенсорными афферентными нервами. Их распределение и иммунореактивность к различным пептидам указывают на роль в гемодинамике и сокращении гладкой мускулатуры. В матке пациенток с тяжелыми формами ЭКЯ, с выраженной хронической тазовой болью, наблюдается повышенное количество нервных волокон и периваскулярная пролиферация нервных волокон [10]. Кроме того, небольшие нервные волокна были обнаружены в функциональном слое эутопического эндометрия у больных эндометриозом, но не в контроле [8]. Клинические симптомы эндометриоза варьируются от тяжелой дисменореи, диспареунии, дизурии до тяжелой хронической тазовой боли; очевидно, что болезнь серьезно влияет на качество жизни пациентов, их социальную жизнь, сексуальность и психологическое благополучие. Это послужило патогенетическим обоснованием применения персонифицированного подхода к ведению пациенток с эндометриозом яичников III–IV стадии и бесплодием.
При сравнении параметров, влияющих на результат лечения бесплодия в исследуемых группах, нами выявлены следующие закономерности. При оценке овариального резерва в I группе выявлены статистически значимые отличия на каждом этапе обследования при оценке КАФ и АМГ, что подтверждает альтерацию овариального резерва вследствие операционной травмы. При этом в IIА и IIВ подгруппах нами не выявлено значимых отличий по уровню КАФ и АМГ после операции, по сравнению с исходными уровнями (для IIА подгруппы – 8,1 (1,3) против 9,6 (1,7), р=0,08, и 2,1 (0,3)нг/мл против 2,8 (0,4) нг/мл, p=0,13; для IIВ – 7,9 (0,8) против 9,6 (1,7), р=0,06, и 2,2 (0,3) нг/мл против 2,8 (0,4) нг/мл, p=0,11, соответственно), что объясняется овариопротективным действием назначенного предоперационного гормонального лечения аГнРГ или диеногестом. Помимо этого, уровень КАФ в подгруппе IIВ, в отличие от IIА подгруппы, в результате комплексного лечения перед ЭКО был стабильным в сравнении с послеоперационными данными (8,2 (0,8) и 7,9 (0,8), р=0,87), а уровень АМГ даже выше (2,5 (0,4) нг/мл и 2,2 (0,3) нг/мл, p=0,06), что, несомненно, связано с количественной и качественной сохранностью овариального резерва, противовоспалительным эффектом, повышением чувствительности к прогестерону, блокированием прогрессирования эндометриоза, улучшением лимфо- и микроциркуляции, проводимости нервных импульсов, антиноцицептивным, антистрессовым механизмами комплексного лечения с применением нестероидных противовоспалительных средств, диеногеста, полостной магнитотерапии, центральной цветоритмотерапии, чрескожной электронейростимуляции.
При оценке толщины эндометрия выявлены значимые отличия, как при межгрупповых сравнениях, так и внутри исследуемых групп. Толщина эндометрия после оперативного лечения не различалась в подгруппе IIВ и IIС (р=0,06) и была статистически ниже толщины эндометрия в подгруппе IIA (р=0,01), что подтверждается эффективной дооперационной гормональной коррекцией экспрессии рецепторов эндометрия в этой подгруппе. При этом толщина эндометрия статистически значимо выросла в IIА и IIВ подгруппах перед ЭКО (p=0,01 и p<0,001, соответственно), что обусловлено поддержкой дидрогестерона второй фазы менструально-овариального цикла у женщин IIА подгруппы и влиянием на эндометрий диеногеста у женщин IIВ подгруппы.
На фоне этапного персонифицированного лечения (дооперационная гормональная терапия, послеоперационное гормональное лечение во IIА подгруппе и комплексное лечение во IIВ подгруппе) уровень провоспалительных цитокинов статистически значимо снижался у пациенток II группы и сохранился стабильно низким перед проведением ЭКО (рис. 1).
Параметры протоколов и исходы ЭКО в группах представлены в таблице 4.
Частота спонтанных беременностей у женщин I группы после хирургического этапа в течение 6 месяцев составила лишь 2% (1/49), что можно объяснить негативным влиянием операционной травмы на овариальный резерв и недостаточной рецептивностью эндометрия. По результатам послеоперационной оценки овариального резерва у 8 (8/49 – 16,3%) пациенток применены ВРТ с донацией ооцитов с благоприятным перинатальным исходом (роды живым плодом). Из 40 женщин, вступивших в программу ЭКО, беременность имела место у 7 (17,5%) пациенток, из них у 3 (3/7 – 42,9%) произошел спонтанный выкидыш, у 4 (4/40 – 10%) – беременность закончилась рождением живого ребенка. В целом, в I группе частота наступления беременности составила 32,7% (16/49), за исключением ЭКО с применением донации ооцитов – 19,5% (8/41), роды живым плодом произошли у 26,5% (13/49), без ЭКО с донацией ооцитов – у 12,5% (5/41) женщин.
Во IIА подгруппе (n=40) после дооперационной гормональной терапии, хирургического лечения ЭКЯ, на фоне циклического применения дидрогестерона в течение 6 месяцев спонтанная беременность наступила у 12,5% (5/40) женщин. В программу ЭКО вступило 35 женщин, из которых беременность имела место у 8 (22,9%), из них выкидыш – у 1 (1/8 – 12,5%) пациентки, роды живым плодом – у 7 (7/35 – 20%) пациенток. Всего беременности во IIА подгруппе наступили у 32,5% (13/40) женщин, роды живым плодом произошли у 30% (12/40) пациенток.
Во IIВ подгруппе (n=43) после дооперационного гормонального лечения, хирургического и комплексного этапов спонтанная беременность в течение 6-8 месяцев наступила у 18,6% (8/43) женщин. В программу ВРТ вступило 35 женщин: беременность имела место у 12 (12/35 – 34,3%) пациенток, из них выкидыш произошел у 2 (2/12 – 16,7%), роды живым плодом произошли у 10 (10/35 – 28,6%). Всего беременности во IIВ подгруппе наступили у 46,5% (20/43) женщин, роды живым плодом состоялись у 41,9% (18/43) пациенток.
Во IIС подгруппе всем 15 пациенткам с критическим овариальным резервом проведено ЭКО с донацией ооцитов с благоприятным перинатальным исходом.
В общей сложности во II группе частота наступления беременности составила 48,9% (48/98), за исключением ЭКО с применением донации ооцитов – 39,8% (33/83), роды живым плодом произошли у 45,9% (45/98), без ЭКО с применением донации ооцитов – у 36,1% (30/83) женщин.
В III контрольной группе из 35 женщин (показание к ВРТ – мужской фактор) частота наступления беременности составила 57,1% (20/35), роды живым плодом наблюдались у 51,4% (18/35) пациенток.
Следовательно, эффективность лечения бесплодия у пациенток с тяжелыми формами ЭКЯ II группы с дифференцированным персонифицированным ведением была выше, по сравнению с I группой пациенток без индивидуального подхода к тактике преодоления бесплодия. Так, частота наступления беременности во II группе была в 1,5 раза выше (за исключением женщин с донацией ооцитов – в 2 раза), родов живым плодом – в 1,7 раза выше (за исключением женщин с донацией ооцитов – в 2,9 раза).
Для расчета эффекта лечебного вмешательства учитывались исходы лечения бесплодия у пациенток II и I групп сравнения с ЭКЯ III–IV стадии, за исключением женщин, сразу направленных на ЭКО с донацией ооцитов в связи с критическим уровнем овариального резерва: количество пациенток с подтвержденной беременностью составило 33 и 8, беременность не наступила у 50 и 33, роды живым плодом произошли у 30 и 5, живорождение отсутствовало у 53 и 36, всего пациенток в группах составило 83 и 41 – соответственно указанным группам.
Ключевые показатели эффекта лечебного вмешательства во II группе с дифференцированным подходом к ведению пациенток с ЭКЯ III–IV стадии по сравнению с I группой без персонализированного подхода к ведению пациенток с данной патологией представлены в таблице 5.
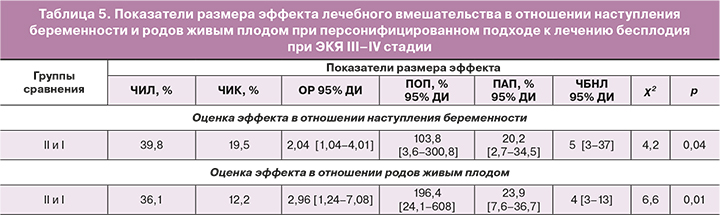
Показатель ЧБНЛ свидетельствует о том, что при дифференцированном подходе к ведению пациенток с тяжелыми формами ЭКЯ, по сравнению с отсутствием персонализированного подхода, наступление беременности результативнее у каждой 5 женщины, а достижение рождения живого ребенка результативнее у каждой 4-й женщины. Показатель ОР, свидетельствующий об отношении частот беременности в каждой группе, показывает, что при персонифицированном подходе беременность наступает в 2,04 раза чаще и роды живым плодом наступают в 2,96 раза чаще, чем при отсутствии дифференцированного ведения пациенток с ЭКЯ тяжелых стадий. Абсолютная польза проведенного лечения – частота беременности на 20,2% и родов живым плодом на 23,9% – выше во II группе; следовательно, шанс родить живого ребенка у пациенток II группы выше, чем в I. Исходя из полученных показателей размера эффекта лечебного вмешательства, можно констатировать значимый эффект от персонифицированных лечебных мероприятий во II группе.
Обсуждаемые по результатам метаанализов и отдельных исследований различные подходы к тактике лечения бесплодия при ЭКЯ объективны, так как данная группа пациенток гетерогенна; при этом результативность преодоления бесплодия зависит от ряда индивидуальных факторов: возраста, клинического течения заболевания, размера ЭКЯ, одно- или двусторонности поражения яичников, количественных и качественных характеристик овариального резерва, состояния рецептивности эндометрия, сопутствующей коморбидной патологии, наличия оперативных вмешательств на яичнике в анамнезе, частоты рецидивов и др. [1, 3]. В настоящее время существуют различные направления в лечении бесплодия при эндометриозе яичников: хирургический или гормональный методы с последующим ожиданием спонтанной беременности, хирургический метод с адъювантным гормональным лечением или гормональной поддержкой цикла и последующим ожиданием спонтанной беременности, стартовые/ургентные ВРТ, индивидуальный подбор различных протоколов ЭКО, применение протоколов стимуляции овуляции с криоконсервацией эмбрионов, другие варианты ВРТ. ЭКЯ и особенно эндометриоз яичников III–IV стадии – сложная терапевтическая проблема, как в отношении прогрессирования заболевания, противорецидивного лечения, так и в плане преодоления бесплодия [4, 6, 8, 10, 11]. Отсутствие определенного алгоритма ведения пациенток с нереализованной репродуктивной функцией и ЭКЯ тяжелых стадий обусловлено как индивидуальными факторами риска, так и оптимальностью применения хирургических и репродуктивных подходов.
Заключение
Предлагаемый дифференцированный подход к ведению пациенток с ЭКЯ III–IV стадии обуславливает персонификацию тактики в зависимости от клинического течения заболевания, овариального резерва, состояния эндометрия.
Результаты проспективного исследования, в ходе которого проведен сравнительный анализ эффективности преодоления бесплодия у женщин с ЭКЯ III–IV стадии различными подходами, показали более высокую частоту наступления беременности (в 2 раза) и родов живым плодом (в 2,9 раза) при дифференцированным персонифицированным ведении пациенток по разработанному алгоритму, по сравнению с пациентками без индивидуального подхода к тактике преодоления бесплодия. Полученные данные объективизируют рациональность тактики ведения пациенток с тяжелыми формами эндометриоза яичников и инфертильностью, оптимизируют возможность реализации репродуктивной функции у данного контингента женщин.



