Антенатальные потери остаются актуальной, социально значимой и недостаточно изученной проблемой [1–3]. Причины антенатальной гибели плода многообразны и включают гипоксию, врожденные пороки развития у плода, внутриутробную инфекцию, диабетическую фетопатию [4–7]. Основной причиной мертворождения является внутриутробная и интранатальная гипоксия. Так, согласно данным Росстата, в целом по Российской Федерации гипоксия как причина смерти была зарегистрирована в 84,8% от всех случаев мертворождения в 2010 году и в 81,8% – в 2012 году [8, 9].
В свою очередь, внутриутробная гипоксия плода считается клиническим проявлением критической формой плацентарной дисфункции [10–12]. Частота плацентарной недостаточности (ПН) по данным различных авторов варьирует от 5% до 65%, в то время как перинатальная заболеваемость при ПН достигает 73% [3, 7, 13, 14].
Целью исследования стало определение начальных эхографических маркеров плацентарной дисфункции у беременных с последующей антенатальной гибелью плода.
Материал и методы исследования
В основу работы положен ретроспективный анализ 38 женщин, у которых течение беременности осложнилось антенатальной гибелью плода на сроках 24–36 недель гестации (основная группа). Контрольная группа сформирована из 28 женщин с физиологической беременностью. В контрольной группе родоразрешение осуществлялось в доношенном сроке. Критериями включения явились одноплодная беременность, антенатальная гибель плодов на сроках более 23 недель.
Критериями исключения в исследовании явились: многоплодная беременность, беременность с наличием хромосомных заболеваний или пороков развития у плода.
Анализировали данные анамнеза, клинико-лабораторных исследований, а также эхографического исследования беременных и морфологического изучения последа. Эхографическое обследование плодов произведено при помощи ультразвуковых приборов с использованием трансабдоминального и трансвагинального доступов, датчиками частотой 3,5–7,5 МГц. Проводилось ультразвуковое исследование (фетометрия, плацентометрия, оценка количества околоплодных вод), а также допплерометрическое исследование кровотока в артериях пуповины (АП), средней мозговой артерии (СМА), венозном протоке (ВП).
Нарушение кровотока в маточных артериях и АП диагностировали при выявлении низкого значения конечной диастолической скорости кровотока, что выражалось в увеличении численных значений индекса резистентности (ИР) выше 95-го перцентиля нормативных значений ИР. Нарушение кровотока в СМА плода диагностировалось при выявлении повышенной диастолической скорости кровотока, что выражалось в снижении численных значений ИР или пульсационного индекса (ПИ) менее 5-го перцентиля нормативных показателей [1, 15].
Макроскопическое изучение последов проводили по стандартной методике [10, 16]. После макроскопического изучения из центральной зоны плаценты вырезали кусочки ткани, которые фиксировали в 10% нейтральном формалине. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином.
Статистическая обработка материалов проводилась с использованием статистических функций программы MS Excel 2000.
Результаты исследования и их обсуждение
На первом этапе были изучены особенности анамнеза беременных женщин. При анализе экстрагенитальной патологии установлено, что у 8 женщин (21,1%) с антенатальной гибелью плода имелся хронический пиелонефрит, в том числе в фазе обострения – в половине наблюдений. У 5(13,2%) пациенток в анамнезе имелись сведения о цистите, у 3 (7,9%) из них отмечено обострение во время беременности. Шесть (15,8%) женщин перенесли острые респираторные заболевания в I триместре беременности. Клинические признаки хронической артериальной гипертензии (АГ) определялись у 8 (21,1%) беременных. Острые респираторные заболевания (с повышением температуры тела до 37,8°С) отмечались у каждой третьей пациентки.
 У 10 (26,3%) беременных основной группы в анамнезе имели также место искусственные аборты, при этом у 8 (21,1%) женщин отмечено два и более абортов, у 4 (10,5%) – неразвивающаяся беременность.
У 10 (26,3%) беременных основной группы в анамнезе имели также место искусственные аборты, при этом у 8 (21,1%) женщин отмечено два и более абортов, у 4 (10,5%) – неразвивающаяся беременность.
В данной группе по сравнению с контрольной достоверно (p<0,05) чаще отмечались гинекологические заболевания: эктопия шейки матки у 8 женщин (21,1%), хронический сальпингоофорит у 7 (18,4%), инфекции, передающиеся половым путем – у 12 (31,6%).
При анализе течения беременности в основной группе установлено, что у 9 (23,7%) женщин в I триместре имелись эхографические признаки отслойки хориона (ретрохориальная гематома) и локальный гипертонус миометрия. У 8 (21,1%) беременных развился ранний токсикоз. Практически у каждой третьей пациентки (11 женщин, 28,9%) отмечалась угроза преждевременных родов. Истмико-цервикальная недостаточность отмечалась у 3 (7,9%), при этом хирургическая коррекция проведена в 5,3% наблюдений.
Среди других осложнений беременности отмечалось развитие анемии различной степени тяжести у 17 (44,7%) женщин. Наследственная тромбофилия (низкий риск) была выявлена у 10 (26,3%) женщин.
Во II триместре беременности у 5 (13,2%) пациенток данной группы развилась преэклампсия, основными клиническими проявлениями которой явились повышение АД со средними значениями 150/90 мм рт. ст., протеинурия (1,2 г/л) и отеки (преимущественно голеней). Соответственно всем женщинам оказана терапия с учетом Московских стандартов оказания медицинской помощи. В 2 (5,3%) случаях на сроках 26 нед. и 34 нед. гестации произошла преждевременная отслойка нормально расположенной плаценты.
При исследовании отделяемого из цервикального канала методом полимеразной цепной реакции у беременных основной группы выявлены различные возбудители бактериальной инфекции в I и II триместрах: Chlamydia trachomatis у 2 (5,3%) женщин, Gardnerella vaginalis у 5 (13,2%), Mycoplasma hominis у 4 (10,5%), Ureaplasma urealyticum у 3 (7,9%). Носительство папилломавируса выявлено в 3(7,9%) наблюдениях, цитомегаловируса – у 5(13,2%) женщин, вируса простого герпеса 1-го или 2-го типа у 4 (10,5%). При бактериологическом исследовании соскоба из цервикального канала у женщин основной группы выявлен рост Staphylococcus epidermidis 7Log в 2 (5,3%), Staphylococcus hominis 7Log – 1 (2,6%), Klebsiella pneumoniae 7Log – в 1 (2,6%), E.coli 8Log – в 3 (7,9%), Streptococcus haemolyticus 8 Log – в 1 (2,6%), Enterococcus faecalis 8Log – в 6 (15,8%), Candida glabrata 8 Log – в 12 (31,6%) наблюдениях.
Среди различных проявлений ПН обращает на себя внимание наличие изменения количества околоплодных вод – у 13 (34,2%) женщин: у 2 (5,3%) – многоводие, у 11 (28,9%) – маловодие. При этом маловодие во II триместре выявлено в 5 (13,2%) случаях, в III триместре – в 6 (15,8%). У всех плодов при проведении эхографического исследования на сроках 19–21 недели не выявлены отклонения в ультразвуковой картине.
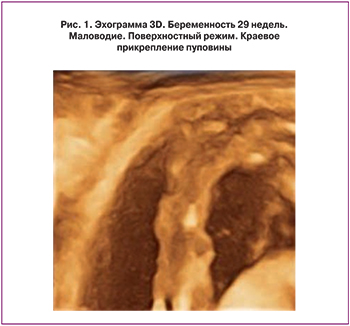
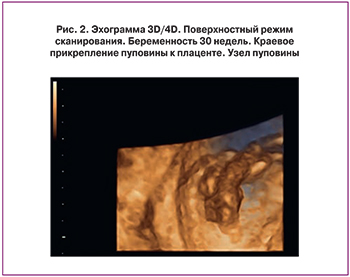 Проявлением плацентарной дисфункции является развитие синдрома задержки роста плода (СЗРП), который выявлен в основной группе у 13 (34,2%) женщин. При этом СЗРП, развившийся во II триместре беременности, выявлен у 4 (10,5%), в III триместре беременности – у 9 (23,7%). Изменение кровотока в фето-плацентарном комплексе отмечено у 5 (13,2%) в виде нарушения маточно-плацентарного кровотока IА степени; изолированное изменение кровотока в сосудах пуповины – у 3 (7,9%). Эхографическая картина плаценты имела следующие особенности. Истончение плаценты выявлено в 3 (7,9%) случаях, расширение межворсинкового пространства – в 6 (15,8%), изменение эхогенности плаценты (в виде повышения эхогенности) по материнской или плодовой поверхности различных размеров (от 1 до 1,5 см в диаметре) – в 4 (10,5%) случаях. Амниотические тяжи выявлены в 2 (5,3%) случаях. Усугубляют компенсаторные возможности в фетоплацентарном комплексе особенности отхождения сосудов пуповины. В проведенном анализе краевое прикрепление сосудов пуповины выявлено в 4 (10,5%) случаях, оболочечное прикрепление – в 3 (7,9%) случаях. В 2,6% выявлен узел пуповины (рис. 1, 2).
Проявлением плацентарной дисфункции является развитие синдрома задержки роста плода (СЗРП), который выявлен в основной группе у 13 (34,2%) женщин. При этом СЗРП, развившийся во II триместре беременности, выявлен у 4 (10,5%), в III триместре беременности – у 9 (23,7%). Изменение кровотока в фето-плацентарном комплексе отмечено у 5 (13,2%) в виде нарушения маточно-плацентарного кровотока IА степени; изолированное изменение кровотока в сосудах пуповины – у 3 (7,9%). Эхографическая картина плаценты имела следующие особенности. Истончение плаценты выявлено в 3 (7,9%) случаях, расширение межворсинкового пространства – в 6 (15,8%), изменение эхогенности плаценты (в виде повышения эхогенности) по материнской или плодовой поверхности различных размеров (от 1 до 1,5 см в диаметре) – в 4 (10,5%) случаях. Амниотические тяжи выявлены в 2 (5,3%) случаях. Усугубляют компенсаторные возможности в фетоплацентарном комплексе особенности отхождения сосудов пуповины. В проведенном анализе краевое прикрепление сосудов пуповины выявлено в 4 (10,5%) случаях, оболочечное прикрепление – в 3 (7,9%) случаях. В 2,6% выявлен узел пуповины (рис. 1, 2).
При проведении эхографического исследования у плодов основной группы, нами установлены различные сочетания эхографических признаков, характерных для внутриутробной инфекции у плода. Так, в 9 (23,7%) наблюдениях выявлен гиперэхогенный кишечник, в 7 (18,4%) – кардиомегалия в сочетании с кардиопатией, в 2 (5,3%) – кальцификаты в паренхиматозных органах и в 7 (18,4%) – признаки неиммунной водянки плода в виде отеков подкожной клетчатки, гидроторакса, гидроперикарда и асцита. Кроме того отмечены проявления нейроинфекции: малые формы ее проявления и тяжелые формы нейроинфекции. К данным признакам отнесены минерализационная васкулопатия у 2 (5,3%) плодов, субэпендимальные кисты у 3 (7,9%), гидроцефалия у 3 (7,9%) и кальцинаты в головном мозге у 3 (7,9%).
Пик мертворождения в основной группе составил для II триместра – сроки 25–26 недель (26,1±1,2 недель), для III триместра – сроки 33–34 недели (33,4±1,7 недель). Предположительно, у плодов во II триместре причиной гибели явилась инфекция в 11 (28,9%).
В результате комплексного изучения тел мертворожденных в 4 наблюдениях (10,5%) была выявлена врожденная генерализованная вирусная инфекция, в 8 (21,1%) – внутриутробная пневмония, в 5 (13,2%) – врожденный кандидоз в 3 (7,9%) – энтероколит. При микробиологическом исследовании аутопсийного материала в 5 (13,2%) наблюдениях в образцах ткани легких, кишечника и мазке из зева обнаружен рост Staphylococcus hominis, Klebsiella pneumonia, в образце кишечника – E. coli. У двух (5,3%) мертворожденных в содержимом толстой кишки обнаружен рост Bacillus cereus, Еnterobacterium spp., Staphylococcus epidermidis и Citrobacter freundii в минимальном количестве. В одном наблюдении отмечен минимальный рост Сitrobacter freundii в ткани печени.
При гистологическом исследовании ткани плаценты установлены гипоксические изменения ворсинчатого дерева в виде облитерирующей ангиопатии с перестройкой стволовых артерий и артериол, диффузного фиброза стромы, формирования внутрисосудистых септ и синтициальных узелков. Подобные изменения свидетельствуют о развитии выраженной хронической маточно-плацентарной ишемии. В наблюдениях задержки роста плода отмечались также группы бессосудистых ворсин, свидетельствующие о выраженных нарушениях их васкуляризации.
В ряде препаратов плаценты наблюдались признаки гипоксической гиперкапилляризации в виде большого количества мелких капилляров в участках скопления терминальных ворсин. При этом ворсины соединялись друг с другом трофобластическими мостиками. Подобные изменения были характерны для беременных с признаками анемии, умеренной эклампсии и наличием СЗРП.
Важным фактором, приводящим к плацентарной дисфункции, является формирование незрелости ворсинчатого дерева к данному сроку гестации. Так при исследовании плацент (из 22 случаев мертворождения плодов в III триместре) в 18 (81,8%) наблюдениях выявлен патологический вариант незрелости ворсинчатого дерева (вариант промежуточных дифференцированных ворсин), наличие циркуляторных и дистрофических изменений. В 6 (15,8%) наблюдениях установлено соответствие строения ворсинчатого дерева сроку беременности, в 7 (18,4%) – ускоренное созревание ворсинчатого дерева.
В 17 (44,7%) наблюдениях в плаценте выявлены ишемически-геморрагические инфаркты, обнаружены крупные субхориальные тромбы. Выявлены тромбы в сосудах висцерального хориона, а также многочисленные скопления склерозированных ворсин и некрозы базальной пластинки. Признаки хронической маточно-плацентарной гипоксии (многочисленные мелкие терминальные ворсины с множеством синцитиальных почек), а также афункциональные зоны выявлены в 60,5% наблюдениях. Наряду с этим выявлялись участки отложения фибриноида, замуровывающие обширные участки ворсинчатого дерева, что свидетельствует о нарушении внутриутробного развития.
Следовательно, выявленные нами морфологические изменения плаценты подтверждают данные эхографического исследования о развитии ПН, явившейся причиной внутриутробной гибели.
Действительно, плацентарная дисфункция остается главной причиной развития критического состояния у плода. Различные агрессивные факторы (вредные привычки, экстрагенитальные заболевания матери, включая инфекции, осложнения беременности) приводят к выраженной хронической маточно-плацентарной ишемии и соответственно гипоксическим повреждениям ворсинчатого дерева плаценты.
В настоящем исследовании основными среди ряда выявленных осложнений беременности, которые и привели к антенатальной гибели плодов во II триместре явились, по нашему мнению, тяжелая преэклампсия и инфекционные поражения плода и плаценты. Клинические проявления преэклампсии отмечались у 12 (31,6%) пациенток основной группы. Различные неблагоприятные факторы: курение, гипертензия могут вызвать изменения сосудов плацентарного ложа, создавая условия для ухудшения плацентарного кровотока.
В основе развития преэклампсии лежит развитие эндотелиальной дисфункции, при этом происходящие структурные изменения в ткани плаценты приводят к прогрессированию ПН и ее декомпенсации, что и было отмечено при морфологическом изучении последов, полученных от беременных основной группы.
По данным литературы табакокурение также способствует повреждению эндотелия, что является дополнительным фактором риска антенатальной гибели плода [7]. В основной группе курили во время беременностии 8 (21,1%) жещин. Среди женщин основной группы отмечен высокий процент перенесенных детских инфекций, который составил 16 (42,1%) случаев.
Инфекционный фактор также играет важную роль в развитии антенатальной гибели плода. На основании морфологического исследования образцов плаценты нами установлено наличие пизнаков воспалительной инфильтрации плодных оболочек в 19 (50%) наблюдениях. Подобные изменения в виде острого очагового экссудативного фуникулита, париетального и висцерального хориоамниотита, продуктивного базального децидуита способствуют развитию дисциркуляторных нарушений в плацентарной ткани. В некоторых препаратах нами отмечались явления отека ворсин с признаками отставания их созревания.
Безусловно, наличие отягощенного анамнеза матери (хронические инфекции), наличие в анамнезе прерывания беременности, перенесенные во время беременности острые респираторные заболевания, обострение хронического пиелонефрита, цистита повышают риск развития внутриутробной инфекции.
Проблема антенатальной гибели плода актуальна в акушерстве и требует выработки предикторов, указывающих на возможность формирования критического состояния у плода. В проведенном анализе отмечены следующие маркеры критического состояния у плода во II и начале III триместра беременности: раннее изменение количества околоплодных вод на фоне гипоксических изменений в фето-плацентарном комплексе; пороки развития плаценты и пуповины; инфекционное повреждение органов плода и развитие преэклампсии. Общеизвестные допплерометрические критерии критического состояния у плода в проведенном исследовании отсутствовали.
Среди возможных этиологических факторов изменения околоплодных вод (по данным проведенного анализа) являются воспалительные заболевания женской половой сферы (различные возбудители бактериальной инфекции выявлены в основной группе при исследовании отделяемого из цервикального канала), а также развитие преэклампсии во время беременности. Полученные данные согласуются с другими исследованиями [7, 13, 17].
По данным литературы [1, 2, 12] уменьшенние объема околоплодных вод повышает частоту развития задержки внутриутробного роста плода. При выраженном маловодии, особенно в сочетании с гипотрофией плода, повышается частота замершей беременности.
При восходящем пути инфицирования (через канал шейки матки в околоплодное пространство) происходит одновременное воспалительное поражение амниона плаценты и пуповины.
При воспалительных процессах развивается относительный вариант незрелости ворсин – диссоциированное развитие котиледонов или вариант патологической незрелости – доминирование промежуточных дифференцированных ворсин, что свидетельствовует об отставании в развитии ворсин до 6 недель. Наличие межворсинчатого фибриноида, склееных ворсин, инфарктов и инволютивных процессов (кальцификатов) свидетельствует о начальных стадиях хронической ПН.
Заключение
Таким образом, несмотря на имеющиеся сложности выявления клинических маркеров критического состояния у плода на современном этапе следует использовать данные эхографического исследования, наиболее информативными из которых являются: маловодие, специфические изменения в плаценте, СЗРП, патологические показатели кровотока в фето-плацентарном комплексе.



