Миома матки является одной из самых распространенных доброкачественных опухолей у женщин. Особенности клинического течения миомы матки и прогноз заболевания определяется, прежде всего, вариантом ее развития (простая, клеточная и пролиферирующая миома), локализацией миоматозных узлов, их размерами и темпом роста. Важно отметить, что клинические проявления миомы матки зависят также от сопутствующей патологии эндометрия. В литературе имеются многочисленные, но противоречивые данные о морфологическом состоянии эндометрия у больных с сочетанной патологией эндо- и миометрия. Параллельное существование миомы матки и гиперпластического процесса эндометрия отмечается у 55–60% обследованных по поводу маточных кровотечений [1]. Исследование эндометрия у больных, оперированных по поводу миомы матки, показало, что железистая гиперплазия эндометрия обнаруживается в 40–62,5% случаев, в том числе атипическая – в 10–12,7%, полипы эндометрия – в 10–15,6%, аденомиоз – в 7,55%, рак эндометрия – в 0,7–7% [2]. Результаты исследований [3, 4] свидетельствуют о том, что у пациенток с патологией миометрия выраженность пролиферативных изменений в слизистой оболочке матки коррелирует с клинико-морфологическим вариантом лейомиомы. Высокая частота выявления гиперпластических процессов в эндометрии у больных с миомой матки предполагает сходство патогенетических звеньев формирования сочетанной патологии эндо- и миометрия.
Учитывая, что миома матки часто сочетается с гиперпластическими процессами эндометрия, можно предположить системный характер поражений матки при сочетанных гиперпластических заболеваниях эндо- и миометрия, а также то, что клинические проявления миомы во многом зависят и определяются формой патологии эндометрия. Возраст возникновения заболевания имеет неуклонную тенденцию к снижению и приходится на 30–35 лет, что приводит к преждевременной утрате репродуктивной функции [5].
В исследовании Л.А. Щербаковой и соавт. [6] обнаружено, что у 62,1% обследованных больных репродуктивного возраста имело место сочетание субмукозной миомы матки с гиперпластическими процессами в эндометрии. Иммуногистохимические исследования ткани удаленных миом и гиперплазированного эндометрия показали, что экспрессия рецепторов эстрогена, прогестерона и индекс пролиферативной активности были различными в ткани субмукозных миоматозных узлов, нормального эндо- и миометрия и в ткани гиперплазированного эндометрия. Предполагается, что установленные различные изменения в ткани гиперплазированного эндометрия и миоматозных узлов могут быть одной из причин неэффективности гормонального лечения у больных с сочетанной патологией и служат обоснованием их хирургического лечения [6].
Результаты исследований [7] преморбидного фона у пациенток с различными сочетаниями гиперпластических заболеваний репродуктивных органов свидетельствуют, что сочетанная патология эндо- и миометрия представляет собой единое патологическое состояние репродуктивной системы, проявляющееся гиперпластическими изменениями гормонозависимых органов.
Большой вклад в стимуляцию пролиферативного потенциала клеток вносит нарушение метаболизма стероидных гормонов и экспрессии их рецепторов [8]. Согласно результатам исследования Н.А. Литвиновой [9], у пациенток с миомой матки и доброкачественным гиперпластическим процессом в эндометрии повышена экспрессия эстрогена и прогестерона как при простой, так и при сложной типичной гиперплазии по сравнению с нормальным эндометрием фазы пролиферации. Наряду с этим, по данным С.В. Закаблуковой [7],
у больных с сочетанной доброкачественной патологией эндо- и миометрия имеются крайне высокий уровень экспрессии эстрогена и низкая очаговая экспрессия прогестерона в эндометрии, однако закономерности экспрессии данных рецепторов при различных морфологических вариантах гиперплазии также не отмечается.
В связи с преимущественным содержанием в матке эстрогена типа α большинство современных исследований эстрогена в эндометрии при гиперплазии посвящено изучению именно данного типа рецепторов эстрадиола. Так, согласно результатам исследования K. Hu и соавт. [10], экспрессия эстрогена типа α в гиперплазированном эндометрии повышена, а по данным O. Nunobiki и соавт. и S. Bircan и соавт [11, 12] – снижена.
Наименее изучен вопрос об изменении рецептивности эндометрия и ее взаимосвязи с различными вариантами патологии эндометрия у больных лейомиомой матки [13].
Целью исследования стало изучение морфофункционального состояния эндометрия у больных миомой матки репродуктивного возраста.
Материал и методы исследования
В работу включены результаты проспективного исследования 101 женщины, находившейся на стационарном лечении в НЦАГиП им. В.И. Кула-кова Минздрава России с 2011 по 2012 г. Возраст пациенток колебался от 18 до 39 лет (34,4±3,4 года). Было сформировано 4 клинических группы больных с миомой матки: I группа – больные с полипами эндометрия (22 человека), II группа – больные с простой и комплексной гиперплазией эндометрия (11 человек), III группа – больные с хроническим эндометритом (17 человек),
IV группа – больные без патологических изменений эндометрия (51 человек).
Критериями включения в исследование служили: репродуктивный возраст; наличие миомы матки, подтвержденной данными гинекологического и ультразвукового исследования; интраоперационное и патологоанатомическое подтверждение наличия миомы матки.
Критериями исключения были: наличие выраженной экстрагенитальной патологии; злокачественные образования любой локализации; гормональная терапия или использование внутриматочных средств контрацепции в течение 4 месяцев до исследования; наличие сопутствующей генитальной патологии.
Обследование больных проводилось по разработанной «Карте комплексного обследования», включающей оценку возраста, общесоматического и гинекологического статуса, анализ сопутствующей гинекологической патологии и экстрагенитальных заболеваний.
При обследовании больных с миомой матки учитывались следующие параметры: размеры матки, локализация узлов относительно толщины маточной стенки (подслизистая, интрамуральная, субсерозная), размеры миоматозных узлов, наличие клинических симптомов заболевания (болевой синдром, быстрый рост опухоли, рождающийся подслизистый узел, острое нарушение питания или инфицирование узлов, меноррагия, бесплодие). Кроме того, учитывался возраст выявления миомы матки.
Фертильными считались женщины, имеющие хотя бы одну беременность в анамнезе.
УЗИ проводили с помощью аппаратов «Aloka альфа-10» (Япония) и «Siemens Elegra» (Германия) с использованием трансвагинального датчика с частотой 5 Мгц. Определяли расположение матки, ее размеры, оценивали структуру миометрия, наличие сопутствующей патологии миометрия (эхо-признаков аденомиоза), состояние срединного маточного эхо (М-эхо), его эхогенность, структуру, толщину, локализацию, состояние яичников.
Лапароскопию выполняли под эндотрахеальным наркозом с использованием эндохирургической стойки, укомплектованной аппаратурой фирмы «Karl Stotz Gmbh» (Германия) по стандартной закрытой методике.
Во время лапароскопии оценивали размеры, положение органов малого таза, наличие сопутствующей патологии матки и придатков. Всем пациенткам проведена миомэктомия лапароскопическим или, в случае субмукозного расположения узлов, гистерорезектоскопическим доступом под контролем лапароскопии, а также диагностическое выскабливание эндометрия.
Морфологическому исследованию подвергались миоматозные узлы, удаленные во время миомэктомии, и соскобы эндометрия и эндоцервикса, полученные при диагностическом выскабливании. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 ч. Образцы были обработаны по общепринятой стандартной методике и заключены в парафин. Срезы толщиной 4 мкм окрашивали гематоксилином и эозином. Иммуногистохимическому (ИГХ) исследованию подвергнут материал от 21 пациентки. ИГХ-реакции проводили на депарафинировнных срезах толщиной 4–5 мкм по общепринятым протоколам (DAKO protocols). Стероидные рецепторы выявлялись с помощью мышиных моноклональных антител к эстрогену типа α (клон 1D5 «DAKO», Дания) и прогестерону А (клон 636 «DAKO», Дания). Рассчитывался индекс прогестерон/эстроген по строме, являющийся прогностическим признаком наступления беременности, как нами было показано ранее [13]. Благоприятным критерием наступления беременности является соотношение прогестрона/эстрогена в диапазоне от 2 до 3 [14].
Для выявления экспрессии лейкемия-ингибирующего фактора (ЛИФ) использовали первичные мышиные антитела к ЛИФ (R@D Systems, USA, clone:9824). Для анализа результатов ИГХ-реакций использовали метод гистологического счета H-score по формуле: HS = 1a±2b±3c, где а – процент слабо окрашенных клеток, b – процент умеренно окрашенных клеток, с – процент сильно окрашенных клеток, 1, 2, 3 – интенсивность окрашивания, выраженная в баллах. Результаты ИГХ-реакции для ЛИФ оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (-) – 0 баллов; менее 5% иммуноокрашенных клеток (±) – 0,5 балла, менее 20% иммуноокрашенных клеток (±) – 2 балла; от 20 до 40% окрашенных клеток (±±) – 4 балла; более 40% окрашенных клеток (±±±) – 6 баллов.
Полученные данные подвергались статистической обработке при помощи программы STATIATICA 6.0 for Windows. Достоверность различий количественных показателей проверяли при помощи U-критерия Уилкоксона–Манна–Уитни. Качественные признаки сравнивались с помощью точного теста Фишера. Для определения существования функциональных связей между параметрами вычисляли коэффициент корреляции R Спирмена. Построение прогностической модели риска развития рака эндометрия у больных с гиперпластическими процессами в эндометрии с миомой матки проводилось при помощи программы SPSS 12.0 методом мультиноминальной логистической регрессии на основании выбранной оптимальной совокупности признаков.
Результаты исследования
Клинико-морфологические сопоставления
Патология эндометрия по данным гистологического исследования выявлена у 50 (49,5%) больных миомой матки. Она была представлена следующими вариантами: фиброзно-железистыми полипами эндометрия – у 22 (21,8 %) женщин, гиперплазией эндометрия – у 11 (10,9 %), хроническим эндометритом – у 17 (16,8 %) пациенток. У 51 пациентки патологических изменений в эндометрии по данным гистологического исследования найдено не было.
Средневозрастные показатели больных сравниваемых групп в зависимости от характеристики эндометрия не имели существенных различий. Средний возраст пациенток с полипами эндометрия составил 35±3,2 года, с гиперплазией эндометрия – 36±2,5 года, с хроническим эндометритом – 33±3,1 года, без патологии эндометрия – 34±3,2 года (p>0,05).
Изучение особенностей клинического течения патологических процессов эндометрия в сочетании с миомой матки показало, что менометроррагия у больных миомой матки в сочетании с эндометриальными полипами встречалась в 36% (8 больных), с нормальным эндометрием – в 9,8% (5 больных), при гиперплазии эндометрия – в 18,2% (2 больных), с хроническим эндометритом – в 17,6% (3 больных). Таким образом, клинический вариант течения миомы матки определяется не только расположением узлов миомы, но и формой сопутствующей патологии эндометрия.
Длительность заболевания миомой матки у пациенток без патологии эндометрия составила 4,2 года, у пациенток с миомой матки в сочетании с полипами эндометрия – 4,3 года, с хроническим эндометритом – 3,8 года, с гиперплазией эндометрия – 5,7 года (p>0,05).
 Множественные узлы чаще выявлялись у пациенток с сопутствующей патологией эндометрия (52%), однако эти данные статистически не значимы (p>0,05). В группе пациенток с гиперплазией эндометрия множественная миома матки выявлена в 63,6% (7 пациенток), в группе с полипами эндометрия – в 54,5% случаев (12 пациенток), в группе с хроническим эндометритом – в 41,2% (7 пациенток). Таким образом, наиболее часто множественная миома матки встречалась в группе пациенток с гиперплазией эндометрия (p<0,05). Субмукозное расположение узлов миомы наиболее часто выявлено в группе пациенток с гиперплазией – в 18% и полипами эндометрия – в 18%. При этом в группе пациенток без патологии эндометрия субмукозная миома матки выявлена в 5,9 % (p<0,05).
Множественные узлы чаще выявлялись у пациенток с сопутствующей патологией эндометрия (52%), однако эти данные статистически не значимы (p>0,05). В группе пациенток с гиперплазией эндометрия множественная миома матки выявлена в 63,6% (7 пациенток), в группе с полипами эндометрия – в 54,5% случаев (12 пациенток), в группе с хроническим эндометритом – в 41,2% (7 пациенток). Таким образом, наиболее часто множественная миома матки встречалась в группе пациенток с гиперплазией эндометрия (p<0,05). Субмукозное расположение узлов миомы наиболее часто выявлено в группе пациенток с гиперплазией – в 18% и полипами эндометрия – в 18%. При этом в группе пациенток без патологии эндометрия субмукозная миома матки выявлена в 5,9 % (p<0,05).
Анализ состояния репродуктивного здоровья больных изучаемых групп показал, что у больных с миомой матки и сопутствующей патологией эндометрия отмечается тенденция к меньшему количеству беременностей, чем у пациенток с миомой матки без патологии эндометрия. Так, среди пациенток с миомой матки и нормальным эндометрием у 25 больных отмечалось от 1 до 7 беременностей, тогда как в группе женщин с полипами эндометрия у 9 пациенток было от 1 до 4 беременностей, в группе с гиперплазией эндометрия у 10 женщин было от 1 до 5 беременностей и в группе пациенток с хроническим эндометритом у 10 больных отмечалось от 1 до 5 беременностей. Таким образом, при наличии сопутствующей патологии эндометрия отмечается наименьшее количество беременностей в анамнезе по сравнению с пациентками остальных групп.
Частота бесплодия в группе больных с патологией эндометрия имеет тенденцию к увеличению по сравнению с группой без патологии эндометрия. Так, в группе пациенток с различной патологией эндометрия бесплодие выявлено в 64% случаев (32 пациентки), тогда как в группе пациенток без патологии эндометрия – в 51% случаев (26 женщин). Высокая частота бесплодия у пациенток с миомой матки и отсутствием патологических изменений в эндометрии, по-видимому, может быть объяснена нарушением рецептивности эндометрия.
Бесплодие среди пациенток с патологией эндометрия и миомой матки (n=32) в 47% (15) случаев сочеталось с полипами эндометрия, в 34% (11) – с хроническим эндометритом, в 19% (6) – с гиперплазией эндометрия.
По данным гистологического исследования, среди пациенток с миомой матки и патологией эндометрия простая миома выявлена у 42 пациенток (84%), а клеточная – у 8 (16%) (рис. 1а, в см. на вклейке), тогда как у пациенток без патологических изменений эндометрия по данным гистологического исследования простая миома матки наблюдалась в 48 случаях (94%), а клеточная – в 3 (6%).
Сочетанная патология эндометрия при разных типах лейомиомы матки встречалась с различной частотой (таблица). Неизменный эндометрий чаще выявлялся у пациенток с простой лейомиомой матки (в 53,3%), чем среди пациенток с клеточной лейомиомой (30%) (p<0,05).
Морфологическое исследование
Диагноз простой и клеточной лейомиомы был уточнен только после ИГХ-исследования. Простая лейомиома выявлена в 13 (61,9%) из 21 случая и характеризовалась индексом пролиферации по Ki-67 до 5% (рис. 1б см. на вклейке), высокой экспрессией прогестерона (до 220%) и низкой экспрессией эстрогена. Клеточная лейомиома обнаружена в 8 (38,1%) случаях и отличалась индексом пролиферации до 17% (рис. 1г см. на вклейке), а также с высокой экспрессией прогестерона (до 220%) и низкой экспрессией эстрогена. Исходя из полученных данных, можно заключить, что маркер пролиферации Ki-67 является ключевым ИГХ-маркером для точного определения гистологического типа лейомиомы матки.
При морфологическом исследовании патология эндометрия не имела специфических особенностей.
Фиброзно-железистые полипы характеризовались разрастанием фиброзной ткани и железистых тубулярных структур. В строме обнаруживались толстостенные сосуды и лимфоплазмоцитарная инфильтрация (рис. 2а см. на вклейке). Иммунофенотип фиброзно-железистых полипов отличался умеренными значениями индекса пролиферации в строме по Ki-67 (рис. 2б см. на вклейке), а также невысоким уровнем экспрессии в железах прогестерона и эстрогена.
Простая гиперплазия эндометрия у больных с миомой матки характеризовалась гиперплазией эпителия желез, которые приобретали извилистый ход, увеличивались в размерах, в ряде случаев подвергались кистозной трансформации (рис. 2в см. на вклейке), а также умеренными значениями индекса пролиферации по Ki-67 в строме (до 10–15%) (рис. 2г см. на вклейке) и низким уровнем в железах (до 5%), в то время как уровень экспрессии гормональных рецепторов имел высокое значение и был сопоставим в строме и железах.
Хронический эндометрит диагностирован нами в эндометрии фазы пролиферации по наличию лимфоплазмоцитарной инфильтрации, гиперплазированных лимфоидных фолликулов и очагов неоангиогенеза и склероза (рис. 2д см. на вклейке). Индекс пролиферации по Ki-67 в железах и строме составил до 20% (рис. 2е см. на вклейке), а также выявлена неравномерная экспрессия гормональных рецепторов на высоком уровне, как в строме, так и в железах.
Из 13 пациенток с простой лейомиомой в 3 случаях (23,0%) выявлены полипы эндометрия, в 2 (15,4%) – гиперплазия эндометрия, в 2 (15,4%) – хронический эндометрит, в 6 случаях (46,2%) патологии эндометрия не было выявлено.
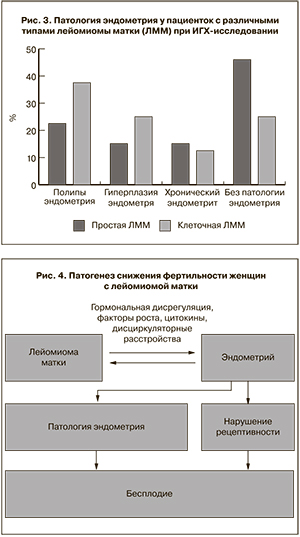
Из 8 пациенток с клеточной лейомиомой в 3 случаях (37,5%) выявлены полипы эндометрия, в 2 (25%) – гиперплазия эндометрия, в 1 (12,5%) – хронический эндометрит, в 2 (25%) случаях патологии эндометрия не выявлено (рис. 3).
Таким образом, при проведении более тщательного исследования у пациенток с миомой матки с применением ИГХ-методов исследования выявлено, что выраженность патологии эндометрия у пациенток с клеточной лейомиомой в целом выше, чем у пациенток с простой лейомиомой, что может указывать на наличие корреляции между пролиферативными процессами в эндо- и миометрии, а также предполагать тесную взаимосвязь между развитием гиперпластических процессов эндо- и миометрия. Проведенное исследование показывает возможность существования патогенетической взаимосвязи между развитием лейомиомы матки, патологией эндометрия, нарушением рецептивности эндометрия и бесплодием у женщин (рис. 4).
Заключение
Патология эндометрия у пациенток с лейомиомой матки встречается в 49,5%, при этом даже без структурной перестройки эндометрия имеются признаки нарушения его рецептивности. Лейомиома разных гистологических типов сочетается с определенным типом патологии эндометрия с различной частотой. Данные ИГХ-исследования показали наличие патогенетической взаимосвязи между развитием лейомиомы, патологией эндометрия и нарушением его рецептивности, что может быть причиной бесплодия (рис. 4).




