Бесплодие представляет собой глобальную проблему, затрагивающую 10–15% супружеских пар репродуктивного возраста в большинстве стран мира [1, 2]. За последние десятилетия в рамках проведения программ экстракорпорального оплодотворения (ЭКО) в лечении бесплодия достигнут огромный прогресс по оптимизации условий культивирования эмбрионов [3, 4], оценке морфологических и молекулярно-биологических критериев их качества [5–8], выбору стадии развития эмбриона, подходящей для переноса в полость матки [9, 10]. Но не только жизнеспособность и качество эмбриона играют первостепенную роль в успешной имплантации. Рецептивность эндометрия является решающим фактором в обеспечении имплантации эмбриона в течение определенного периода менструального цикла, называемого «окном имплантации» [11, 12]. Эта средняя стадия секреторной фазы наступает через 6–10 дней после пика лютеинизирующего гормона и регулируется цитокинами, факторами роста и другими молекулами, ключевыми для развития эндометрия и эмбриона [13, 14]. Выявлено, что около 60% повторных неудач вспомогательных репродуктивных технологий (ВРТ) обусловлено смещением «окна имплантации» [12, 15, 16]; поэтому определение готовности эндометрия к имплантации эмбриона является важной задачей в области репродукции.
Для определения рецептивности эндометрия были разработаны различные методы, включая инструментальные и инвазивные методы исследования [17]. Согласно данным метаанализа, специфичность и/или чувствительность инструментальных методов исследования по анализу толщины, объема, трехслойности эндометрия, кровотока в эндометрии, гистероскопии не позволяют достоверно оценить рецептивность эндометрия с целью прогнозирования наступления беременности в программах ВРТ [12]. Ультраструктурными маркерами рецептивности эндометрия являются пиноподии, считающиеся предпочтительными местами взаимодействия эмбриона и эндометрия [18, 19]. Кроме того, появление пиноподий совпадает с увеличением экспрессии других биомаркеров «окна имплантации», таких как муцин 1, ингибирующий лейкемию фактор (LIF) и его рецептор (интегрин αVβ3) [20], гомеодомен-содержащий транскрипционный фактор 10 (HOX10) [21]. Оценка числа и формы пиноподий при гистологическом анализе биоптата эндометрия была использована для разработки метода персонализированного переноса эмбрионов [22]. Но во избежание ошибок в подсчете числа пиноподий в образце люминальной поверхности эндометрия необходим микроскопический просмотр не менее 60 областей образца ввиду высокой вариабельности числа пиноподий (от 5 до 20%) [23], что является трудоемким процессом и исключает его использование в рутинной клинической практике.
Использование метода транскриптомного анализа биоптата эндометрия (мРНК и микроРНК) позволило выявлять пациентов со смещением окна имплантации и повысить частоту наступления беременности, особенно в группе с повторными неудачами имплантации в программе ЭКО [24–26]. Несмотря на большую информативность и точность метода транскриптомного анализа в сравнении с гистологическим исследованием биоптата эндометрия, его дороговизна и инвазивность являются препятствиями для рутинного применения в клинической практике.
Альтернативным методом оценки состояния эндометрия является исследование маточной жидкости (МЖ), аспирация которой является минимально инвазивной и безопасной и может быть выполнена непосредственно перед переносом эмбрионов без отрицательного влияния на последующую имплантацию, в отличие от общепринятой биопсии эндометрия [27, 28]. Было выявлено изменение паттерна экспрессии малых некодирующих (мнк)РНК экзосом МЖ в рецептивную стадию в сравнении с прорецептивной стадией секреторной фазы естественного менструального цикла и при контролируемой овариальной стимуляции [29], но связи с наступлением беременности выявить не удалось.
Для минимизации влияния на эндометрий контролируемой овариальной стимуляции [30] нами была выбрана модель переноса эмбриона в криоцикле.
Цель исследования: оценка рецептивности эндометрия путем количественного определения мнкРНК в МЖ в день переноса криоконсервированного эмбриона (КЭ) на фоне циклической гормональной терапии (ЦГТ) и построение модели логистической регрессии расчета вероятности готовности эндометрия к имплантации эмбриона путем сопоставления транскриптома МЖ от пациенток с положительным и отрицательным исходом программы ВРТ.
Материалы и методы
Пациенты
В отделение вспомогательных репродуктивных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «НМИЦ АГП им. В.И. Кулакова» обратились 54 супружеские пары для проведения программы переноса КЭ на фоне ЦГТ. Критериями включения в исследование были возраст пациентов от 29 до 39 лет, нормальный овариальный резерв у женщин с трубно-перитонеальным фактором бесплодия, нормозооспермия или мужской фактор бесплодия без выраженной патозооспермии. Критериями невключения в исследование были: 1) наличие верифицированного наружного генитального эндометриоза III–IV стадии; 2) онкологические заболевания; 3) синдром поликистозных яичников; 4) патология эндометрия; 5) интерстициальная и/или субсерозная миома матки более 4 см; 6) субмукозная миома, деформирующая полость матки; 7) генетические аномалии; 8) пороки развития половых органов; 9) перенесенные оперативные вмешательства на яичниках; 10) тяжелые формы мужского бесплодия.
Всем пациентам было проведено полное клинико-лабораторное обследование согласно Клиническим рекомендациям «Женское бесплодие», а также в соответствии с Приказом Минздрава России от 31.07.2020 N 803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». У всех пациентов, включенных в исследование, было получено информированное добровольное согласие на осуществление аспирации МЖ в день переноса эмбриона с помощью одноразовых гибких катетеров.
Протокол подготовки эндометрия к переносу размороженного эмбриона на фоне ЦГТ
На 2–4-й день менструального цикла пациентам был назначен препарат эстрадиола валерат в дозировке 2 мг/сут, и после достижения нормальной толщины эндометрия (>7 мм) на 14–15-й день цикла вводили гестагены (200 мг/сут микронизированного прогестерона или 10 мг/сут дидрогестерона). День переноса КЭ в полость матки рассчитывали путем прибавления числа дней культивирования эмбриона с момента оплодотворения яйцеклетки в предыдущем цикле стимуляции суперовуляции к дате начала введения гестагенов в текущем криоцикле, как показано на рисунке 1.
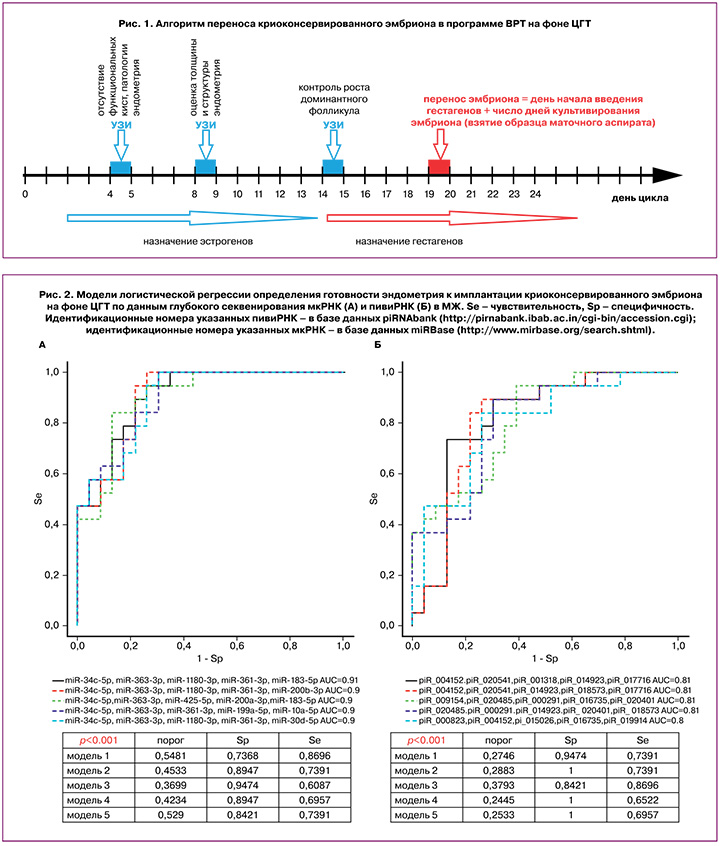
Наступление беременности диагностировали при получении положительного результата β-хорионического гонадотропина человека через 14 дней после переноса эмбриона и при визуализации плодного яйца в полости матки на 21-й день.
Аспирация МЖ
Аспирация МЖ проводилась непосредственно перед проведением переноса КЭ с использованием гибкого катетера (COOK, Австралия), который соединялся со стерильным шприцом (1 мл). Полученный материал МЖ объемом 5–50 мкл помещали в стерильный эппендорф и доводили объем физиологическим раствором 0,9% NaCl до 200 мкл. Далее материал транспортировали в лабораторию прикладной транскриптомики отдела системной биологии в репродукции ФГБУ «НМИЦ АГП им. В.И. Кулакова» для хранения при -80°С и дальнейшего молекулярно-биологического анализа МЖ.
Выделение мнкРНК из образцов МЖ
Из собранных образцов МЖ были выделены РНК колоночным способом с использованием набора miRNeasy Serum/Plasma Kit (Qiagen).
Глубокое секвенирование мнкРНК
Из 14 мкл элюата колонки miRNeasy Serum/Plasma Kit (Qiagen), содержащего мнкРНК из МЖ, 7 мкл были использованы для синтеза кДНК-библиотек набором NEBNext Multiplex Small RNA Library Prep Set for Illumina (Set11 and Set2, New England Biolab®), амплифицированных в течение 20 циклов в ходе полимеразной цепной реакции (ПЦР), очищенных в 6% полиакриламидном геле и секвенированных на платформе NextSeq 500/550 (Illumina). Секвенированные последовательности в диапазоне от 16 до 50 п.н. были картированы на базы данных человека GRCh38.p15, miRBase v21 и piRNABase с использованием алгоритма Bowtie [31]. Анализ дифференциальной экспрессии мнкРНК проводили с помощью программного пакета DESeq2 [32].
Обратная транскрипция и количественная ПЦР в реальном времени
Из 14 мкл элюата колонки miRNeasy Serum/Plasma Kit (Qiagen), содержащего мнкРНК из МЖ, 5 мкл были использованы для синтеза кДНК набором miScript II RT Kit (Qiagen) по протоколу фирмы-производителя. Количественная ПЦР в реальном времени была проведена с использованием набора miScript SYBR Green PCR Kit (Qiagen, Hilden, Germany) и смысловых праймеров, специфичных для определенных мкРНК и пивиРНК (табл. 1). Программа ПЦР: (1) 15 мин при 95°С и (2) 40 циклов: 94°С в течение 15 с, оптимизированная температура отжига (45–61,6°С) в течение 30 с и 70°С в течение 30 с; (3) нагревание реакционной смеси от 65 до 95°C с шагом 0,1°C для построения кривой плавления продукта ПЦР в термоциклере StepOnePlus (Applied Biosystems). Относительную экспрессию мнкРНК в МЖ определяли методом ∆Ct, используя hsa_piR_017716 в качестве референсной РНК.
Статистический анализ
Для статистической обработки результатов использовали скрипты, написанные на языке R [33], и программу RStudio [34]. Соответствие анализируемых параметров закону нормального распределения оценивали по значениям теста Шапиро–Уилка. Статистический анализ проводили с помощью теста Манна–Уитни при парном сравнении в случае, когда распределение не соответствовало закону нормального распределения. При распределении признаков с распределением, отличающимся от нормального, их описывали в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1; Q3). Величину порогового уровня значимости p принимали равной 0,05. Если значение p было меньше 0,001, то p указывали в формате p<0,001.
Модели логистической регрессии разрабатывали с использованием программы RStudio путем поэтапного включения и исключения мнкРНК-предикторов рецептивного эндометрия в соответствии с их вкладом в модель. Прогностическую способность модели оценивали методом ROC-анализа (Receiver operating characteristic) по величине AUC (Area Under Curve), статистической значимости, уровню специфичности и чувствительности.
Результаты
На первом этапе исследования был проведен ретроспективный анализ анамнестических и лабораторных данных супружеских пар до вступления в программу ЭКО, эмбрионального этапа в ходе стимуляции суперовуляции и последующего криопротокола на фоне ЦГТ в двух сформированных группах в зависимости от наличия или отсутствия имплантации эмбриона (табл. 2).
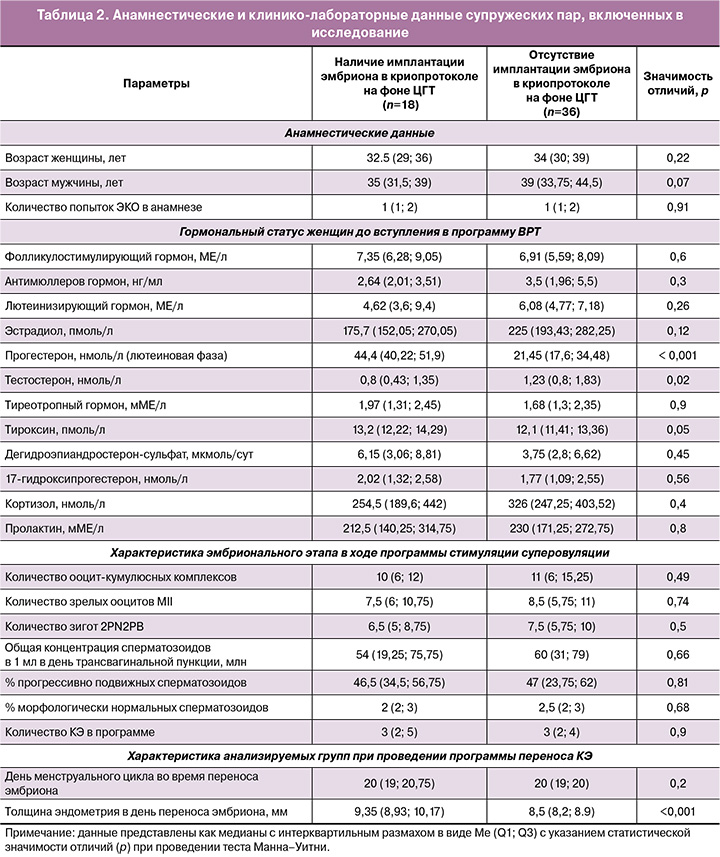
Из таблицы 2 следует, что в группе с отрицательным результатом программы ВРТ при переносе КЭ наблюдали статистически значимое повышение уровня тестостерона в 1,5 раза (р=0,02) и понижение уровня прогестерона в 2,1 раза (р<0,001) относительно группы с наступившей беременностью до вступления в программу ЭКО. При этом у женщин с положительным результатом программы ВРТ выявлены более высокие значения толщины эндометрия в день переноса эмбриона, по сравнению с группой женщин, у которых беременность не наступила (р<0,001). По анамнестическим данным и характеристикам эмбрионального этапа в ходе программы стимуляции суперовуляции сопоставляемые группы не различались.
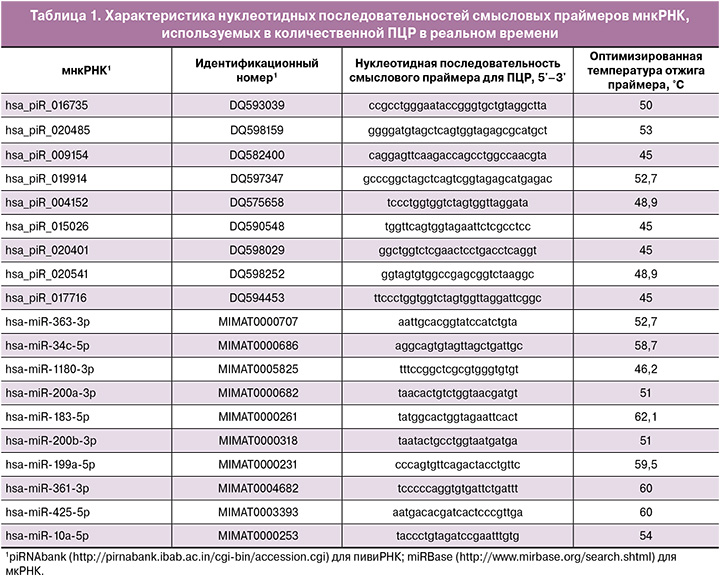
На втором этапе исследования методом глубокого секвенирования была проведена количественная оценка мнкРНК (мкРНК и пивиРНК) в 31 из 54 образцов МЖ, собранных непосредственно перед проведением переноса КЭ. В 15 образцах МЖ женщин с отсутствием имплантации эмбриона и в 16 образцах МЖ женщин с наступившей беременностью было идентифицировано 289 мкРНК и 488 пивиРНК. Из данного списка мнкРНК в программе RStudio путем поэтапного включения и исключения каждой молекулы были найдены оптимальные комбинации мнкРНК-маркеров рецептивного эндометрия в соответствии с их вкладом в построение моделей логистической регрессии (рис. 2), где в качестве зависимой переменной (переменной отклика) выступала степень готовности эндометрия к имплантации (0 – имплантация, 1 – отсутствие имплантации). Все модели, построенные по содержанию мкРНК (рис. 2А) и пивиРНК (рис. 2Б) в МЖ, были статистически значимы и обладали высокой специфичностью (84–100%), а значит, высокой диагностической ценностью наличия рецептивного эндометрия в день переноса КЭ. Более низкие значения чувствительности построенных моделей (65–87%) могут быть обусловлены отсутствием информации об имплантационном потенциале эмбриона, переносимого в полость матки, которую можно получить до этапа криоконсервации на стадии морулы или бластоцисты [7], так как причиной отсутствия имплантации может быть не только нарушение формирования рецептивного эндометрия, но и качество самого эмбриона.
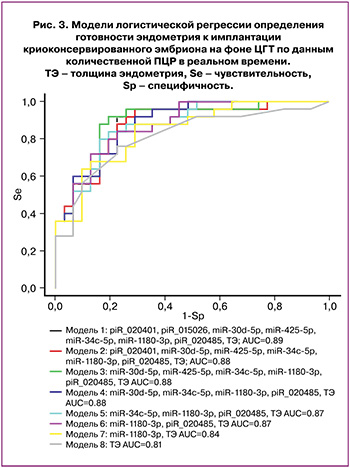
Данные секвенирования были валидированы методом количественной ПЦР в реальном времени на всей выборке пациентов, указанных в таблице 2. По значениям «-ΔСt» для 18 молекул мнкРНК, перечисленных в таблице 1, и величине толщины эндометрия были построены модели логистической регрессии в программе RStudio путем нахождения оптимальной комбинации объясняющих переменных при поэтапном их включении и исключении в соответствии с вкладом в построение модели, где в качестве зависимой переменной (переменной отклика) выступала готовность эндометрия к имплантации эмбриона. Была найдена комбинация из объясняющих переменных (модель 1 рис. 3), имеющая наибольшую площадь под кривой (AUC=0,89) и состоящая из семи мнкРНК и толщины эндометрия. Методом обратного исключения из модели 1 рисунка 3 пошагово удаляли по одной самой незначимой объясняющей переменной с получением моделей 2, 3, 4, 5, 6, 7, где каждая последующая модель является производной от предыдущей (табл. 3). В результирующей модели 7 рисунка 3 все объясняющие переменные оказались статистически значимыми (табл. 3) и независимыми по данным корреляционного анализа по Спирмену (r=0,02; p=0,9). Cпецифичность и чувствительность модели 7 рисунка 3 составила 88 и 71% соответственно, что говорит о высокой диагностической значимости сочетанного измерения уровня miR-1180-3p в МЖ и толщины эндометрия в определении готовности эндометрия к имплантации КЭ в день его переноса. Формула расчета вероятности рецептивного эндометрия для модели 7 рисунка 3 представлена ниже:

где: х1 – ΔCt(miR-1180-3p), х2 – толщина эндометрия (мм).
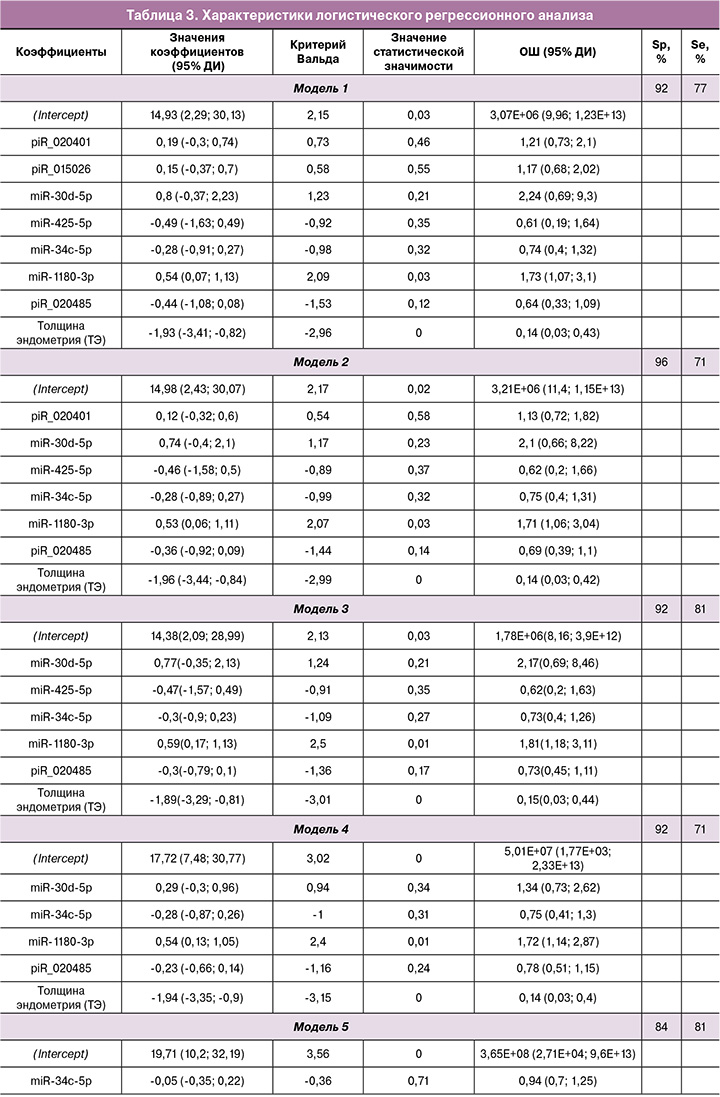
В качестве примера применения модели 7 для оценки изучаемого исхода у восьми случайно выбранных пациенток с конкретными клиническими характеристиками приведена таблица 4.
Важно отметить, что однофакторная модель, включающая лишь толщину эндометрия, обладает меньшей специфичностью для оценки его репептивности (модель 8 рис. 3, Sp=76%), как указано в таблице 3.
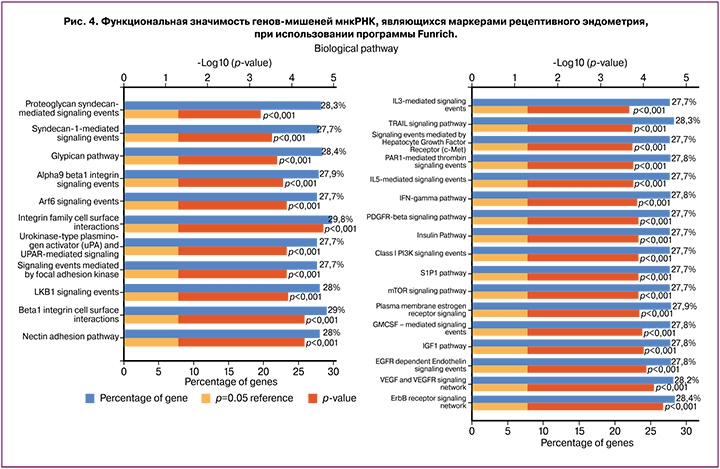
При анализе функциональной значимости мнкРНК, участвующих в моделях рисунка 3, были идентифицированы потенциальные гены-мишени пивиРНК с использованием алгоритма miRanda [8], а гены-мишени мкРНК были найдены в программе Funrich (http://www.funrich.org/). При анализе обогащения сигнальных путей, в которых задействованы выявленные гены-мишени мкРНК и пивиРНК, обнаружено их участие в процессах клеточной адгезии и проведения сигнала внутрь клеток через рецепторы ростовых факторов и интерлейкинов, необходимых для имплантации эмбриона и его последующего роста и развития (рис. 4).
Обсуждение
Существенным недостатком современных методов диагностики рецептивности эндометрия, введенных в клиническую практику (ERA, Igenomix; ER-Map, iGLS; ERPeak, CooperGenomics), является инвазивный способ получения ткани эндометрия, что отменяет перенос эмбриона в том же цикле, что и выполнение биопсии ткани. Известно, что «окно имплантации» открывается в момент резкого изменения транскрипционного профиля в безреснитчатых, но не в реснитчатых эпителиоцитах, и в стромальных фибробластах, трансформирующихся в децидуальные клетки [35]. Поэтому высока вероятность различий соотношения реснитчатых, безреснитчатых эпителиоцитов и стромальных клеток в разных образцах биоптата эндометрия, взятых у одной и той же женщины. Более того, при различных патологических состояниях эндометрия, в том числе хроническом эндометрите, показатель отношения плотности реснитчатых и безреснитчатых эпителиоцитов значимо ниже контрольных значений [36]. Вышеуказанные обстоятельства могут привести к неправильной интерпретации получаемых данных транскриптомного анализа биоптата эндометрия. Кроме того, «окно имплантации» в менструальном цикле во время проведения инвазивного теста может быть сдвинуто относительно «окна имплантации» в последующих циклах переноса эмбриона из-за физиологической межцикловой вариабельности. Поэтому требуется использовать неинвазивный способ анализа рецептивности эндометрия, позволяющий предоставить комплексную оценку трансформации его клеток для обеспечения имплантации эмбриона.
В настоящем исследовании при сочетании методов глубокого секвенирования и количественной ПЦР в реальном времени были идентифицированы внеклеточные мнкРНК в МЖ в день переноса эмбриона, являющиеся маркерами рецептивного эндометрия. Построены модели логистической регрессии в виде комбинации количественных характеристик мнкРНК и толщины эндометрия. Наиболее точной для диагностики рецептивного эндометрия у женщин в день переноса КЭ на фоне ЦГТ оказалась модель сочетанного измерения уровня miR-1180-3p в МЖ и толщины эндометрия ввиду отсутствия зависимости включенных в нее переменных по данным корреляционного анализа по Спирмену (r=0,02; p=0,9) и статистической значимости всех входящих в модель коэффициентов (р<0,05). Ограничением настоящего исследования является малый размер выборки, исходя из формулы N=50+8m, где N – требуемый объем выборки, m – количество независимых переменных [37]. При использовании двух объясняющих переменных (уровень miR-1180-3p в МЖ и толщина эндометрия в день переноса эмбриона, модель 7 рисунка 3) объем выборки приближен к допустимому и отклоняется от референсного показателя меньше чем на 20%. Но для того, чтобы проверить диагностическую значимость исходной модели 1 рисунка 3 с использованием восьми объясняющих переменных, необходимо расширить обучающую выборку до 114 образцов, что мы и планируем сделать в будущем.
При анализе генов-мишеней мнкРНК-маркеров рецептивного эндометрия выявлено, что в основном они участвуют в процессах: 1) адгезии, опосредованные синдеканом-1, нектином, глипиканом, семейством интегринов; 2) протеолиза внеклеточного матрикса посредством активатора плазминогена урокиназного типа; 3) дифференцировки гранулоцитов и моноцитов-макрофагов под действием интерлейкинов-3 и -5, гранулоцитарно-макрофагального колониестимулирующего фактора; 4) иммунных реакциях при участии интерферона гамма; 5) клеточного роста и пролиферации, опосредованных действием тромбоцитарного фактора роста, эпидермального фактора роста, сосудистого ростового фактора, инсулиноподобного фактора роста 1, эстрогена, сфингозин-1-фосфат сигнальной системы; 6) везикулярного транспорта, контролируемого фактором АДФ-рибозилирования. Полученные данные согласуются с результатами секвенирования мРНК эпителиальных и стромальных клеток эндометрия человека в рецептивную стадию относительно прорецептивной стадии секреторной фазы менструального цикла женщин [38]. Авторы работы подчеркивают ключевую роль белков клеточной адгезии (в том числе, галектинов, интегрина бета-1, базигина и остеопонтина), регуляторов секреторных процессов и организации внеклеточного матрикса на начальных этапах имплантации эмбриона, таких как аппозиция, адгезия и инвазия. Построены сети белок-белковых взаимодействий бластоцисты и эндометрия [38–40], где одним из основных белков является интегрин бета-1. В составе мембраны клеток эндометрия интегрин бета-1 взаимодействует с гликопротеином BSG на поверхности трофэктодермы, в которой, в свою очередь, уровень интегрина бета-1 регулируется галектином-3, секретирующимся стромальными и эпителиальными клетками эндометрия, что в конечном итоге и обеспечивает миграцию и инвазию клеток трофобласта [41]. Ввиду участия целого каскада взаимодействующих друг с другом белков в процессе имплантации эмбриона, необходимо до его переноса в полость матки не только оценивать рецептивность эндометрия, но и заранее знать имплантационный потенциал самого эмбриона, ориентируясь не только на его морфологические параметры, но и на молекулярно-биологические характеристики. Важно отметить, что модель логистической регрессии для определения готовности эндометрия к имплантации эмбриона по уровню мнкРНК в день переноса КЭ на фоне ЦГТ была разработана в настоящем исследовании без учета имплантационного потенциала эмбриона, что сказалось на числе ложноотрицательных результатов (29%). В предыдущих исследованиях нами были разработаны модели логистической регрессии для определения имплантационного потенциала эмбриона по уровню мнкРНК в среде его культивирования на стадии морулы и бластоцисты в цикле контролируемой овариальной стимуляции [7] с целью дальнейшего переноса в полость матки или криоконсервации качественного эмбриона. Поэтому в дальнейшем для улучшения диагностической способности построенных моделей планируется одновременная оценка рецептивности эндометрия и имплантационного потенциала эмбриона по профилю мнкРНК.
Значимость разработанных нами моделей подтверждается литературными данными о потенциальной роли входящих в них мкРНК (miR-30d-5p, miR-425-5p, miR-34c-5p, miR-1180-3p) в процессах, ассоциированных с имплантацией эмбриона. Роль семейства miR-30 в формировании рецептивного эндометрия выявлена в различных исследованиях [42–44]; в частности, наблюдали повышение экспрессии miR-30d-5p в период окна имплантации [43]. Напротив, при повторных неудачах имплантации обнаружено резкое снижение уровня экспрессии miR-30d-5p и повышение уровня экспрессии гена-мишени супрессора передачи сигнала цитокинов 1 (SOCS1) в эндометрии на 7-е сутки после пика лютеинизирующего гормона [45]. На мышиных моделях, нокаутных по miR-30d-5p, продемонстрировано влияние дефицита miR-30d-5p в эндометрии и у эмбриона на имплантацию и последующее фетальное развитие [46]. В других исследованиях доказана роль miR-425-5p в регуляции клеточной пролиферации, миграции и инвазии и выявлен повышенный уровень ее экспрессии в тканях различных опухолей, в том числе карциноме почек [47], гепатоклеточной карциноме [48], раке шейки матки [49], раке желудка [50]. miR-34c-5p, являясь ингибитором эпителиально-мезенхимального перехода, клеточной инвазии и миграции путем подавления уровня экспрессии гена-мишени Notch1, вовлечена в патогенез эндометриоза при снижении уровня ее экспрессии в эктопическом эндометрии [51]. Значительное подавление экспрессии miR-34c-5p в эутопическом эндометрии отмечают в период «окна имплантации», в течение которого резко повышается уровень белка гена-мишени GAS, необходимого для имплантации эмбриона; в то время как дефицит экспрессии GAS1 обнаружен в эндометрии женщин с неоднократными неудачами имплантации в сравнении с рецептивным эндометрием [52]. miR-1180-3p рассматривают в качестве супрессора многих эпителиальных опухолей, в том числе рака мочевого пузыря [53], рака поджелудочной железы [54], колоректального рака [55], и повышенный уровень экспрессии miR-1180-3p обусловливает снижение пролиферации и подвижности раковых клеток путем воздействия на ген-мишень COL12A1 [55].
Заключение
Индивидуализация подхода в определении «окна имплантации» при проведении ЭКО на фоне ЦГТ в соответствии с уровнем мнкРНК в МЖ может играть важную роль в повышении эффективности программ ВРТ. Ограничением использования в клинической практике модели логистической регрессии, построенной в настоящем исследовании на обучающей выборке пациенток, является отсутствие информации об имплантационном потенциале переносимой в полость матки бластоцисты. Отрицательный исход программы ВРТ может быть обусловлен не отсутствием рецептивного эндометрия, а сниженным качеством самого эмбриона. Одновременное определение рецептивности эндометрия и имплантационного потенциала эмбриона по профилю мнкРНК приведет к снижению процента ложноотрицательных результатов и улучшению качества модели. Точность построенных моделей необходимо проверять на независимой тестовой выборке.



