Возрастное снижение овариального резерва (ОР) характеризуется уменьшением количества антральных фолликулов по данным ультразвукового исследования (УЗИ), увеличением уровня фолликулостимулирующего гормона (ФСГ) и снижением уровня антимюллерова гормона (АМГ) в сыворотке крови. Зачастую, независимо от паспортного возраста, низкий ОР ассоциируется с процессами, наблюдаемыми при старении яичников, такими как увеличение количества анеуплоидных эмбрионов, снижение оплодотворяющей способности и высокие показатели потери беременности на различных сроках гестации [1–4]. Постепенное снижение фертильности с возрастом характеризуется количественным и качественным изменениями ооцитов [5]. Считается, что определяющими показателями процессов истощения фолликулярного пула с возрастом являются его исходный размер и скорость процессов атрезии фолликулов, в которых важную роль играют митохондрии. Например, ряд зарубежных авторов, проведя исследования на животных моделях, предположили, что первоначальный размер фолликулярного пула, определяющийся в период внутриутробного развития плода женского пола, зависит, в том числе, и от митохондриального биогенеза [5–7]. Распределение молекул митохондриальной ДНК (мтДНК) во время деления оогониев происходит случайным образом, что может привести к появлению ооцитов, содержащих перестройки мтДНК. Соответственно, происходят изменения функционирования митохондрий ооцитов с мутантными мтДНК, что, как предполагается, запускает процесс фолликулярной атрезии, элиминируя первичные ооциты, несущие мутации мтДНК. Данная теория также объясняет возможный патогенез развития преждевременной недостаточности яичников [8].
Другим спорным вопросом остается причина снижения качества ооцитов у женщин позднего репродуктивного возраста. В мировой литературе имеется большое количество гипотез, среди которых главенствующую роль занимают окислительный стресс, нарушение микроциркуляции, гипоксические процессы в фолликулярной жидкости [9, 10]. Однако в последнее время появляется все больше публикаций, указывающих на взаимосвязь возрастного снижения качества ооцитов с митохондриальной дисфункцией [11]. Митохондрии, являясь важнейшими органеллами, наследуемыми по материнской линии, генерируют подавляющее большинство клеточного аденозинтрифосфата, а также являются единственными органеллами, имеющими собственную ДНК. Предполагается, что исходное количество митохондрий и мтДНК может определять энергетический потенциал ранних эмбрионов, до третьих суток развития, так как на данной стадии эмбриогенеза отсутствует репликация мтДНК. Полноценная репликация мтДНК начинается на стадии бластоцисты (пятидневного эмбриона), когда увеличивается потребность в энергии для последующего успешного деления [12–14]. На животных моделях (ооциты мышей, свиней) было доказано, что успешно оплодотворялись те ооциты, которые содержали большее количество мтДНК, чем ооциты со сниженной копийностью мтДНК [15, 16]. Однако определение уровня мтДНК ооцитов человека по этическим соображениям невозможно, в связи с чем проводятся исследования клеток кумулюса (КК), что считается одним из лучших неинвазивных подходов для оценки метаболических процессов, лежащих в основе качества ооцитов и потенциала развития эмбрионов. В частности, взаимодействия ооцит-кумулюсного комплекса (OКК) координируют метаболизм углеводов, липидов и белков для обеспечения надлежащего энергетического баланса, необходимого для мейоза и оплодотворения яйцеклетки, а также для поддержания раннего эмбриогенеза. Митохондрии КК являются центральными агентами энергетических метаболических путей, непосредственно участвуют в становлении компетенции ооцитов во время оогенеза [17, 18]. Например, M.Ogino и соавт. [11] выявили существенную связь между содержанием мтДНК в КК и морфологическим качеством бластоцист. Среднее содержание мтДНК КК для эмбрионов хорошего и низкого качества составило 140 относительных единиц (о.е.) и 57 о.е. соответственно (р<0,0001). Desquiret-Dumas V. и соавт. [18] также подтвердили статистически значимую связь между копийностью мтДНК в КК и морфологическим качеством эмбрионов. В этом исследовании повышенная копийность мтДНК была ассоциирована с эмбрионами отличного качества, по сравнению с эмбрионами хорошего или низкого качества, медиана 738 (250–1228) о.е. и 342 (159–818) о.е. соответственно (р=0,006). По данным Taugourdeau A. и соавт. [19], имеет место значительно более высокий уровень мтДНК в КК в группе имплантировавшихся эмбрионов, чем неимплантировавшихся, в среднем 215 о.е. и 59 о.е. соответственно (p<104).
Таким образом, определение копийности мтДНК в КК может стать потенциальным маркером как качества ооцитов, так и эмбрионов, а также их имплантационного потенциала.
Цель исследования – оценить показатели копийности мтДНК в КК у пациенток позднего репродуктивного возраста, проходящих лечение в программах экстракорпорального оплодотворения (ЭКО) с преимплантационным генетическим тестированием на анеуплоидии (ПГТ-А), и проанализировать взаимосвязь исследуемых показателей с параметрами оогенеза, эмбриогенеза и исходами лечения.
Материалы и методы
Исследование было проведено в 1-м гинекологическом отделении и в лаборатории молекулярно-генетических методов ФГБУ «НМИЦ акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России. В исследование были включены 454 ОКК 67 пациенток в возрасте 35-45 лет, проходивших лечение бесплодия методом ЭКО/интрацитоплазматической инъекции сперматозоидов (ИКСИ) с последующим преимплантационным генетическим тестированием на анеуплоидии (ПГТ-А) полученных эмбрионов. В исследование были включены пациентки, соответствующие следующим критериям: возраст 35–45 лет; индекс массы тела 18–29 кг/м2; базальный уровень ФСГ крови ≤15 МЕ/мл; отсутствие наружного генитального эндометриоза III–IV степени, миомы матки больших размеров, синдрома поликистозных яичников; нормальный кариотип супругов. В исследование не включены курящие пациентки, а также пациенты с тяжелой формой тератозооспермии (более 96% сперматозоидов с аномальной морфологией, согласно критериям ВОЗ).
Пациентки были обследованы согласно Приказу МЗ РФ от 30 августа 2012 г. №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Стимуляция функции яичников проводилась в протоколе с антагонистами гонадотропин-рилизинг-гормона (ГнРГ) с применением препаратов рекомбинантного ФСГ или человеческого менопаузального гонадотропина, а также корифоллитропина альфа. Подбор дозы осуществлялся индивидуально, исходя из параметров овариального резерва. Триггер овуляции вводили при наличии в яичниках 3 и более фолликулов диаметром 18 мм. В качестве триггера использовали человеческий хорионический гонадотропин или агонист ГнРГ. Трансвагинальная пункция яичников проводилась через 35–36 ч после введения триггера овуляции под контролем УЗИ.
КК отделяли от ОКК при помощи тонких игл, помещали в пробирку типа эппендорф и замораживали при -80°C для последующего анализа копийности мтДНК. После проведения процедуры ИКСИ эмбрионы культивировались до стадии бластоцисты. Всем эмбрионам 5–6 суток развития производили биопсию трофэктодермы (ТЭ) с целью проведения ПГТ-А методом сравнительной геномной гибридизации. Морфологическая оценка эмбрионов стадии бластоцисты была проведена согласно классификации Гарднера (степень зрелости бластоцист, качество внутриклеточной массы (ВКМ) и качество ТЭ) [20]. Учитывая морфологические характеристики, эмбрионы были разделены на 3 группы: отличного качества – бластоцисты с ВКМ категории А и качеством ТЭ категории А-В; хорошего качества – бластоцисты с ВКМ категории В и качеством ТЭ категории В-С; плохого качества – ранние бластоцисты, бластоцисты с ВКМ категории С и качеством ТЭ категории С, которые не подвергались ПГТ-А.
Относительная количественная оценка копийности мтДНК проводилась с использованием полимеразной цепной реакции (ПЦР) в режиме реального времени. В реакции использованы специально разработанные олигонуклеотиды и TaqMan-пробы для амплификации и количественного определения специфических фрагментов мтДНК (ген MT-ND2 – mitochondrially encoded NADH dehydrogenase 2 и ген MT-ND4 – mitochondrially encoded NADH dehydrogenase 4). Нормировка осуществлялась на геномную ДНК (ген LTC4S - leukotriene C4 synthase). Использование олигонуклеотидов (праймеров) к гену MT-ND2 позволило оценить содержание тотального пула мт ДНК (mtDNAtotal), а праймеров к гену MT-ND4 – содержание пула полноразмерной мтДНК, лишенной больших делеций (mtDNAdel-), включающих ген MT-ND4, например del mtDNA4977, mtDNA7436, mtDNA7345, mtDNA8041.
TaqMan-пробы для фрагментов митохондриальной и геномной ДНК были помечены разными флуорофорами (FAM и HEX), что позволило проводить реакцию в одной пробирке (мультиплексная ПЦР) в двух повторах для каждого образца. Для обеспечения «горячего старта» использован парафин. В работе использованы реактивы и детектирующие амплификаторы «ДТпрайм» (ООО «ДНК-Технология», Россия) в соответствии с инструкциями и рекомендациями производителя. Режим амплификации: 80° С в течение 1 мин, инкубирование при 95° С в течение 1 мин, а затем 50 циклов: 94° С в течение 15 с и 64° С в течение 20 с с измерением уровня флуоресценции на каждом цикле.
Количество мтДНК относительно геномной определяли методом сравнения пороговых циклов (2∆Ср) и представляли в о.е. по формуле 1: mtDNA/gDNA = 2Cp gDNA-Cp mtDNA , где Cp gDNA – значение порогового цикла амплификации геномной ДНК; Cp mtDNA – значение порогового цикла амплификации мтДНК.
Все КК, включенные в исследование, были разделены на 2 группы, в зависимости от показателей уровня АМГ пациенток: группа А (n=251) – ооциты, полученные у пациенток с уровнем АМГ >1; группа Б (n=203) – ооциты, полученные у пациенток с уровнем АМГ <1.
После оплодотворения 454 ооцитов методом ИКСИ прокультивировано 130 эмбрионов до 5–6 суток развития. По результатам ПГТ-А, из 130 полученных эмбрионов 56 диагностированы как анеуплоидные и 74 – как эуплоидные. Перенесенные эуплоидные эмбрионы (n=51) были поделены на 2 группы: 1-я группа – имплантировавшиеся эмбрионы (n=21), 2-я группа – неимплантировавшиеся эмбрионы (n=30).
Количественные данные после определения вида распределения (нормальное или ненормальное) были представлены в виде средних значений со стандартным отклонением M (SD) с применением параметрической статистики (t-тест) или медиан с интерквартильным размахом (Me (Q1;Q3)) с применением методов непараметрической статистики (тест Манна–Уитни). Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена, а также с использованием параметрического критерия Пирсона при нормальном типе распределения данных. Статистически значимыми считались результаты при уровне р<0,05. Статистическая обработка данных выполнена с помощью электронных таблиц Microsoft Excel и пакета прикладных программ SPSS Statistics 17.0.
Результаты и обсуждение
Были получены 454 ОКК 67 пациенток позднего репродуктивного возраста. Средний возраст пациенток в данном исследовании составил 37,8 (2,1) года, среднее значение уровня АМГ в крови – 2,66 (1,09) нг/мл. Более подробно когорта пациенток, вошедших в исследование, описана в табл. 1.

Результаты, полученные с использованием праймеров к генам MT-ND2 и MT-ND4, были полностью идентичны, что свидетельствует об отсутствии в КК исследуемой когорты пациенток крупных делеций мтДНК, включающих ген MT-ND4.
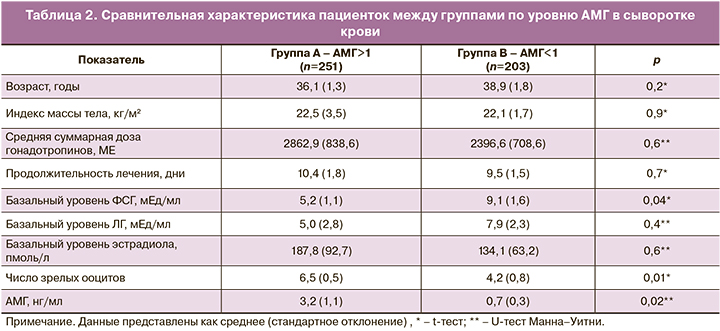
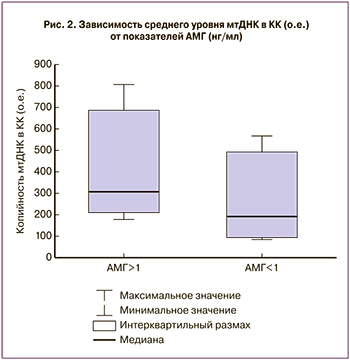 Была выявлена отрицательная корреляция между средним уровнем мтДНК в КК и возрастом пациенток (r=-0,142, p=0,008) (рис. 1). Соответственно, по мере увеличения возраста отмечалось снижение копийности мтДНК в КК. Стоит отметить, что в нашем исследовании возраст 39 лет являлся пороговым, при котором копийность мтДНК в КК снижалась в 1,5 раза по сравнению с пациентками в возрастном диапазоне 35–38 лет. Кроме того, относительные показатели копийности мтДНК в КК коррелировали с уровнем АМГ в сыворотке крови (r=0,139; p=0,003). При разделении выборки по группам в соответствии со значением АМГ не наблюдалось статистически значимых различий в распространенности экстрагенитальных и гинекологических заболеваний, индексе массы тела, возрасте, суммарной дозе гонадотропинов, продолжительности лечения (табл. 2). Уровень АМГ в группе А составил 3,2 (1,1) нг/мл, в группе Б – 0,7 (0,3) нг/мл (p=0,02) (табл. 2). Копийность мтДНК в КК, полученных у пациенток с уровнем АМГ более 1 нг/мл, была статистически значимо выше, чем в группе Б (369 (203;696) о.е. и 210 (98;597) о.е. в группах А и Б соответственно; p=0,001) (рис. 2). Число зрелых ооцитов было ниже в группе Б по сравнению с группой А (4,2 (0,8) и 6,5 (0,5) в группах А и Б соответственно (p=0,01).
Была выявлена отрицательная корреляция между средним уровнем мтДНК в КК и возрастом пациенток (r=-0,142, p=0,008) (рис. 1). Соответственно, по мере увеличения возраста отмечалось снижение копийности мтДНК в КК. Стоит отметить, что в нашем исследовании возраст 39 лет являлся пороговым, при котором копийность мтДНК в КК снижалась в 1,5 раза по сравнению с пациентками в возрастном диапазоне 35–38 лет. Кроме того, относительные показатели копийности мтДНК в КК коррелировали с уровнем АМГ в сыворотке крови (r=0,139; p=0,003). При разделении выборки по группам в соответствии со значением АМГ не наблюдалось статистически значимых различий в распространенности экстрагенитальных и гинекологических заболеваний, индексе массы тела, возрасте, суммарной дозе гонадотропинов, продолжительности лечения (табл. 2). Уровень АМГ в группе А составил 3,2 (1,1) нг/мл, в группе Б – 0,7 (0,3) нг/мл (p=0,02) (табл. 2). Копийность мтДНК в КК, полученных у пациенток с уровнем АМГ более 1 нг/мл, была статистически значимо выше, чем в группе Б (369 (203;696) о.е. и 210 (98;597) о.е. в группах А и Б соответственно; p=0,001) (рис. 2). Число зрелых ооцитов было ниже в группе Б по сравнению с группой А (4,2 (0,8) и 6,5 (0,5) в группах А и Б соответственно (p=0,01).
В данном исследовании не обнаружена связь между содержанием мтДНК в КК и зрелостью или частотой оплодотворения ооцитов. Также в нашем исследовании не было выявлено статистически значимой связи между уровнем мтДНК в КК и морфологической оценкой эмбрионов 5–6 суток развития (р=0,7). Кроме того, не наблюдалось различий в уровнях мтДНК в КК и плоидности эмбрионов: 356 о.е. и 325 о.е. для эуплоидных и анеуплоидных бластоцист соответственно (р>0,05). Однако была выявлена тенденция к снижению копийности мтДНК между группой имплантировавшихся и неимплантировавшихся эмбрионов – 390 (40) о.е. и 299 (32) о.е. в 1-й группе и во 2-й группе соответственно (р=0,08).
Учитывая полученные результаты, можно предположить, что низкая копийность мтДНК в КК, вероятно, отражает возрастное снижение как количества, так и качества ооцитов. Это согласуется с данными Boucret L. и соавт. [21], изучавших копийности мтДНК в КК пациенток с нормальным и сниженным овариальным резервом. При этом группу «низкого овариального резерва» составляли пациентки как позднего репродуктивного возраста, так и пациентки с преждевременной недостаточностью яичников. В группе «нормального овариального резерва» уровень мтДНК в КК был статистически выше, чем в группе «низкого овариального резерва» (p=0,02).
В нашем исследовании, так же как и в исследовании Taugourdeau A. и соавт. [19], не было выявлено статистически значимой связи копийности мтДНК в КК с морфологическим качеством бластоцист. Однако Ogio M. и соавт. [11] при ранжировании бластоцист на 2 группы, плохого (<3ВВ) и хорошего (3ВВ) качества, получили статистически значимую разницу в копийности мтДНК между изучаемыми группами (p<0,0001). В нашем исследовании и в исследовании Taugourdeau A. и соавт. [19] эмбрионы 5–6 суток были разделены на 3 группы: отличного, хорошего, плохого качества, что могло повлиять на отсутствие корреляции исследуемых параметров. Также в проведенном нами исследовании не было выявлено статистически значимой связи между копийностью мтДНК в КК и плоидностью полученных эмбрионов, что согласуется с результатами зарубежных авторов [18, 19, 21]. Отсутствие корреляции между мтДНК в КК и плоидностью бластоцист отличного и хорошего качества объясняется тем, что в ооцитах имеется достаточное количество митохондрий и мтДНК, которое обеспечивает необходимый уровень энергии для последующего развития эмбрионов до стадии бластоцисты. Однако мутации в материнских генах, связанные с мейозом или митозом, наследование аберрантной материнской РНК, а также накопленные мутации мтДНК могут приводить к нарушению сегрегации хромосом и делению клеток, что ведет к возникновению анеуплоидий. Соответственно, сниженная копийность мтДНК и митохондриальный потенциал ОКК не всегда являются определяющими в развитии анеуплоидии.
Интересно, что в нашем предыдущем исследовании, направленном на изучение уровня мтДНК в ТЭ бластоцист, было выявлено статистически значимое увеличение уровня мтДНК в ТЭ анеуплоидных эмбрионов по сравнению с эуплоидными (p=0,003) [22]. Этот факт подтверждает предположение об аномальном увеличении мтДНК в клетках ТЭ во время эмбриогенеза с целью компенсации дефектного митохондриального пула в конце оогенеза [7].
Кроме того, по результатам нашего исследования выявлена тенденция к статистически значимой связи уровня мтДНК и потенциала имплантации эмбрионов. Согласно данным Taugourdeau A. и соавт. [19], копийность мтДНК в КК в группе имплантировавшихся эмбрионов значительно выше, чем в группе неимплантировавшихся (p<10-4).
Таким образом, авторы сделали вывод, что количество мтДНК в КК может являться определяющим фактором успешного развития и имплантации эмбрионов. Возможно, отсутствие сильной корреляции между уровнем мтДНК в КК и имплантационным потенциалом эуплоидных бластоцист в нашем исследовании связано с меньшим числом перенесенных эмбрионов (n=51) по сравнению с результатами Taugourdeau A. и соавт. [19] (n=84).
В отечественной и мировой литературе имеется большое количество данных о связи количества мтДНК в КК с ИМТ, а также с курением [18, 23]. Высокие значения ИМТ связаны с дисфункцией митохондрий и снижением числа копий мтДНК, однако не было выявлено корреляции с ухудшением качества эмбрионов. У курящих пациенток, наоборот, содержание мтДНК в КК компенсаторно увеличено. Соответственно, определение уровня мтДНК в КК у курящих пациенток и/или пациенток с избыточным ИМТ нецелесообразно, учитывая, что данный метод зависит от индивидуальных особенностей пациенток. Исходя из этого, в настоящее исследование не были включены курящие пациентки и пациентки с высоким ИМТ; тем не менее, несмотря на нивелирование влияния пациент-специфических факторов, не удалось определить пороговый уровень копийности мтДНК, прогнозирующий количество или качество эмбрионов и их способность к имплантации.
Заключение
Результаты настоящего исследования позволяют предположить, что уровень мтДНК в КК ассоциирован со снижением как количества, так и качества ооцитов. Определение копийности мтДНК в КК может стать достоверным биомаркером старения репродуктивной системы, учитывая, что паспортный возраст не всегда отражает истинный фертильный потенциал женщин. Также определение уровня мтДНК в КК может стать возможным предиктором имплантационного потенциала эмбрионов.



