В настоящее время сохраняется тенденция к позднему замужеству и деторождению, что связано с инверсией социального положения женщин в большинстве стран мира. Так, получение высшего образования, карьерный рост, достижение финансовой независимости и определенного общественного статуса становятся приоритетными целями современных женщин, что приводит к отсроченному деторождению. Неудивительно, что на данный момент сохраняется тенденция обращения женщин позднего репродуктивного возраста по поводу лечения бесплодия, учитывая, что реализация репродуктивной функции с возрастом имеет ряд сложностей. Так у женщин старше 35 лет происходит резкое снижение овариального резерва [1], а после 40 лет скорость атрезии фолликулов увеличивается вдвое [2]. Статистический анализ рождаемости, проведенный Smith KE, Buyalos RP, показал, что 38 лет является пограничным возрастом, при достижении которого, частота живорождения снижается в два раза, по сравнению с этим показателем у женщин моложе 35 лет [3]. Кроме того, группа женщин позднего репродуктивного возраста часто имеет отягощенный соматический и гинекологический анамнез. Однако основной причиной снижения фертильности в данной группе пациенток является снижение качества ооцитов и, как следствие, эмбрионов [4]. По данным ряда зарубежных авторов, хромосомные аномалии выявляются в 50% случаев репродуктивный потерь у женщин моложе 35 лет, в то время как у женщин старше 35 лет – в 75% [5, 6]. При проведении преимплантационного генетического тестирования (ПГТ) эмбрионов у женщин позднего репродуктивного возраста выявлено, что около 80% диагностированных эмбрионов были анеуплоидными [6–8]. Оценка качества эмбрионов является ключевой составляющей успеха в программах вспомогательных репродуктивных технологий (ВРТ). Существующие методы селекции эмбрионов основаны на детальной морфологической, а также генетической оценке эмбрионов при помощи ПГТ. Однако эффективность программ ВРТ составляет около 63–64% на цикл переноса размороженных эмбрионов [9]. По данным Fiorentino F., Rubio C. (2014, 2017), перенос морфологически нормальной и генетически диагностированной эуплоидной блатоцисты не приводит к наступлению беременности в 30% случаев [10, 11]. Эти данные показывают, что перенос эуплоидной бластоцисты отличного качества, все еще не может гарантировать наступление беременности. Поэтому, необходимы дополнительные методы селекции эмбрионов. В этой связи большое значение в последние годы придается митохондриальной функции гамет и эмбрионов.
Метаболические показатели и содержание аденозинтрифосфата (АТФ) ооцитов и эмбрионов человека значительно различаются [11]. Предполагается, что способность ооцита к оплодотворению, а также способность поддерживать развитие эмбриона зависят от содержания АТФ в ооците [11, 12]. Митохондрии являются клеточными органеллами, ответственными за синтез АТФ путем окислительного фосфорилирования (OXPHOS). Они также участвуют в регуляции кальциевого гомеостаза, контролируют клеточный метаболизм, пролиферацию и процессы апоптоза [13, 14].
Отличительной особенностью митохондрий от других клеточных органелл является наличие митохондриальной ДНК (мтДНК); мтДНК человека кодирует 13 полипептидов, участвующих в построении четырех комплексов транспортной цепи электронов (I, III, IV и V). Наследование митохондрий и их генома происходит исключительно по материнской линии, в то время как митохондрии сперматозоида, которые попадают в ооцит, подвергаются деградации и утилизации аутофагосомами [15].
Как только оплодотворение завершается и начинается митотическое деление, митохондрии, полученные из ооцита, распределяются по вновь образованным бластомерам. Следует отметить, что на ранних стадиях развития эмбриона, в течение первых трех суток преимплантационного развития, не происходит репликации мтДНК, и ключевые клеточные процессы, выполняемые митохондриями, включая продукцию АТФ, полностью поддерживаются популяцией органелл, полученных из ооцита [11].
Полноценная репликация мтДНК начинается на стадии бластоцисты, когда необходим адекватный уровень энергии для успешного деления. На данном этапе происходит переход от анаэробного пути метаболизма энергии, который наблюдался на ранних стадиях эмбриогенеза, к аэробному (окислительное фосфорилирование) [13, 14].
В ряде работ по изучению взаимосвязи между потенциалом имплантации, морфологической оценкой и хромосомным набором бластоцисты, а также возрастом пациенток и содержанием мтДНК в кумулюсных клетках ооцитов и трофэктодерме бластоцист, была показана статистически значимая корреляция [11, 12, 16–22]. Например, в исследовании Fragouli E. et al. (2015) был определен имплантационный потенциал эуплоидных бластоцист по уровню мтДНК, который составил 0,003 о.е. Так, имплантировавшиеся эмбрионы имели уровни мтДНК ниже порогового значения, в то время как бластоцисты с относительным количественным уровнем мтДНК выше 0,003 o.e., не имплантировались [16]. В более поздних исследованиях данных авторов, произошло изменение порогового уровня с 0,003 о.е. до 0,0004 о.е., что связано с методикой определения копийности мтДНК. Однако, результат исследования подтвердил выявленную ранее корреляцию между потенциалом к имплантации и уровнем мтДНК в трофэктодерме бластоцист [11]. Кроме того, в исследованиях Fragouli E. et al., 2015, Ravichandran K. et al., 2017, Wells D. et al., 2017, было выявлено статистически значимое увеличение копийности мтДНК в трофэктодерме в группе пациенток позднего репродуктивного возраста (старше 35 лет), по сравнению с младшей возрастной группой (р=0,003) [11, 16, 17]. Также, в исследованиях была доказана связь уровня мтДНК с плоидностью бластоцист, в анеуплоидных эмбрионах копийность мтДНК была статистически выше, чем в эуплоидных (р=0,025) [11, 14, 16, 17, 22]. Таким образом, было предложено использование оценки копийности мтДНК в клетках трофэктодермы бластоцист в качестве дополнительного маркера жизнеспособности эмбрионов, с целью повышения эффективность лечения бесплодия.
На основании представленных данных нами было проведено пилотное исследование количества мтДНК в клетках трофэктодермы, позволившее изучить взаимосвязь между копийностью мтДНК и возрастом пациенток, а также морфологией, плоидностью эмбриона и его имплантационным потенциалом. Также предложена методология определения уровня мтДНК, с целью улучшения исходов программ ВРТ.
Цель исследования: повышение эффективности программ экстракорпорального оплодотворения (ЭКО) путем переноса эуплоидных эмбрионов с нормальным уровнем мтДНК в трофэктодерме.
Материал и методы исследования
Исследование было проведено в 1 гинекологическом отделении ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» МЗ РФ и в лаборатории молекулярно-генетических методов. В исследование было включено 106 эмбрионов, полученных от 50 супружеских пар. Пациентки соответствовали следующим критериям включения: возраст 25–45 лет, индекс массы тела 18 – 29 кг/м2, базальный уровень ФСГ крови ≤15 МЕ/мл; отсутствие наружного генитального эндометриоза III-IV степени, миомы матки больших размеров, СПКЯ; нормальный кариотип супругов. В исследование не включены пациенты с тератозооспермией (более 96% сперматозоидов с аномальной морфологией согласно критериям ВОЗ).
Пациенткам было проведено полное клинико-лабораторное обследование в соответствии с Приказом МЗ РФ от 30 августа 2012 г. №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Для стимуляции функции яичников применялся протокол с антагонистами гонадотропин-рилизинг-гормона с применением препаратов рекомбинантного ФСГ или человеческого менопаузального гонадотропина. Подбор дозы осуществлялся индивидуально, исходя из параметров овариального резерва. Триггер овуляции вводили при наличии в яичниках 3 и более фолликулов диаметром 17 мм. В качестве триггера использовались либо человеческий хорионический гонадотропин, либо агонист гонадотропин-рилизинг-гормона. Трансвагинальная пункция яичников проводилась через 36 часов после введения триггера овуляции. Пациентки были разделены на 2 возрастные группы. Средний возраст пациенток I группы (контрольная группа) составил 32±2,8 лет (25–34 лет), II группы – 38,6 ±3,6 лет (35–45 лет).
После проведения процедуры ИКСИ и культивирования эмбрионов до стадии бластоцисты, производили биопсию трофэктодермы с целью проведения ПГТ на анеуплоидии (ПГТ-А) методом сравнительной геномной гибридизации на чипе (aСGH). Морфологическая оценка эмбрионов стадии бластоцисты была проведена согласно классификации Гарднера [21].
aСGH генетического материала эмбриона проводили на оборудовании фирмы «Agilent» (США). Полногеномную амплификацию клеточной ДНК методом WGA-PCR (Whole Genome Amplification–Polymerase Chain Reaction) выполняли с помощью набора PicoPlex SingleCell WGA Kit («Rubicon Genomics», США) и набора GenetiSure Pre-Screen Amplification and Labeling Kit («Agilent», США) в случае MDA (Multiple Displacement Amplification). Качество и количество полученной ДНК контролировали с помощью электрофореза в 1,2%-ном агарозном геле. Ампликоны метили с использованием набора SureTag DNA labeling Kit («Agilent») согласно инструкции фирмы. Меченые ампликоны наносили на биочип Sure Print G3 8x60 aCGH Agilent, гибридизовали в течение 16 ч, после чего отмывали и сканировали на сканере биологических чипов SureScan Microarray Scanner. Интерпретацию результатов проводили с помощью программного продукта Agilent CytoGenomics. Затем, полученные ампликоны разводились в соотношении 1:50 и передавались для измерения копийности мтДНК.
Относительная количественная оценка копийности мтДНК проводилась с использованием полимеразной цепной реакции в режиме реального времени (ПЦР-РВ). В реакции использованы специально разработанные олигонуклеотиды и TaqMan-пробы для амплификации и количественного определения специфического фрагмента мтДНК (ген MT-ND2 mitochondrially encoded NADH dehydrogenase 2). Нормировка осуществлялась на геномную ДНК (ген LTC4S – leukotriene C4 synthase). TaqMan-пробы для фрагментов митохондриальной и геномной ДНК были помечены разными флуорофорами (FAM и HEX), что позволило проводить реакцию в одной пробирке (мультиплексная ПЦР), реакция проведена в двух повторах для каждого образца. Для обеспечения «горячего старта» использован парафин. В работе использованы реактивы и детектирующие амплификаторы «ДТпрайм» (ООО «ДНК-Технология», Россия) в соответствии с инструкциями и рекомендациями производителя. Режим амплификации: 80°С в течение 1 мин, при 95°С в течение 1 мин, а затем 50 циклов: 94° С в течение 15 сек и 64°С в течение 20 сек с измерением уровня флуоресценции на каждом цикле.
Количество мтДНК относительно геномной определяли методом сравнения пороговых циклов (2∆Ср) и представляли в относительных единицах (о.е.).
Пороговые значения мтДНК установлены с использованием ROC-анализа при сравнении образцов трофэктодермы имплантировавшихся и неимплантировавшихся эмбрионов, с площадью под ROC-кривой (AUC) > 0,80, что говорит о высокой точности. При нормальном виде распределения данных применяли методы параметрической статистики (t-тест для сравнения данных в 2-х группах). При ненормальном распределении данных для оценки различий в группах применяли методы непараметрической статистики (точный критерий Фишера). Статистически значимыми считались различия при р<0,05 (95% уровень значимости), при р<0,01 (99% уровень значимости). Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц «Microsoft Excel» и пакета прикладных программ «SPSS Statistics 17.0».
Результаты исследования и обсуждение
При анализе распространенности соматических и гинекологических заболеваний статистически значимых различий между группами выявлено не было. Средний возраст пациенток I группы составил 32±2,8 лет (25–34 лет), II группы – 38,6±3,6 лет (35–45 лет). Средняя суммарная доза гонадотропинов была достоверно выше в группе пациенток позднего репродуктивного возраста, чем в группе молодых пациенток (1398,3±207 МЕ и 2508,1±480 МЕ, в I и во II группе соответственно, (р=0,03)). Продолжительность лечения в I группе была статистически значимо ниже, чем во II группе (9,02±1,2 и 12,7±1,3 дней в I и во II группе соответственно, р=0,02). Показатель числа зрелых ооцитов в группе пациенток позднего репродуктивного возраста был достоверно ниже, чем в I группе (7,2±1,0 и 4,4±0,9 в I и во II группе соответственно, р=0,04).
При проведении генетического анализа 106 эмбрионов методом aCGH, 38 бластоцист были диагностированы как анеуплоидные, 68 – как эуплоидные. Для определения копийности мтДНК использовались продукты полногеномной амплификации. Произведен перенос 41 эуплоидной бластоцисты. Из них 27 привели к беременности (27/41), частота наступления беременности составила 65,8% (таблица). Проведенный ROC анализ позволил установить пороговое значение уровня мтДНК, составившее 0,004 о.е., превышение которого предвещало неудачу имплантации с чувствительностью 76,8% и специфичностью 74,9%, площадь под ROC- кривой составила 0,823 (95% ДИ, 0,710–0,935), что говорит о высокой прогностической силе. Из общего числа перенесенных эмбрионов у 32 бластоцист уровень мтДНК был ниже выявленного порогового значения, таким образом, частота имплантации для эуплоидных эмбрионов с подпороговым уровнем мтДНК составила 84,4% (27/32) (95% ДИ: 0,710–0,97) (таблица). В то время как не зарегистрировано ни одного случая успешной имплантации эуплодной бластоцисты с уровнями мтДНК выше установленного порогового значения (р<0,0001). Таким образом, отрицательная прогностическая ценность метода определения копийности мтДНК в этой когорте составляла 100% (9/9) (95%ДИ: 93–100%).
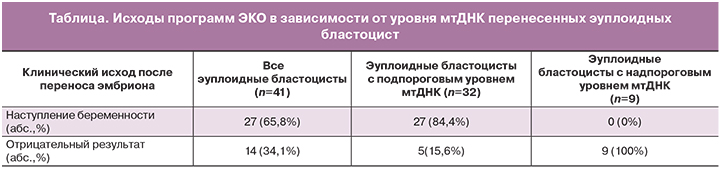
Таким образом, неудачи имплантации при переносе эуплоидных эмбрионов, возможно, ассоциированы с аномально высокой копийностью мтДНК эмбрионов.
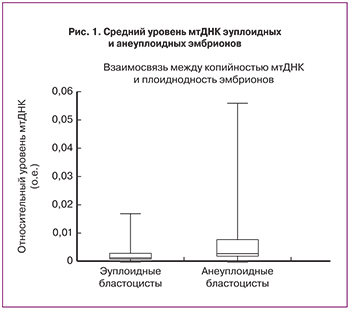 При проведении оценки уровня мтДНК в трофэктодерме бластоцист методом ПЦР-РВ было выявлено, что среди анеуплоидных эмбрионов (n=38) уровень мтДНК был статистически выше, чем в трофэктодерме эуплоидных бластоцист (n=68) (р=0,003) (рис. 1).
При проведении оценки уровня мтДНК в трофэктодерме бластоцист методом ПЦР-РВ было выявлено, что среди анеуплоидных эмбрионов (n=38) уровень мтДНК был статистически выше, чем в трофэктодерме эуплоидных бластоцист (n=68) (р=0,003) (рис. 1).
Кроме того, была рассмотрена взаимосвязь между уровнями мтДНК в образцах трофэктодермы бластоцист и возрастом женщин во время прохождения программы ЭКО/ИКСИ + ПГТ-А. Выявлена положительная корреляция относительного уровня мтДНК в трофэктодерме эмбрионов с возрастом пациенток (р=0,0038) (рис. 2).
Важно отметить, что в нашем исследовании копийность мтДНК изменялась с возрастом, как в трофэктодерме эуплоидных, так и анеуплоидных эмбрионов (рис. 3).
 На данном этапе исследования не было выявлено корреляции между уровнем мтДНК в трофэктодерме бластоцист и их морфологической оценкой. Аналогичным образом не выявлено статистически значимых различий между копийностью мтДНК трофэктодермы и морфологической оценкой трофэктодермы согласно классификации Гарднера. Также, не наблюдалось существенных различий в уровнях мтДНК между эмбрионами мужского и женского пола.
На данном этапе исследования не было выявлено корреляции между уровнем мтДНК в трофэктодерме бластоцист и их морфологической оценкой. Аналогичным образом не выявлено статистически значимых различий между копийностью мтДНК трофэктодермы и морфологической оценкой трофэктодермы согласно классификации Гарднера. Также, не наблюдалось существенных различий в уровнях мтДНК между эмбрионами мужского и женского пола.
Учитывая полученные результаты, можно сделать предположение, что бластоцисты с повышенными уровнями мтДНК, либо испытывают некоторую форму клеточного стресса и требуют дополнительной энергии, либо увеличение митохондрий и мтДНК представляет собой компенсационный механизм, запускающийся при нарушении функционирования существующих митохондрий, в связи с накоплением мутаций в митохондриальном геноме. Представленные данные согласуются с гипотезой о роли митохондриального биогенеза в имплантационном потенциале эмбрионов. Гипотеза «тихого эмбриона», предложенная Leese (2002), предполагает, что жизнеспособный эмбрион имеет относительно низкий или «тихий метаболизм», в то время, как эмбрионы, находящиеся под влиянием стресса и со сниженным потенциалом развития, как правило, метаболически более активны [23].
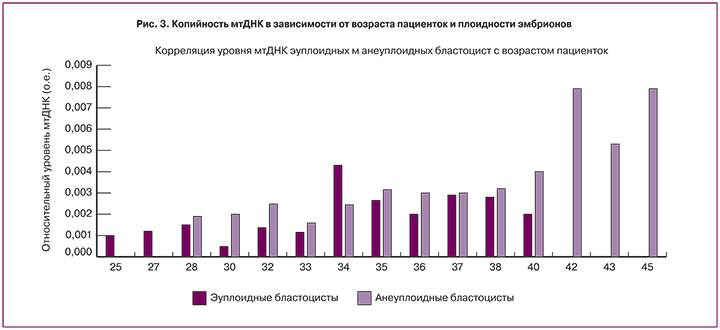
Группа авторов Fragouli E. et al. (2015, 2017) в своих исследованиях выявили связь между потенциалом к имплантации и уровнем мтДНК в трофэктодерме бластоцист [11,16]. Изначально был установлен пороговый уровень мтДНК в 0,003 о.е., выше которого не наблюдалась имплантация эмбрионов в полость матки. Позднее, в связи с изменением технологии исследования (заменой системы ПЦР-РВ StepOne (ThermoFisher), на аппарат Viia7 ПЦР-РВ (ThermoFisher)), был определен новый пороговый уровень 0,0004 о.е., позволяющий определить имплантационный потенциал эмбриона. В нашем исследовании также удалось определить порог копийности мтДНК – 0,004 о.е, превышение которого предвещало неудачу имплантации с чувствительностью 76,8% и специфичностью 74,9%. Разные величины порогового значения, по всей видимости, зависят от технологии определения относительного уровня мтДНК. Так, в нашем исследовании в ПЦР-РВ использовались специально разработанные олигонуклеотиды и TaqMan-пробы для амплификации и количественного определения специфического фрагмента мтДНК (ген MT-ND2 mitochondrially encoded NADH dehydrogenase 2), нормировка осуществлялась на геномную ДНК (ген LTC4S – leukotriene C4 synthase). В исследованиях Fragouli E. et al. (2015, 2017) использовался специально разработанный TaqMan-анализ (AATTTAACTGTTAGTCCAAAGAG, Life Technologies) для выявления и амплификации специфического фрагмента мтДНК (митохондриальной 16S рибосомальной РНК-последовательности), нормировка осуществлялась на мультикопийную последовательность Alu (AGCTACTCGGGAGGCTGAAGGCAGGA, Life Technologies). Тем не менее, по данным всех предыдущих исследований эмбрионы с надпороговыми значениями копийности мтДНК имеют низкий имплантационный потенциал. Кроме того, по данным ряда авторов, в трофэктодерме анеуплоидных эмбрионов уровень мтДНК значительно выше, чем эуплоидных [11, 12, 22], что согласуется с результатами нашего исследования. Так, средние относительные уровни мтДНК статистически значимо выше в трофэктодерме анеуплоидных эмбрионов, по сравнению с эуплоидными (р=0,003).
Далее, в ходе исследования была изучена взаимосвязь между количеством мтДНК и возрастом пациенток. Наши данные расходятся с результатами Santos M. et al. (2017), которые не выявили статистически значимой связи между копийностью мтДНК и возрастом пациенток, но сами авторы отмечают отсутствие охвата широких возрастных диапазонов (38,8±3,2 лет) [12]. Наши результаты свидетельствуют о положительной корреляции копийности мтДНК и возраста пациенток (р=0,0038). Это является подтверждением гипотезы, выдвинутой коллективами авторов Fragouli E. et al. (2015, 2017) и Ravichandran K. et al., (2017), которая заключается в том, что у пациенток позднего репродуктивного возраста может иметь место компенсаторное увеличение уровня мтДНК в связи с наличием возрастного накопления мутаций в митохондриальном геноме [11, 16, 17].
Кроме того, мы не нашли связи между уровнем мтДНК и морфологическим качеством эмбрионов, в то время как Santos M. et al. (2017) выявили положительную связь между копийностью мтДНК в клетках трофэктодермы и морфологической оценкой бластоцист. По результатам исследования уровень мтДНК статистически ниже в бластоцистах «отличного» и «хорошего» качества по классификации Гарднера [12, 21].
Большинство хромосомных аномалий происходят из-за ошибок, возникающих в процессе оогенеза (мейоза), но нарушение сегрегации хромосом также часто встречаются в течение первых клеточных делений после оплодотворения (митотическое деление) [24]. Однако, причины высоких уровней ошибок мейоза и митоза все еще до конца не изучены. Исходя из полученных данных, можно сделать предположение, что изменение количества или функциональности мтДНК может иметь влияние на точность сегрегации хромосом.
Заключение
Таким образом, исходя из результатов нашего исследования, определение копийности мтДНК в трофэктодерме бластоцист в совокупности с проведением ПГТ эмбрионов является надежным методом селекции эмбрионов с высоким имплантационным потенциалом, который позволяет увеличить эффективность лечения бесплодия в программах ЭКО.



