Врожденные пороки развития (ВПР) по-прежнему остаются одной из наиболее частых причин перинатальной заболеваемости и смертности. В структуре врожденной патологии плода аномалии развития мочевыделительной системы (МВС) занимают одно из лидирующих мест, при этом их доля, согласно данным отдельных авторов, может достигать 36% [1, 2].
Среди последних частота различных вариантов обструктивных уропатий (ОУ) составляет от 40 до 87% [3]. В зависимости от степени выраженности и уровня обструкции формирующиеся при данной патологии анатомические особенности отличаются значительной вариабельностью и в тяжелых случаях характеризуются диспластическими изменениями гломерулярного аппарата почки, канальцев и мелких паренхиматозных сосудов, приводя к нефрогенной гипертонии и почечной недостаточности. Так, по сведениям Первого Российского регистра, хроническая почечная недостаточность, требующая проведения диализа, наблюдается у 65% детей с ВПР МВС [4]. Высокая распространенность указанных пороков, тяжесть их осложнений, бессимптомное течение и низкая частота клинической диагностики, не достигающая 25% у детей до года и 55% – до 5 лет, предъявляют высокие требования к пренатальному выявлению патологически сформированной МВС.
 Одним из методов диагностики и прогнозирования течения заболеваний почек является ультразвуковое исследование. Неинвазивная, точная, возведенная в ранг обязательной составляющей протокола скриннинговых обследований беременных, начиная с первого триместра, эхография позволила поднять на качественный иной уровень современную пренатальную диагностику пороков развития МВС.
Одним из методов диагностики и прогнозирования течения заболеваний почек является ультразвуковое исследование. Неинвазивная, точная, возведенная в ранг обязательной составляющей протокола скриннинговых обследований беременных, начиная с первого триместра, эхография позволила поднять на качественный иной уровень современную пренатальную диагностику пороков развития МВС.
Сегодня не вызывает сомнений важность изучения ангиоархитектоники с помощью цветового допплеровского картирования, особенно для оценки функционального состояния почек, в том числе и при наличии различной степени и локализации обструктивного поражения органов МВС.
Новым инструментом для изучения состояния тканевого и органного кровотока является трехмерная (3D) допплерографическая ангиография. Она не только позволяет оценить структуру и распределение сосудистого русла, но и с помощью сигнала энергетического допплера предоставляет объективную количественную информацию о состоянии его кровотока. Диапазон медицинского применения данной технологии достаточно обширен, что подтверждает рост числа публикаций последних лет [5–7].
В настоящее время для количественной оценки доплеровского сигнала предложено несколько компьютерных программ. Одной из наиболее широко используемых в клинической практике, в том числе в акушерстве и гинекологии, является программа «Гистограмма объекта». Приложение VOCAL (Virtual Organ Computeraided AnaLysis) позволяет виртуально провести компьютерный анализ исследуемого органа в режиме трехмерных изображений. Количественная оценка относительной доли цветовых пикселов и интенсивности их сигнала в пределах области исследования достигается с помощью представленных в приложении определенных алгоритмов [8].
Известно, что для ОУ характерно, наряду с поражением паренхимы почки и уменьшением количества нефронов, изменение ее васкуляризации. Последнее может быть подтверждено посредством 3D-допплерографической ангиографии, что имеет важное прогностическое значение в пренатальной диагностике уропатий.
Цель данного исследования заключалась в оценке роли трехмерной допплерографической ангиографии в изучении почечной гемодинамики плодов с отсутствием каких-либо пороков и при обструктивных уропатиях.
Материал и методы исследования
Исследование выполняли на базе отделений функциональной диагностики и хирургии, реанимации и интенсивной терапии новорожденных ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России в период с 2011 по 2012 год. Критериями включения в исследование были: одноплодная беременность в сроке от 20 до 40 недель, отсутствие у беременной экстрагенитальной патологии и отягощенного акушерско-гинекологического анамнеза. В основной группе у 45 плодов с антенатально выявленными ОУ (с увеличением переднезаднего размера лоханки (ПЗРЛ) более 7 мм) проанализированы степень расширения чашечно-лоханочного комплекса (ЧЛК), состояние кровотока в почечной артерии и параметры 3D-допплерографической ангиографии. Аналогичные исследования проведены в контрольной группе у 45 здоровых плодов с отсутствием каких-либо пороков развития. Критерии исключения – отказ пациентов от исследования и/или невозможность наблюдения.
Проведение исследования двумя независимыми специалистами отделения функциональной диагностики Центра придавало объективность пренатальному ультразвуковому диагнозу. Обследование беременных проводили на ультразвуковом приборе Voluson-Е8 (General Electric, США) с использованием трансабдоминального конвексного мультичастотного датчика 4–8 МГц. Для исключения влияния разных технических условий настроек ультразвуковой системы при проведении каждого последующего исследования устанавливались одни и те же параметры: Persistence-2; Line filter-Low; Contrast-9; Enhance-2; Reject-0; Quality-normal; Harmonic frequency-high; Smooth-5/7; Frequency- low; Ensemble-13; Flow resistance- Middle 1; Line density-5; PD Map-5; Balance gray-225; Artifact-on; Line filter-off; Quality-normal; WMFlow 1; PRF-0.6 Khz.
В процессе обследования проводились линейные измерения размеров почек. Состояние кровотока в почечной артерии с помощью импульсной допплерометрии последних характеризовалось спектром допплеровских кривых, отражающих систоло-диастолическое соотношение (С/Д), пульсационный индекс (ПИ) и индекс резистентности (ИР).
При использовании приложения VOCAL «Гистограмма объекта» оценивались следующие сосудистые индексы: индекс васкуляризации (Vascularisation Index (VI)), отражающий относительную долю цветовых вокселов в зоне интереса, индекс потока (Flow Index (FI)), учитывающий их среднюю интенсивность сигнала, индекс васкуляризации потока (Vascularisation Flow Index (VFI)), представляющий собой сочетание двух вышеуказанных измерений (рис. 1 и 2 см. на вклейке).
В комплекс обследования новорожденных входили общие клинические исследования, для оценки функции почек применялась магниторезонансная томография с констрастированием.
Полученные данные были обработаны методами описательной статистики и представлены в виде среднего стандартного отклонения, а также с использованием программ Excel (Microsoft Office 2007) и STATISTICA 6 (StatSoft). Математические методы обработки данных включали статистический и корреляционный анализы. Для определения значимости различий сопоставляемых величин использовали Kruskal–Wallis ANOVA тест и χ2-тест. За уровень статистической достоверности принималось значение коэффициента Пирсона менее 0,05.
Результаты исследования
При обследовании 45 плодов основной группы (с 59 измененными почками) одностороннее поражение почки констатировано у 29 (64,4%), двустороннее – у 16 (35,6%). В зависимости от степени расширения ПЗРЛ все почки были распределены на три группы (табл. 1).
Как видно из представленных в табл. 1 данных, более чем в 1/3 наблюдений у плодов с ОУ отмечалось существенное расширение ПЗРЛ и, соответственно, значительное истончение паренхимы.
Особенностью ангиоархитектоники почек у плодов с выраженной обструкцией мочевыводящих путей (ПЗРЛ более 15 мм) при использовании режима энергетического допплеровского сканирования было значительное обеднение кровотока в паренхиме, о чем свидетельствовала невозможность визуализации сосудов в паренхиме, прилегающей к капсуле. При этом «сосудистое дерево» характеризовалось смещением сегментарных и междолевых его ветвей за счет расширения элементов собирательной системы (рис. 3 см. на вклейке).
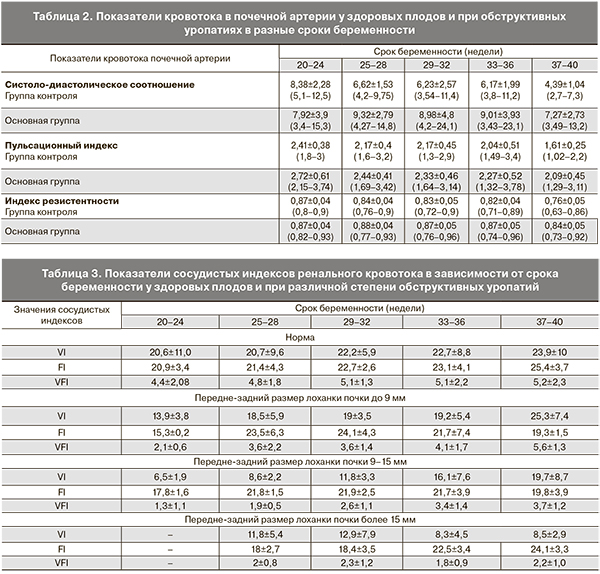
 При изучении показателей кровотока в почечной артерии при помощи импульсно-волновой допплерометрии было установлено повышение систоло-диастолического отношения (С/Д), пульсационного индекса (ПИ) и индекса резистентности (ИР) у плодов основной группы по сравнению с группой контроля. Статистически значимые различия данных значений в исследуемых группах установлены начиная с 25 недель беременности (р<0,05). Причем эти различия изменялись со сроком беременности и были наиболее выражены в третьем триместре (табл. 2).
При изучении показателей кровотока в почечной артерии при помощи импульсно-волновой допплерометрии было установлено повышение систоло-диастолического отношения (С/Д), пульсационного индекса (ПИ) и индекса резистентности (ИР) у плодов основной группы по сравнению с группой контроля. Статистически значимые различия данных значений в исследуемых группах установлены начиная с 25 недель беременности (р<0,05). Причем эти различия изменялись со сроком беременности и были наиболее выражены в третьем триместре (табл. 2).
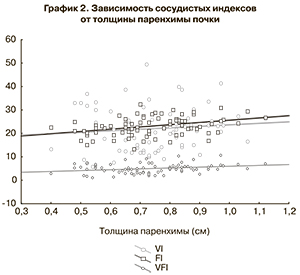
По данным корреляционного анализа, на значения показателей кровотока в почечной артерии у плодов с ОУ оказывали влияние выраженность расширения ЧЛК и толщина сохраненной паренхимы почки (р<0,01). Указанная закономерность продемонстрирована на графике 1 на примере показателей ИР.
При оценке данных, полученных с помощью ЗD-допплерографической ангиографии сосудов почек плодов контрольной группы, была установлена прямая зависимость показателей индекса васкуляризации (VI), индекса потока (FI) и индекса васкуляризации потока (VFI) от срока беременности (табл. 3), объема почки и толщины паренхимы (р<0,01) (график 2). В то же время у плодов с ОУ значения VI и VFI были значительно снижены по сравнению с таковыми в контрольной группе (p<0,01) (табл. 3).
Результаты проведенного анализа свидетельствовали о том, что между значениями сосудистых индексов (VI и VFI), характеризующих ренальную гемодинамику плодов с ОУ, и степенью расширения ЧЛК существует взаимосвязь (р<0,01), представленная в табл. 3. Как наглядно демонстрируют данные, приведенные в указанной таблице, показатели индексов VI и VFI уменьшались при увеличении ПЗРЛ почек. При этом, несмотря на статистически достоверное различие значений индекса FI в основной и контрольной группах, корреляционный анализ констатировал отсутствие взаимосвязи данного индекса и анатомических особенностей пораженной почки.
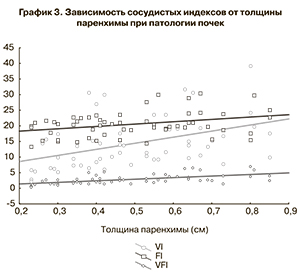
С помощью корреляционного анализа выявлена прямая зависимость сосудистых индексов от толщины сохраненной паренхимы почек при ОУ (график 3).
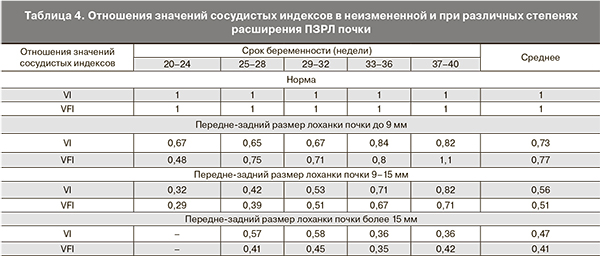
Так как на значения сосудистых индексов большое влияние оказывают настройки ультразвуковой системы, нами было предложено для оценки гемодинамики почки плода использовать отношения значений данных индексов, измеренных в норме и при ОУ, что представлено в табл. 4.
На примере приведенных в табл. 4 отношений показателей сосудистых индексов наглядно продемонстрирована четкая зависимость степени нарушения почечной гемодинамики от выраженности обструкции мочевыводящих путей. Так, при незначительном – I степени расширения ПЗРЛ (до 9 мм) показатели индексов VI и VFI снижались в меньшей степени – в 1,3 раза. Умеренная – II степень расширения (от 9 до 15 мм) характеризовалась более выраженным снижением значений индексов: VI – в 1,8 раза, а VFI – в 2 раза. Самые низкие показатели отношений сосудистых индексов наблюдалось при крайней – III степени расширения ПЗРЛ (более 15 мм), а именно: индекс VI – в 2,1 раза, а индекс VFI – в 2,4 раза.
Таким образом, проведенный анализ показал, что при ОУ увеличение размеров ЧЛК и сдавление паренхимы сопровождалось изменением внутриорганной ангиоархитектоники и, соответственно, ее гемодинамики, что, в свою очередь, проявлялось снижением индексов VI и VFI.
Обсуждение
Врожденные пороки МВС относятся к наиболее часто выявляемым при ультразвуковом исследовании, чему способствует, с одной стороны, их высокая распространенность, а с другой – анатомические особенности пораженного органа, относительно облегчающие эхографическую визуализацию последних [1].
Постоянное совершенствование эхографических методик и появление приборов экспертного класса позволяют с высокой степенью достоверности предоставить более детальную характеристику анатомических структур плода. К числу последних относятся различные режимы 3D/4D сканирования, нашедшие в последнее время широкое применение. Кроме того, возможность осуществления архивирования полученных с помощью 3D-сканирования данных существенно повышает ценность указанных методик [9].
Так, по данным Y.Y. Hsieh и соавт. (2000), трехмерная эхография предоставляет возможность четко оценить соотношение неизмененной и поврежденной почечной ткани при обструктивных уропатиях, кистозных дисплазиях почки и других ВПР [10].
Как известно, прогноз при поражении органов МВС, диагностируемых антенатально, зависит от сохранения функции почек. В этой связи одной из важнейших составляющих комплексной пренатальной ультразвуковой оценки МВС плода является изучение становления кровообращения его почек при отсутствии каких-либо изменений и в условиях формирующегося патологического процесса.
 Наблюдаемая в ряде случаев при обструкции мочевыводящих путей атрофия паренхимы почки реализуется нарушением ее васкуляризации, степень выраженности которой позволяет визуально оценить использование энергетического допплеровского картирования. Так, в ходе нашего исследования у плодов с выраженной обструкцией мочевыводящих путей (ПЗРЛ более 15 мм) в большинстве случаев (17 из 21) в режиме ЦДК отмечалось существенное обеднение кровотока в паренхиме почки. Сосудистый рисунок при этом не прослеживался до капсулы, сегментарные и междолевые ветви были раздвинуты расширенными элементами собирательной системы. Аналогичные результаты были получены в исследовании Е.В. Юдиной и соавт. [11].
Наблюдаемая в ряде случаев при обструкции мочевыводящих путей атрофия паренхимы почки реализуется нарушением ее васкуляризации, степень выраженности которой позволяет визуально оценить использование энергетического допплеровского картирования. Так, в ходе нашего исследования у плодов с выраженной обструкцией мочевыводящих путей (ПЗРЛ более 15 мм) в большинстве случаев (17 из 21) в режиме ЦДК отмечалось существенное обеднение кровотока в паренхиме почки. Сосудистый рисунок при этом не прослеживался до капсулы, сегментарные и междолевые ветви были раздвинуты расширенными элементами собирательной системы. Аналогичные результаты были получены в исследовании Е.В. Юдиной и соавт. [11].
Импульсно-волновая допплерометрия предоставляет возможность получить объективную информацию о гемодинамике почек [12]. В процессе проведенного исследования плодов контрольной группы установлена обратно пропорциональная зависимость показателей кровотока (С/Д, ПИ и ИР) от срока беременности, а также объема почки и толщины ее паренхимы (р<0,01). Полученные данные также согласуются с результатами G. Haugen и соавт. [13].
При ОУ показатели С/Д, ПИ и ИР отличались от таковых, полученных при обследовании контрольной группы. Общеизвестно, что расширение ЧЛК при ОУ сопровождается сдавлением и истончением паренхимы и, соответственно, нарушением ренальной гемодинамики. Как показали результаты проведенного нами исследования, последняя выражалась в повышении значений допплерометрических показателей С/Д, ПИ и ИР (р<0,01). При этом статистическая достоверность указанных различий показателей в основной и контрольной группах выявлялась начиная с 25 недель беременности (р<0,05). Причем эти отличия строго коррелировались со сроком и были наиболее выражены в третьем триместре беременности.
Неоценимую помощь в объективизации информации, отражающей функциональные особенности патологически измененного органа, играет трехмерная допплерографическая ангиография. Последняя позволяет детально охарактеризовать структуру органа и распределение в нем сосудистого русла. Наряду с этим возможна и количественная оценка данных энергетического допплера, которая способствует получению объективной информации о состояние кровотока. Так, в эксперименте на животных O. Morel и соавт. (2010) обнаружили линейную зависимость между сосудистыми индексами и реальным кровотоком в котиледоне плаценты [14]. В публикациях, посвященных применению 3D-допплерографической ангиографии, имеются сообщения об улучшении диагностики ряда патологических состояний, а именно, заболеваний печени, новообразований различной локализации и оценки перфузии эндометрия [15, 16]. Кроме того, получаемая с помощью 3D-ангиографии информация значительно расширила наши представления об отдельных патофизиологических механизмах таких патологических состояний в акушерской практике, как синдром задержки роста плода, преэклампсия, а также некоторых врожденных пороков развития [17, 18].
В процессе данного исследования на основании применения трехмерной допплерографической ангиографии определены нормативные значения, характеризующие почечную гемодинамику у здоровых плодов. При этом была продемонстрирована прямо пропорциональная зависимость показателей сосудистых индексов (VI, FI и VFI) от срока беременности, объема почки, а также толщины ее паренхимы (р<0,01). Вместе с тем установлены особенности ренального кровотока при ОУ. Так, было установлено, что при изучаемой патологии значения сосудистых индексов оказались достоверно снижены вне зависимости от срока беременности (p<0,01).
При этом необходимо отметить, что при отсутствии значимых изменений показателей FI снижение в большей степени касалось сосудистых индексов VI и VFI. Данные изменения носят вполне закономерный характер, так как нарушения при ОУ отражают результат сдавления паренхимы увеличенным ЧЛК, что в свою очередь приводит к патологической гемодинамике, проявляющейся снижением индексов VI и VFI. В ходе проведенного корреляционного анализа на выраженность нарушения васкуляризации обнаружено влияние степени расширения ЧЛК, его объема, а также толщины сохраненной паренхимы почки (р<0,01) При использовании 3D-ангиографии нам приходилось учитывать ряд ограничений и широкий спектр факторов, имеющих непосредственное влияние на показатели сосудистых индексов. Мы также учитывали опыт T. Jansson и соавт., изложенный в детальном обзоре, посвященном изучению состоянию кровотока, связанному с количественной оценкой сигналов энергетического допплера [19].
В исследовании in vitro N.J. Raine-Fenning и соавт. продемонстрировали зависимость сосудистых индексов от объема потока, «затухания», вариабельности концентрации крови и степени васкуляризации [20]. L.S. Bernardes с соавт. указывали на связь сосудистых индексов от расстояния между датчиком и контрольным объемом [21]. Значимость данного фактора также подчеркивается в исследованиях in vitro и на экспериментальных биологических моделях [14, 21].
В связи с этим в нашем исследовании для получения достоверных результатов наравне с использованием стандартизированных параметров и соответствующей калибровки также учитывался указанный выше фактор.
В процессе расчета сосудистых индексов объем расширенной чашечно-лоханочной системы (анэхогенное изображение) вычитался из общего объема для анализа васкуляризации, и указанные индексы рассчитывались только для паренхимы почки (эхогенное изображение). Следовательно, можно предположить, что этим было достигнуто минимальное влияние объема расширенной ЧЛС на показатели VI, FI и VFI.
С этой же целью нами предложено использовать для оценки гемодинамики почки отношение значений данных индексов, измеренных в неизмененной почке и при ОУ. Данная методика применялась нами при односторонней обструкции мочевыводящих путей – измерялись показатели 3D-ангиографии как в неизмененной, так и в пораженной почках. Полученные при этом результаты наглядно отражают взаимосвязь степени нарушения почечной гемодинамики в зависимости от выраженности обструкции мочевыводящих путей. Так, при расширении ПЗРЛ до 9 мм индексы VI и VFI снижались в 1,3 раза, при расширении от 9 до 15 мм индекс VI – в 1,8 раз, а индекс VFI – в 2 раза. Наибольшая степень снижения показателей сосудистых индексов наблюдалась при расширении ПЗРЛ более 15 мм, а именно: VI – в 2,1 раза, а VFI – в 2,4 раза.
Кроме того, необходимо отметить, что у плодов с выраженным гидронефрозом, у которых после рождения было выявлено снижение функции почки, сосудистые индексы были значительно уменьшены по сравнению с показателями у плодов как с умеренным гидронефрозом, так и в группе сравнения.
Вышесказанное свидетельствует, что применение указанных выше сосудистых индексов является более объективным методом, отражающим состояние почечной гемодинамики в антенатальном периоде при данном виде ВПР МВС.
Дальнейшее накопление перманентных наработок в использовании 3D-ангиографии будет способствовать повышению степени достоверности прогнозирования функции почек в постнатальном периоде у новорожденных и с умеренно выраженными ОУ.
Таким образом, широкое применение в повседневной клинической практике перинатальных центров разработанных объективных критериев нарушения почечного кровотока при ОУ позволит оптимизировать тактику ведения беременности и лечебных подходов у новорожденных с данным видом аномалий МВС.